skan0264

Elektrochemia 267
m
A
nF
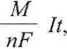
(6.9)
gdzie A (M) oznacza masę atomową (molową), n - liczbę elektronów biorących udział w reakcji elektrodowej, F - stałą Faradaya, Q - ładunek [C], /- natężenie prądu [A], t - czas trwania elektrolizy [s].
Przykład 6.2. W kąpieli cyjano-srebrowej pokrywano wyrób mosiężny o powierzchni całkowitej 0,36 nr antykorozyjną warstwą srebra, przepuszczając prąd o natężeniu 1,35 A. Obliczyć czas trwania elektrolizy dla uzyskania warstwy srebra o grubości 25 pm. Gęstość srebra wynosi 10,5 g em-3.
Rozwiązanie. Dla uzyskania warstwy srebra o grubości / = 25 • 10-6 m objętość srebra musi być równa
V = A! = 0,36 -25-10'6 = 9 -10-6 m3,
jego masa zaś
m = dV = 10,5 • 9 • 10-6 = 94,5 g.
Czas elektrolizy t, obliczony z prawa Faradaya (6.9), wynosi
mvF
MI
94,5 • 96485 107,87 • 1,35
= 62212 s = 17 h 23 min 32 s. ■
Opór roztworu elektrolitu, R [Q], zawartego między elektrodami odległymi o / [m] o efektywnej powierzchni A [m2] określa II prawo Ohma:
= P ~7 ~ — k, (6.10)
A K
gdzie p oznacza oporność właściwą [O • m], k - przewodność elektrolityczną, [O-1 • irT1], k - stałą naczynka [m-1].
Przewodność elektrolityczna k jest to przewodnictwo kostki roztworu o objętości jednostkowej [m3]. Inną miarą przewodnictwa jest przewodność molowa A:
A = kV= - [£> 1 • m2 • mol 1 = S • m2 ■ mol ]], (6.11)
1000 • c
gdzie Voznacza objętość roztworu, w której zawarty'jest 1 mol elektrolitu [m3 • • mol-1], c zaś jest stężeniem molowym, jak zwykle w [M], Ze względu na wygodę zapisu symbol CT1 (om-1) jest zastępowany coraz częściej przez S (simens).
W dawnej literaturze przewodność elektrolityczną wyrażano wyłącznie w [£2-1 • cm-1]. Przy stężeniu molowym, jak zazwyczaj, w [M], wzór (6.11) przyjmował postać
Wyszukiwarka
Podobne podstrony:
skan0036 (3) Stany skupienia materii 39 gdzie M oznacza masę cząsteczkową (kg • mol-1), a - napięcie
skanowanie0064 gdzie n jest koncentracją atomów, k - stała Boltzmana.11. Iloczyn skalarny dwóch wekt
gdzie (A,Z) oznacza jądro o liczbie masowej A i atomowej Z. Ze spełnienia praw zachowania wynika rel
skan0288 Elektrochemia 291 Elektrochemia 291 Ks = [Pb2+][F-]2(2) gdzie [F ] = 2c + cs. Zatem c, rozp
skan0274 Elektrochemia 277 Tak więc termin „współczynnik aktywności elektrolitu” oznacza w istocie y
skan0278 Elektrochemia 281 lg y± = -A z+zJj^I 1 +Bayfr ’ (6.39) gdzie stała A jest określona wzorem
więcej podobnych podstron