skanowanie0009

elektronów atom (jon) metalu. Każdy atom centralny może przyłączać pewną liczbę ligandów - liczba ta jest nazywana liczbą koordynacyjną (LK).
Nazwę kompleksu tworzy się dodając do nazwy jonu centralnego przedrostki określa-i jące liczbę i rodzaj ligandu (tab. 3).
Tabela 3. Nazwy i wzory często spotykanych ligandów
|
Nazwa ligandu |
Wzór ligandu |
|
amina |
NH, |
|
akwa |
m |
|
bromo |
Br |
|
chloro |
ci- |
|
cyjaniano |
CNO- |
|
cyjano |
CN- |
|
fluoro |
F- |
|
hydrokso |
OH- |
|
karbonyl |
CO |
|
okso |
o2- |
|
tio |
s2- |
|
tiocyjaniano |
CNS- |
|
tiosiarczano |
SĄ2' |
Wiele jonów metali tworzy z amoniakiem trwałe jony kompleksowe. Jest to praktycz^ nie wykorzystywane do rozpuszczania w roztworze amoniaku trudno rozpuszczalnych osadów wodorotlenków lub soli tych metali. Na przykład jony Cu2+. w środowisku zasadowym wytrącają się w postaci trudno rozpuszczalnego osadu Cu(OH). Jeżeli zamiast; wodorotlenku sodu użyje się wodnego roztworu amoniaku, w pierwszym momencie utworzy się taki sam osad Cu(OH)2, lecz po dodaniu większej ilości roztworu amoniaku osad rozpuści się, dając klarowny roztwór o głębszej i bardziej intensywnej barwie niebieskiej niż pierwotny roztwór. Przyczyną rozpuszczania osadu jest reakcja kompleksowania jonów miedzi(II) i utworzenie jonów tetraaminamiedzi(II) [Cu(NH3) ]2+:
Cu2+ + 4 NH3 [Cu(NH3)J2+
Jony te są trwalsze od występujących w roztworze wodnym uwodnionych jonów mie-dzl(H) [Cu(H20)J2+ (w powyższym równaniu reakcji skrótowo zapisanych jako Cu2+). Podobne zjawisko obserwuje się podczas rozpuszczania trudno rozpuszczalnego chlorku srebra AgCl w wodnym roztworze amoniaku, kiedy to powstaje jon diaminasrebra -| Ag(NH3)2]+. Dzięki trwałości jonu tetrachlorozłocianowego(III) [AuClJ", złoto roztwarza tlę w wodzie królewskiej, będącej mieszaniną stężonych kwasów azotowego(V) i solnego. Złoto nie roztwarza się w widoczny sposób w tych kwasach użytych oddzielnie.
Każdy związek kompleksowy posiada charakteryzującą go stałą trwałości równą stałej równowagi reakcji tworzenia kompleksu:
M + nL^± [MLJ
gdzie: M - atom (jon) metalu,
L - Ugand.
Wflżną cechą związków kompleksowych jeit ich barwit, szczególnie charakterystyczna tllit połączeń metali bloku d. Większość jonów tych metali w roztworze wodnym tworzy itkwtikompleksy (jony uwodnione, hydraty), trwałe nawet po odparowaniu wody z roz-Iwui u. Często w takich roztworach obserwuje się wymianę ligandów połączonych z dartym Jonem centralnym - np. cząsteczek wody na cząsteczki amoniaku - prowadzącą do rtrtWHlunlu kompleksu o większej trwałości i innym zabarwieniu niż związek wyjściowy.
I y po we Ugandy są prostymi cząsteczkami mogącymi przyłączać się do atomu central-H0||o Jednym wiązaniem koordynacyjnym (np. H20, NH3, CN"). Niektóre Ugandy mogą jednak dostarczać kilku par elektronowych i tworzyć kilka wiązań z atomem centralnym, lit kle Ugandy nazywa się chelatowymi lub kleszczowymi (rys. 7).

II1% 7, l.lgandy dwukoordynacyjne
I'i zykładem ligandu chelatowego jest kwas etylenodiaminotetraoctowy (EDTA) uży-WMny w analizie kompleksometrycznej. Jest to Ugand sześciokleszczowy tworzący wyjątkowo I r wałe kompleksy, także z metalami bloku s, które z reguły nie są chętne do tworze-lilti lego typu połączeń (rys. 8).
O
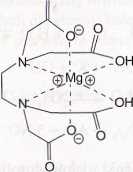
O
My«. M, Kompleks dianionu kwasu EDTA z jonem Mg2*
2.1.6. Reakcje egzo- i endoenergetyczne
l< ca keje egzoenergetyczne to reakcje, w których energia jest przekazywana z układu reagującego do otoczenia. Szczególnym przypadkiem takich reakcji są reakcje egzotermiczne (zmiana entalpii AH < 0), w których przekazywana jest tylko energia w postaci drpk
Ueitkcje endoenergetyczne przebiegają z pochłonięciem energii przez układ reagujący; w reakcjach endotermicznych (AH > 0) pochłaniane jest tylko ciepło.
Wyszukiwarka
Podobne podstrony:
4. Każdy Uczestnik Konkursu może nadesłać dowolną liczbę Filmów. 5. Do Konkursu mogą zostać zgłoszon
DSCN4162 atom centralny + Ugand = kompleks [akceptor elektronów) (donor elektronów
Marcin Sieńczyk Załącznik 2 ryny na elektrofilowy atom fosforu inhibitora (Rys.2).9 Struktura estrów
IMAG0179 (3) SW4S wewnętrzna sfera koordynacji - tworzy ją atom centralny wraz z fioandamt koordynac
SDC10357 H ładunku elektrycznego. Cząsteczki wody otaczają każdy jon lub polarną cząsteczkę
skanowanie0005 (8) BoEkOWA ATOM o sklacUitkC Jć^dfcL 3)vryu£x-^€^so ~ k)0KU3OUV Nb^lMN^! ! i ; 1
Budowa atomuBUDOWA ATOMU /----JADRO N ^ATOMOWE__/ CpROTON^> <NEllTRON^> (ELEKTRON)ATOM WOD
DSC02934 (3) stów — wplątana zostaje w grę, każdy nieledwie jej atom stanowić może bądź to materialn
DSCN4165 [CoiHzOMCI, chlorek sześć loakwakobałtu(ll) wewnętrzna sfera koordynacji - tworzy ją atom c
P1100184 Rys. 19.1. Schcinac wzbudzenia atomu;a. b) fotonem, c) elektronem, d) atom wzbudzony pn*. c
Wiązania i hybrydyzacja Zadanie 239 (3 pkt) Ile wolnych par zachowuje atom centralny w podanej cząst
więcej podobnych podstron