6771814990
Marcin Sieńczyk Załącznik 2
ryny na elektrofilowy atom fosforu inhibitora (Rys.2).9 Struktura estrów diarylowych kwasów 1-aminoalkilofosfonowych jest analogiczna do stanu przejściowego reakcji hydrolizy wiązania pep-tydowego katalizowanej przez enzymy proteolityczne. Dodatkowo, wprowadzenie do ich struktury N-końcowego łańcucha peptydowego istotnie zwiększa selektywność ich działania, pozwalając uzyskać inhibitor reagujący jedynie z docelową proteazą, nawet w przypadku kilku proteaz o pokrywającej się preferencji wobec reszty Pi inhibitora okupującej kieszeń Si (nomenklatura według Schechter i Berger10).
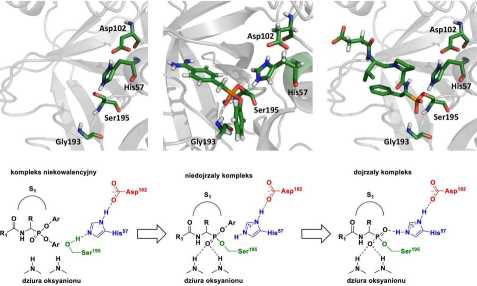
Rysunek 2: Mechanizm inhibicji proteaz serynowych przez aromatyczne estry kwasów 1-aminoalkilofosfonowych.11
Od odkrycia estrów diarylowych kwasów 1-aminoalkilofosfonowych i ich pierwszego zastosowania jako inhibitorów proteaz serynowych upłynęło już około 30 lat, i choć otrzymano wiele specyficznych inhibitorów tej klasy skierowanych wobec różnych proteaz serynowych (chymaza, uPA, trombina czy trypsyna), w literaturze opisano zaledwie kilka przykładów estrów diarylowych kwasów 1-aminoalkilofosfonowych jako inhibitorów katepsyny G czy neutrofilowej elastazy.8 Brak kompleksowych badań w tej dziedzinie przyczynił się do podjęcia prac badawczych skupiających się na otrzymaniu specyficznych i selektywnych inhibitorów CatG i HNE.
wes as specific inhibitors of serine otive site of papain; specific peptide i of protease control, Curr. Pharm.
J.C.: Amino acid o i Enzymology, 1994, 2 A.: On the active site of p inhibitors of papain. Biochem. Biophys. Res. Com 1 [H.13] Grzywa R., Sieńczyk M.: Phosphonic e Des., 2013, 19, 1154-1178.
10
Wyszukiwarka
Podobne podstrony:
Marcin Sieńczyk Załącznik 2 Rysunek 5: Wzory ogólne otrzymanych na drodze kondensacji wieloskładniko
Marcin Sieńczyk Załącznik 2 przyczyn śmierci na świecie.1 Zaobserwowano także, że neutrofilowa elast
Marcin Sieńczyk Załącznik 2Katepsyna G Bardzo interesującą z punktu widzenia specyficzności
Marcin Sieńczyk Załącznik 2 Wysoka zdolność związku 3 do inaktywacji katepsyny G oraz wysoka
Marcin Sieńczyk Załącznik 2 tygenów in vitro,17 podjęto próbę określenia roli katepsyny G w procesow
Marcin Sieńczyk Załącznik 2 dendrytyczne, mDCl) zastosowałem specyficzne inhibitory katepsyny G. W t
Marcin Sieńczyk Załącznik 2 W ramach kontynuacji podjętych badań dotyczących roli katepsyny G
Marcin Sieńczyk Załącznik 2 detekcji aktywnej katepsyny G w lizacie śledziony wołowej,23 potwierdzaj
Marcin Sieńczyk Załącznik 2 Rysunek 4: Niskocząsteczkowe sondy molekularne do detekcji neutrofilowyc
Marcin Sieńczyk Załącznik 2 Do niedawna w literaturze naukowej opisano zaledwie kilka przykładów
Marcin Sieńczyk Załącznik 2 która wykazała także prawie absolutną selektywność działania,
Marcin Sieńczyk Załącznik 2 Marcin Sieńczyk Załącznik 2 I Imię i Nazwisko: Marcin Sieńczyk H
Marcin Sieńczyk Załącznik 2 IV Wykaz osiągnięć naukowo-badawczych Tabela 1: Wykaz
Marcin Sieńczyk Załącznik 2 V Wskazanie osiągnięcia wynikającego z art. 16 ust. 2 ustawy z dnia 14 m
Marcin Sieńczyk Załącznik 2 H.6 Palesch D., Sieńczyk M.. Oleksyszyn J., Reich M., Wieczerzak E., Boe
Marcin Sieńczyk Załącznik 2 b) Omówienie celu naukowego/artystycznego ww. pracy/prac i osiągniętych
Marcin Sieńczyk Załącznik 2 Katepsyna G Proteinaza 3 NSP4 Rysunek 1: Struktura ludzkiej katepsyny G
skanuj0004 Rozpraszanie promieni X Promienie X rozpraszane są na elektronach Każdy rozpraszający ato
więcej podobnych podstron