6771814998
Marcin Sieńczyk Załącznik 2
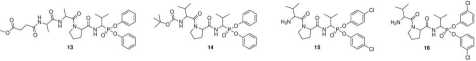
Do niedawna w literaturze naukowej opisano zaledwie kilka przykładów zastosowania fosfono-wych inhibitorów ludzkiej elastazy. Pierwszym z opisanych fosfonowych inhibitorów elastazy był fosfonowy tetrapeptyd MeO-Suc-Ala-Ala-Pro-Valp(OPh)2 (13, k0&s/I = 7 100 M-1s-1).8 Dwa lata później opisano bardziej aktywny inhibitor HNE — Boc-Val-Pro-Valp(OPh)2 (14, k0(,s/I = 27 000 M-1s-1), który jednocześnie wykazał absolutną selektywność działania wobec chymotryp-syny.8 Bardziej zaawansowane badania nad syntezą fosfonowych inhibitorów HNE dotyczyły określenia wpływu podstawnika chlorowego pierścienia fenylowego grupy estrowej na ich właściwości inhibitorowe.27 Najbardziej aktywny związek z tej grupy — H-Val-Pro-Valp(0-C6H4-4-Cl)2 (15) okazał się jednak około dwukrotnie słabszym inhibitorem HNE niż 14 (k„6S/I = 13 000 M_1s_1), natomiast zmiana położenia podstawnika chlorowego z pozycji 4 do 3 spowodowała około 2.5-krotnie obniżenie aktywności inhibitorowej (16, k0<,s/I = 13 000 M_1s_1). Wprawdzie opisane przez Boduszka i wsp. związki okazały się być słabymi inhibitorami HNE, to uzyskane wyniki dostarczyły bardzo istotnej informacji wskazującej, że odpowiednia modyfikacja struktury aromatycznych grup estrowych stanowi kolejny element, którym, oprócz wprowadzenia łańcucha polipeptydowego, można modulować aktywnością inhibitorową aminofosfonianów.
Przez kolejne kilkanaście lat nie odnotowano doniesień literaturowych na temat projektowania fosfonowych inhibitorów HNE. Brak kompleksowych badań w tym zakresie skłonił mnie do podjęcia prac, których nadrzędnym celem było zaprojektowanie i otrzymanie specyficznych i selektywnych fosfonowych inhibitorów elastazy. W pierwszym okresie prowadzonych prac zaprojektowałem serię prostych, Cbz-blokowanych pochodnych kwasów 1-aminoalkilofosfonowych o zróżnicowanej strukturze grup estrowych, co pozwoliło mi na określenie ich wpływu na aktywność inhibitorową otrzymanych związków.28 Spośród otrzymanych i przebadanych prostych, Cbz-blokowanych fosfonowych analogów Ala, Abu, Val, Leu, nVal oraz nLeu najsilniejsze właściwości inhibitorowe wobec elastazy wykazała pochodna Cbz-Valp(0-C6H4-4-C00CH3)2 (17, k2/K; = 33 015 M-1s-1),
27 Boduszek B., Brown A.D., Powers J.C.: alpha-Aminoalkylphosphonate di(chlorophenyl) esters as inhibitora oj serine proteases, J. Enzyme Inhib., 1994, 8, 147-158.
28 a) [H.4] Sieńczyk M., Winiarski Ł., Kasperkiewicz P., Psurski M., Wietrzyk J., Oleksyszyn J.: Simple phospho-nic inhibitora of human neutrophil elastase, Bioorg. Med. Chem. Lett., 2011, 21, 1310-1314; b) Sieńczyk M., Winiarski Ł., Oleksyszyn J.: Nowe pochodne diestrów arylowych kwasów 1 -aminoalkanofosfonowych, sposób wytwarzania pochodnych diestrów arylowych kwasów 1-aminoalkanofosfonowych oraz zastosowanie pochodnych diestrów arylowych kwasów 1-aminoalkanofosfonowych, Patent Polski 215209.
— 18 —
Wyszukiwarka
Podobne podstrony:
Marcin Sieńczyk Załącznik 2 IV Wykaz osiągnięć naukowo-badawczych Tabela 1: Wykaz
Zdjęcie0248 147 DLA DZIECI I ML0D7IF.ŻY. ■1^7 twórców bawili literackich. Można podać zaledwie kilka
Marcin Sieńczyk Załącznik 2 Wysoka zdolność związku 3 do inaktywacji katepsyny G oraz wysoka
Marcin Sieńczyk Załącznik 2 Rysunek 4: Niskocząsteczkowe sondy molekularne do detekcji neutrofilowyc
Marcin Sieńczyk Załącznik 2 b) Omówienie celu naukowego/artystycznego ww. pracy/prac i osiągniętych
Marcin Sieńczyk Załącznik 2 ryny na elektrofilowy atom fosforu inhibitora (Rys.2).9 Struktura estrów
Marcin Sieńczyk Załącznik 2Katepsyna G Bardzo interesującą z punktu widzenia specyficzności
Marcin Sieńczyk Załącznik 2 tygenów in vitro,17 podjęto próbę określenia roli katepsyny G w procesow
Marcin Sieńczyk Załącznik 2 dendrytyczne, mDCl) zastosowałem specyficzne inhibitory katepsyny G. W t
Marcin Sieńczyk Załącznik 2 W ramach kontynuacji podjętych badań dotyczących roli katepsyny G
Marcin Sieńczyk Załącznik 2 detekcji aktywnej katepsyny G w lizacie śledziony wołowej,23 potwierdzaj
Marcin Sieńczyk Załącznik 2 która wykazała także prawie absolutną selektywność działania,
Marcin Sieńczyk Załącznik 2 Rysunek 5: Wzory ogólne otrzymanych na drodze kondensacji wieloskładniko
Marcin Sieńczyk Załącznik 2 Marcin Sieńczyk Załącznik 2 I Imię i Nazwisko: Marcin Sieńczyk H
Marcin Sieńczyk Załącznik 2 V Wskazanie osiągnięcia wynikającego z art. 16 ust. 2 ustawy z dnia 14 m
Marcin Sieńczyk Załącznik 2 H.6 Palesch D., Sieńczyk M.. Oleksyszyn J., Reich M., Wieczerzak E., Boe
Marcin Sieńczyk Załącznik 2 Katepsyna G Proteinaza 3 NSP4 Rysunek 1: Struktura ludzkiej katepsyny G
Marcin Sieńczyk Załącznik 2 przyczyn śmierci na świecie.1 Zaobserwowano także, że neutrofilowa elast
Do polskiej literatury naukowej pojęcie niedostosowania społecznego wprowadziła Maria Grzegorzewska
więcej podobnych podstron