6771815001
Marcin Sieńczyk Załącznik 2
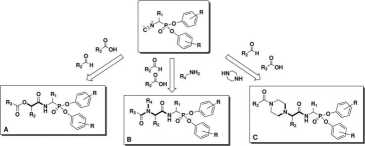
Rysunek 5: Wzory ogólne otrzymanych na drodze kondensacji wieloskładnikowej: Passerini (A) oraz Ugi (B, C) fosfonowych inhibitorów ludzkiej neutrofilowej elastazy.30
lowej elastazy. Choć podejście kombinatoryczne w otrzymywaniu nowych, biologicznie aktywnych cząsteczek jest stosowane z powodzeniem od lat, to dotychczas nie zastosowano tej strategii dla estrów diarylowych kwasów 1-aminoalkilofosfonowych. Otrzymane wyniki stanowią więc pierwsze doniesienie w tej tematyce opisane w literaturze naukowej.30 W celu otrzymania zaprojektowanych fosfonowych pseudopeptydów wykorzystałem dwie reakcje: (i) reakcję Ugi, której produktem są N-podstawione pseudopeptydy oraz (ii) reakcję Passerini, która prowadzi do uzyskania depsipep-tydów. Zastosowałem także zmodyfikowaną reakcję Ugi wykorzystującą piperazynę jako komponent aminowy (Rys.5).
Fosfonowymi substratami, których użyłem do konstrukcji bibliotek, były estry diarylowe kwasów 1-izocyjanoalkilofosfonowych.29 Jako substratów zawierających grupę karboksylową użyłem zarówno prostych kwasów organicznych, jak i N-blokowanych aminokwasów. W reakcji Passerini zastosowałem osiem strukturalnie zróżnicowanych aldehydów, natomiast w reakcji Ugi trzy alifatyczne aminy oraz piperazynę. Zastosowana strategia pozwoliła mi w krótkim czasie otrzymać i przebadać pod kątem zdolności hamowania ludzkiej neutrofilowej elastazy około tysiąc nowych fosfonowych peptydomimetyków (Rys.6). Ponadto, na podstawie otrzymanych wyników wyselekcjonowałem najbardziej aktywne pochodne, które otrzymano w formie czystych związków.
W kolejnym etapie prowadzonych badań związki wchodzące w skład mieszaniny wykazującej najsilniejsze zdolności hamowania proteolitycznej aktywności HNE zsyntetyzowano oddzielnie. Na szczególną uwagę zasługuje fakt, że spośród produktów reakcji Passerini najaktywniejsze okazały się fosfonowe depsipeptydy zawierające w pozycji P3 resztę metioniny: Cbz-Met-0-Val-Valp(0-C6H4-4-Cl)2 (24, ko6s/I = 20 500 M-1s-1) oraz Cbz-Met-0-Met-Valp(0-C6H4-4-Cl)2 (25, k06S/I = 40 105 M-1s-1). Ta zaskakująca preferencja HNE wobec Met w pozycji P3 znalazła potwierdzenie zarówno w moich późniejszych badaniach, jak i ostatnio w literaturze, gdzie najefektywniej hydrolizowany substrat oraz selektywna sonda molekularna do detekcji HNE zawierała 30 [H.5] Sieńczyk M., Podgórski D., Błażejewska A., Kulbacka J., Saczko J., Oleksyszyn M.: Phosphonic pseu-dopeptides as human neutrophil elastase inhibitors — o combinatorial approach, Bioorg. Med. Chem., 2011, 19, 1277-1284.
— 20 —
Wyszukiwarka
Podobne podstrony:
Marcin Sieńczyk Załącznik 2 Rysunek 4: Niskocząsteczkowe sondy molekularne do detekcji neutrofilowyc
Marcin Sieńczyk Załącznik 2 ryny na elektrofilowy atom fosforu inhibitora (Rys.2).9 Struktura estrów
Marcin Sieńczyk Załącznik 2 Katepsyna G Proteinaza 3 NSP4 Rysunek 1: Struktura ludzkiej katepsyny G
Marcin Sieńczyk Załącznik 2 przyczyn śmierci na świecie.1 Zaobserwowano także, że neutrofilowa elast
Marcin Sieńczyk Załącznik 2Katepsyna G Bardzo interesującą z punktu widzenia specyficzności
Marcin Sieńczyk Załącznik 2 Wysoka zdolność związku 3 do inaktywacji katepsyny G oraz wysoka
Marcin Sieńczyk Załącznik 2 tygenów in vitro,17 podjęto próbę określenia roli katepsyny G w procesow
Marcin Sieńczyk Załącznik 2 dendrytyczne, mDCl) zastosowałem specyficzne inhibitory katepsyny G. W t
Marcin Sieńczyk Załącznik 2 W ramach kontynuacji podjętych badań dotyczących roli katepsyny G
Marcin Sieńczyk Załącznik 2 detekcji aktywnej katepsyny G w lizacie śledziony wołowej,23 potwierdzaj
Marcin Sieńczyk Załącznik 2 Do niedawna w literaturze naukowej opisano zaledwie kilka przykładów
Marcin Sieńczyk Załącznik 2 która wykazała także prawie absolutną selektywność działania,
Marcin Sieńczyk Załącznik 2 Marcin Sieńczyk Załącznik 2 I Imię i Nazwisko: Marcin Sieńczyk H
Marcin Sieńczyk Załącznik 2 IV Wykaz osiągnięć naukowo-badawczych Tabela 1: Wykaz
Marcin Sieńczyk Załącznik 2 V Wskazanie osiągnięcia wynikającego z art. 16 ust. 2 ustawy z dnia 14 m
Marcin Sieńczyk Załącznik 2 H.6 Palesch D., Sieńczyk M.. Oleksyszyn J., Reich M., Wieczerzak E., Boe
Marcin Sieńczyk Załącznik 2 b) Omówienie celu naukowego/artystycznego ww. pracy/prac i osiągniętych
Załączniki. Rysunek. 1 10 priorytetów IT na 2012 rok wg. wielkości firmyTop Ten IT Priorities by Com
więcej podobnych podstron