6771814992
Marcin Sieńczyk Załącznik 2
Wysoka zdolność związku 3 do inaktywacji katepsyny G oraz wysoka selektywność działania wobec innych protez serynowych umożliwiła nawiązanie współpracy z prof. Zenonem Łukaszewskim (Wydział Chemiczny Politechniki Poznańskiej) oraz dr hab. Ewą Gorodkiewicz (Wydział Chemiczny Uniwersytetu w Białymstoku), której celem było określenie użyteczności uzyskanego inhibitora do pomiarów stężenia katepsyny G w materiale biologicznym (krew, ślina).15 Zastosowanie inhibitora 3 do pomiarów metodą SPR (surface plasmon resonance) wymagało jednak przeprojektowania cząsteczki, aby umożliwić jej kowalencyjną immobilizację do podłoża. W tym celu zaprojektowałem związek zawierający terminalną grupę karboksylową (4), która następnie przy użyciu układu sprzęgającego NHS/EDC pozwoliła na związanie inhibitora z powierzchnią sensora zawierającego wolne grupy aminowe.
A,
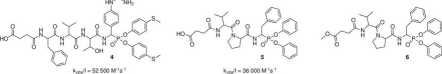
Ponieważ wprowadzenie nawet niewielkich zmian do struktury inhibitora może powodować drastyczną zmianę aktywności, przeprowadziłem analizę wpływu obecności terminalnej grupy karboksylowej na reaktywność związku 4 z katepsyną G. Badania te rozszerzyłem o pomiar inhibicji innych proteaz serynowych m.in. ludzkiej neutrofilowej elastazy, świńskiej elastazy trzustkowej (PPE), subtylizyny oraz proteinazy 3. Analiza wyników wykazała, że istotnie, aktywność związku 4 wobec katepsyny G zmniejszyła się około pięciokrotnie (k0j,s/I = 52 500 M-1s-1) w porównaniu z inhibitorem 3, natomiast aktywność wobec trypsyny zmalała ponad czterokrotnie, przy czym związek 4 nie hamował aktywności HNE, PPE oraz chymotrypsyny. Interesującym jest, że selektywność działania 4 wobec trypsyny uległa tylko nieznacznej zmianie — był on około 17 razy mniej reaktywny w stosunku do trypsyny niż katepsyny G. Zaprojektowany sensor pozwolił na bardzo czułą detekcję CatG w ślinie i surowicy pacjentów,15 a także umożliwił detekcję katalitycznie aktywnej katepsyny G u pacjentów cierpiących na endometriozę.16
Kontynuując moje badania nad zastosowaniem inhibitorów katepsyny G w analizie roli tej proteazy w układach biologicznych, rozpocząłem współpracę naukową z prof. Timo Bursterem {Dimsion of Endocńnology and Diabetes, Department of Intemal Medicine I, Uniuersity Medi-cal Center Ulm, Niemcy). Jako że katepsyna G, obok proteaz cysternowych (np. katepsyny S) i proteaz aspartylowych (np. katepsyny D), bierze udział m.in. w regulacji procesowania autoan-
15 [H.10] Gorodkiewicz E., Sieńczyk M., Regulska E., Grzywa R., Pietrusewicz E., Lesner A., Łukaszewski Z.: Surface plasmon resonance imaging biosensor for cathepsin G based on a potent inhibitor: deuelopment and applications, Anal. Biochem., 2012, 423, 218-223.
16 [H.15] Grzywa R., Gorodkiewicz E., Burchacka E., Lesner A., Laudański P., Łukaszewski Z., Sieńczyk M.: Determination of cathepsin G in endometrial tissue using a surface plasmon resonance imaging biosensor with tailored phosphonic inhibitor, Eur. J. Obstet. Gynecol. Reprod. Biol., 2014, 182, 38-42.
Wyszukiwarka
Podobne podstrony:
Marcin Sieńczyk Załącznik 2 dendrytyczne, mDCl) zastosowałem specyficzne inhibitory katepsyny G. W t
Marcin Sieńczyk Załącznik 2 Rysunek 4: Niskocząsteczkowe sondy molekularne do detekcji neutrofilowyc
Marcin Sieńczyk Załącznik 2 Do niedawna w literaturze naukowej opisano zaledwie kilka przykładów
Marcin Sieńczyk Załącznik 2 ryny na elektrofilowy atom fosforu inhibitora (Rys.2).9 Struktura estrów
Marcin Sieńczyk Załącznik 2Katepsyna G Bardzo interesującą z punktu widzenia specyficzności
Marcin Sieńczyk Załącznik 2 tygenów in vitro,17 podjęto próbę określenia roli katepsyny G w procesow
Marcin Sieńczyk Załącznik 2 W ramach kontynuacji podjętych badań dotyczących roli katepsyny G
Marcin Sieńczyk Załącznik 2 detekcji aktywnej katepsyny G w lizacie śledziony wołowej,23 potwierdzaj
Marcin Sieńczyk Załącznik 2 która wykazała także prawie absolutną selektywność działania,
Marcin Sieńczyk Załącznik 2 Rysunek 5: Wzory ogólne otrzymanych na drodze kondensacji wieloskładniko
Marcin Sieńczyk Załącznik 2 Marcin Sieńczyk Załącznik 2 I Imię i Nazwisko: Marcin Sieńczyk H
Marcin Sieńczyk Załącznik 2 IV Wykaz osiągnięć naukowo-badawczych Tabela 1: Wykaz
Marcin Sieńczyk Załącznik 2 V Wskazanie osiągnięcia wynikającego z art. 16 ust. 2 ustawy z dnia 14 m
Marcin Sieńczyk Załącznik 2 H.6 Palesch D., Sieńczyk M.. Oleksyszyn J., Reich M., Wieczerzak E., Boe
Marcin Sieńczyk Załącznik 2 b) Omówienie celu naukowego/artystycznego ww. pracy/prac i osiągniętych
Marcin Sieńczyk Załącznik 2 Katepsyna G Proteinaza 3 NSP4 Rysunek 1: Struktura ludzkiej katepsyny G
Marcin Sieńczyk Załącznik 2 przyczyn śmierci na świecie.1 Zaobserwowano także, że neutrofilowa elast
DSC00852 Załącznik 2 RODZAJ PRÓBEK POBIERANYCH DO BADAŃ DIAGNOSTYCZNYCH ORAZ SPOSÓB ICH POBIERANIA I
więcej podobnych podstron