S0029 (2)
I SoloMywnc tworzeniu wiązań wąyiel wąyiel
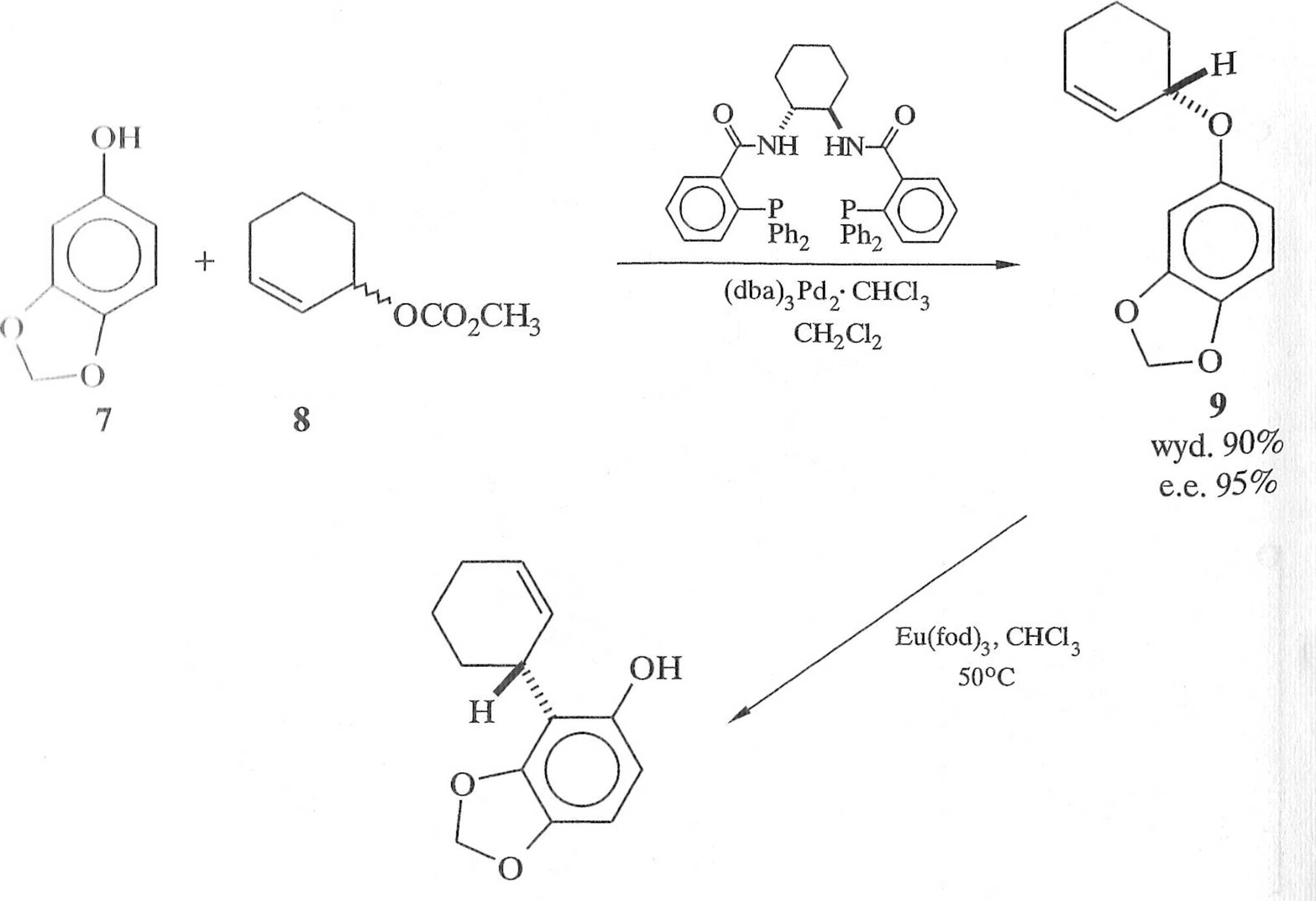
wyd. 91% e.e. 93%
10
Schemat 1.5.11
wy di przegrupowań Claisena przez zespół Hiratani umożliwiło syntezę analogu kaliksarenu 13 z makrocyklicznego polieteru 12 (schemat 1.5.12) [31].
i. jj ."l;
irj1!
Synteza niekodowanych aminokwasów (schemat 1.5.7) [26]
< igólna procedura otrzymywania allilowych estrów iV-trifluoroacetyIogli-
cyny 3: Do roztworu jV-trifluoroacetyloglicyny (1,71 g, 10 mmol) i odpowiedniego alkoholu allilowego (10 mmol) w 20 ml chlorku metylenu ochłodzonego do lemperatury -15°C należy dodać roztworu DMAP-u (122 mg, 1 mmol) i dicyklo-heksylokarbodiimidu (DCC, 2,06 g, 10 mmol) w 15 ml chlorku metylenu w tern pcralurze -15°C. Mieszaninę reakcyjną należy mieszać przez. 12 godzin, pod
I ') h/ni|Hi|>ov..nim | l l|hM|innliopowo
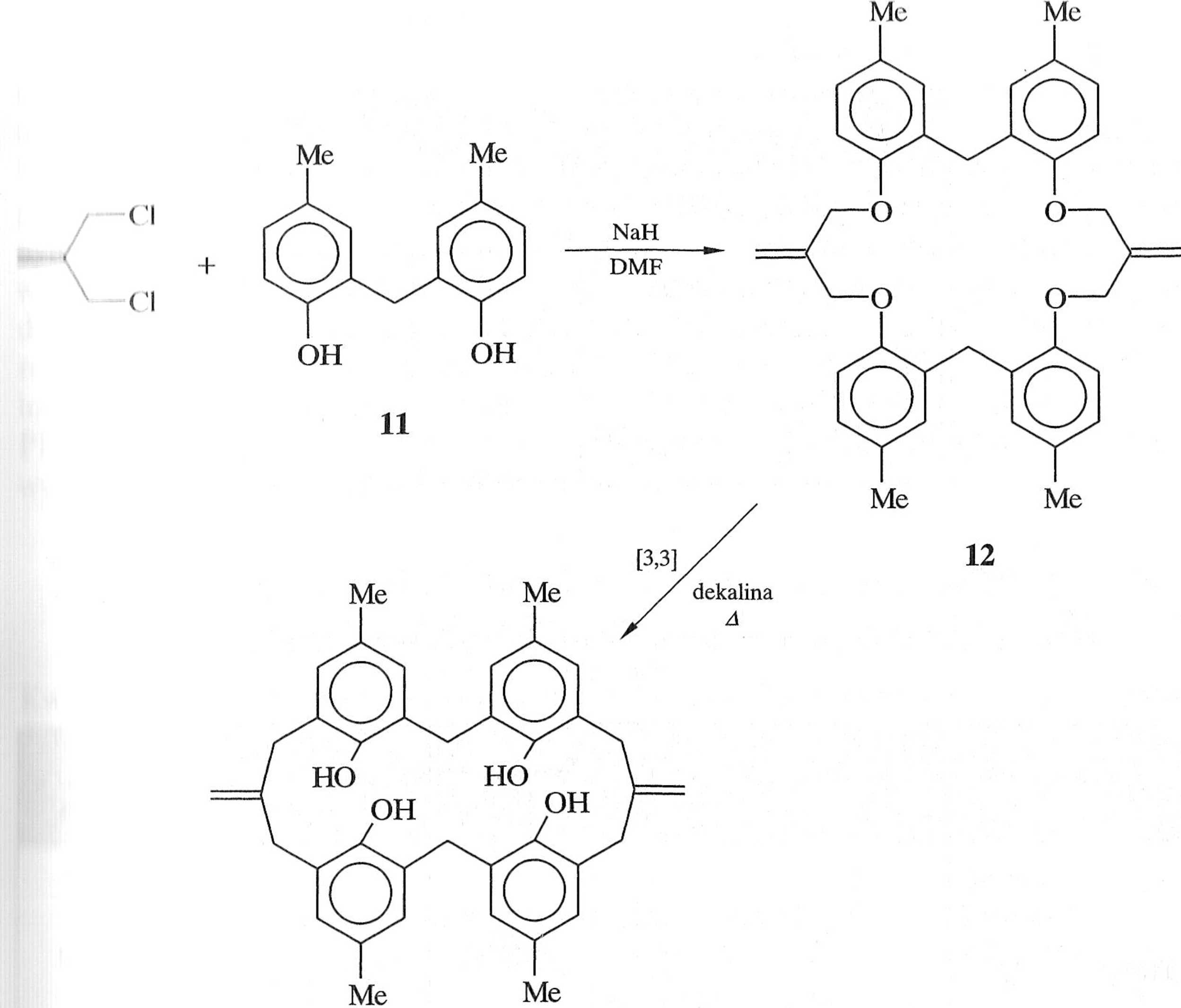
13
Schemat 1.5.12
mi |i stopniowo temperaturę do pokojowej. Po tym czasie należy odsączyć n,nony osad dicykloheksylomocznika, przemywając go na sączku 10 ml chlor-i * i nnlylenu. Warstwę organiczną przemywa się 1-molowym HC1 (10 ml) i nasy-m ni ioz(worem NaHC03, po czym warstwy wodne należy ekstrahować chlor-! i ni metylenu (2 • 10 ml). Połączone warstwy organiczne suszy się Na2S04 i od-
......w uje rozpuszczalnik. Surowy produkt oczyszcza się poprzez chromatografię
11ilnmnową na silikażelu lub poprzez krystalizację. Substraty i produkty zostały u Imme w tabeli 1.5.1.
t symetryczne przegrupowanie Claisena estrów allilowych glicyny 3:
i i, i .illilowy A/-lrifluoroiieety|og|ieyny (0,5 mmol), Al(Oi-Pr), (0,55 mmol) i li-
*"■ I liinina lub eluniilyu.i I "i mmol) należy rozpuścić w bezwodnym tetrahy-
}
Wyszukiwarka
Podobne podstrony:
S0029 (2) I SoloMywnc tworzeniu wiązań wąyiel wąyiel wyd. 91% e.e. 93% 10 Schemat 1.5.11 wy di przeg
80850 S0029 (2) I SoloMywnc tworzeniu wiązań wąyiel wąyiel wyd. 91% e.e. 93% 10 Schemat 1.5.11 wy di
S0042 (2) I Selektywne tworzenie wiązań węgiel-węgiel ii) RCM CH CH PhH, 24 h 22 °C wyd. 90% e.e. 95
S0042 (2) I Selektywne tworzenie wiązań węgiel-węgiel ii) RCM CH CH PhH, 24 h 22 °C wyd. 90% e.e. 95
skanuj0226 (5) Rys. 2.85. Powstawanie dimeru w krysztale heminy przez tworzenie wiązań wodorowych mi
S0017 (3) I SoloMywno łworzonio wiązań węgiel węgiel Tabela 1.2.1. Sub,straty i produkty reakcji ald
S0041 (2) I. Selektywne tworzenie wiązań węgiel-węgiol u) [Mo] + + ■Ht, tłialkenowy proces
37444 S0030 (2) TMMnlam I Suloklywno tworzenie wiązań węgiel-węgiel Tabela 1.5.1. Synteza estrów all
S0017 (3) I SoloMywno łworzonio wiązań węgiel węgiel Tabela 1.2.1. Sub,straty i produkty reakcji ald
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
S0027 (2) I Sfilnktywno tworzenie wiązań węgiel węgiel i hiralnego pomocnika związanego kowalencyjni
S0030 (2) TMMnlam I Suloklywno tworzenie wiązań węgiel-węgiel Tabela 1.5.1. Synteza estrów allilowyc
S0032 (2) I Suloktywne tworzenie wiązań węgiel węgiel M. I licrscmann, L. Abraham, Eur. J. Org. Chem
więcej podobnych podstron