32254 skanuj0148 (7)

Dalszy rozwój teorii pola krystalicznego wykazał, że tworzeniu płaskich kompleksów kwadratowych najbardziej sprzyja konfiguracja jonów d8 (rys. 2.15). Istotnie, jony d8 wykazują silną tendencję do tworzenia płaskich kompleksów kwadratowych o sparowanych elektronach; jest tak w przypadku jonu Ni2+ w [Ni(CN)4]2~, najbardziej charakterystyczne są jednak liczne kompleksy Pt2+ zaliczane do najtrwalszych kompleksów tego typu: [PtCl4]2-, [Pt(NH3)4]2+. Również Au3+ tworzy takie kompleksy.
Liczby koordynacyjne inne niż 6 i 4, a zwłaszcza liczby nieparzyste, występują rzadziej w związkach pierwiastków (metali) przejściowych. Warto jeszcze zauważyć, że koordynacja liniowa, z liczbą koordynacyjną równą dwu, występuje często w przypadku jonów d° i d10, stanowiących przypadki graniczne jonów metali przejściowych.
Przykłady:
d° w V5 + , Mo6+: [V02]+, [Mo02]2+, [U02]2+
d10 w Cu+, Ag+, Au+, Hg2+: [Cu(NH3)2]+, [Ag(CN)2]“, [AuC12]“, HgBr2
Koordynacja taka mogłaby wydać się dziwna w przypadku dużych jonów d109 które, zgodnie z teorią elektrostatyczną, powinny tworzyć kompleksy o dużej liczbie koordynacyjnej, staje się jednak zrozumiała, jak przekonamy się dalej (s. 154), jeżeli się przyjmie, że wiązanie jest przede wszystkim kowalencyjne.
II. Wiązania kowalencyjne A—X
Należy tu ponownie rozróżnić dwa przypadki: A może być lub nie być pierwiastkiem przejściowym.
a) Atom A nie jest pierwiastkiem przejściowym. Wewnętrzne powłoki elektronowe są wysycone. Sidgwick i Powell, a później Gillespie i Nyholm zwrócili uwagę na fakt, że w tym przypadku kierunki wiązań są uwarunkowane odpychaniem się par elektronowych powłoki walencyjnej. W przypadku czystych wiązań jonowych (ładunki niepołaryzowalne) jony X tworzą pierwszy pierścień ładunków, który nie jest sferycznie symetryczny wokół A, a równowadze tych ładunków odpowiada konfiguracja, w której są one maksymalnie oddalone od siebie. Przeciwnie, w przypadku wiązania kowalencyjnego pierwszy pierścień ładunków, o znaku przeciwnym w stosunku do znaku zrębu atomowego A, jest utworzony przez elektrony wiązań i wolnych par elektronowych. Te grupy elektronów wykazują tendencję do silnego odpychania wzajemnego zgodnie z zasadą Pauliego, która decyduje o kierunkach wiązań. W wiązaniu kowalencyjnym A—X o krotności k, k par elektronowych skupia się w obszarze międzyjądrowym, lecz oprócz elektronów wiązania powłoka walencyjna atomu A może zawierać / wolnych par, tak że łącznie powłoka
X,
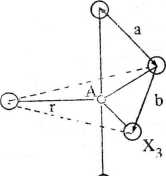
Rys. 2.19. Pięć atomów X w jednakowych odległościach (r) od atomu A tworzących konfigurację podwójnej piramidy trygonalnej: h > a, gdyż a — r\2 i b — 2rcos30° (X1AX2 = 90° i X2AX3 = 120°)
150
Wyszukiwarka
Podobne podstrony:
skanuj0011 Biologia noKotworjaua — Cttitzemie 3 (por. Ćwiczenie 1 i 2). Wykazano, że pacjenci z dany
skanuj0011 Biologia noKotworjaua — Cttitzemie 3 (por. Ćwiczenie 1 i 2). Wykazano, że pacjenci z dany
Matem Finansowa 4 224 Zbiór zadań i testów z matematycznych podstaw teorii procentu 30)
64280 skanuj0003 (169) Statyny. Lilja i wsp. [14] wykazali, że picie soku grapefruitowego przez 2 dn
skanuj0264 Kominy 26323.5. Rozwój technologii budowy kominów Dalszy rozwój - szczególnie w dziedzini
skanuj0010 • Dyfuzja rozwoju • Dyfuzja informacji e Dyfuzja innowacji •
skanuj0040 .mu pojęciu pokolenia. Faktycznie można jednak wykazać, że najdłuższy możliwy czas życia
więcej podobnych podstron