52233 skanuj0118 (15)
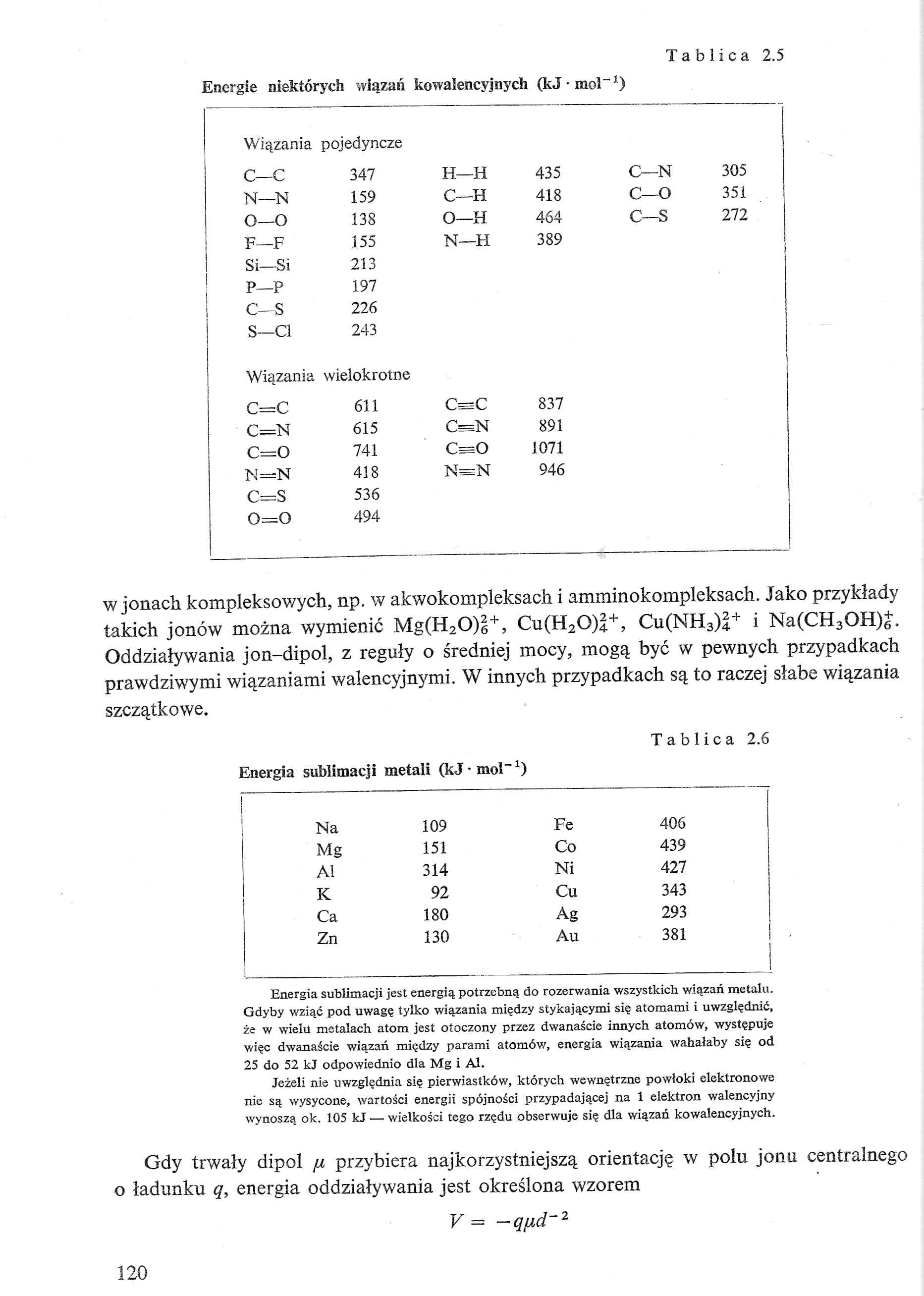
Tablica 2.5
Energie niektórych wiązań kowalencyjnych (kJ • mol" *)
|
Wiązania |
pojedyncze | ||||
|
C—C |
347 |
H—H |
435 |
C—N |
305 |
|
N—N |
159 |
C—H |
418 |
c—O |
351 |
|
O—O |
138 |
O—H |
464 |
c—s |
272 |
|
F—F |
155 |
N—FI |
389 | ||
|
Si—Si |
213 | ||||
|
P—P |
197 | ||||
|
C—s |
226 | ||||
|
S—Cl |
243 | ||||
|
Wiązania |
wielokrotne | ||||
|
C=C |
611 |
C=C |
837 | ||
|
C=N |
615 |
C=N |
891 | ||
|
c=o |
741 |
c==o |
1071 | ||
|
N=N |
418 |
NsN |
946 | ||
|
c=s |
536 | ||||
|
0=0 |
494 |
w jonach kompleksowych, np. w akwokompleksach i amminokompleksach. Jako przykłady takich jonów można wymienić Mg(H20)l+, Cu(H20)|+, Cu(NH3)i+ i Na(CH3OH)£. Oddziaływania jon-dipol, z reguły o średniej mocy, mogą być w pewnych przypadkach prawdziwymi wiązaniami walencyjnymi. W innych przypadkach są to raczej słabe wiązania szczątkowe.
Tablica 2.6
Energia sublimacji metali (kJ • mol x)
|
Na |
109 |
Fe |
406 |
|
Mg |
151 |
Co |
439 |
|
Al |
314 |
Ni |
427 |
|
K |
92 |
Cu |
343 |
|
Ca |
180 |
Ag |
293 |
|
Zn |
130 |
Au |
381 |
Energia sublimacji jest energią potrzebną do rozerwania wszystkich wiązań metalu. Gdyby wziąć pod uwagę tylko wiązania między stykającymi się atomami i uwzględnić, że w wielu metalach atom jest otoczony przez dwanaście innych atomów, występuje więc dwanaście wiązań między parami atomów, energia wiązania wahałaby się od 25 do 52 kJ odpowiednio dla Mg i Al.
Jeżeli nie uwzględnia się pierwiastków, których wewnętrzne powłoki elektronowe nie są wysycone, wartości energii spójności przypadającej na 1 elektron walencyjny wynoszą ok. 105 kJ — wielkości tego rzędu obserwuje się dla wiązań kowalencyjnych.
Gdy trwały dipol (i przybiera najkorzystniejszą orientację w polu jonu centralnego o ładunku q, energia oddziaływania jest określona wzorem
V = —q/
120
Wyszukiwarka
Podobne podstrony:
7. Na podstawie tablicowych wartości funkcji termodynamicznych_ Am [kJ/mol] 52 [J/
skanuj0029 (15) • Niektóre wartości funkcji trygonometrycznych ar o(o°) f(*) §m f(9T) sin
skanuj0019 (241) Tablica 1.4 Orientacyjne własności wytrzymałościowe niektórych gatunków stali: Rm i
skanuj0020 (230) Tablica 1.5 Orientacyjne własności wytrzymałościowe niektórych gatunków staliw i że
skanuj0288 (4) Wartość HB dla niektórych materiałów stosowanych na koła zębate podano w tablicy 11.8
skanuj0115 (16) Wiązanie kowalencyjne jest pojedyncze lub wielokrotne zależnie od liczby elektronów
14278 skanuj0007 (486) Tablica 8 Własności wytrzymałościowe niektórych materiałów
28535 str 139 Tablica 14.15 Wartości C/P dla niektórych trwałości Lh wg [2] Trwałość Lh [h] Łożysk
więcej podobnych podstron