skanuj0115 (16)
Wiązanie kowalencyjne jest pojedyncze lub wielokrotne zależnie od liczby elektronów uwspólnionych przez połączone atomy. W wiązaniach pojedynczych gęstość ładunku odpowiadająca sumarycznie parze elektronów (o przeciwnych spinach) jest zlokalizowana w pobliżu linii łączącej jądra. Elektrony te nazywa się elektronami o. W przypadku wiązań
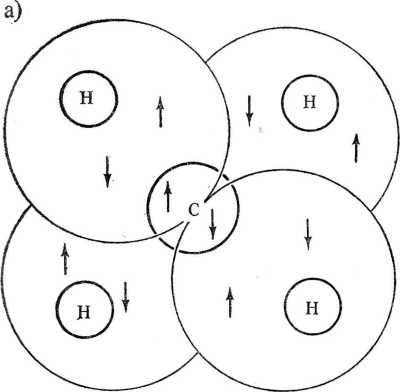
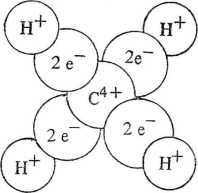
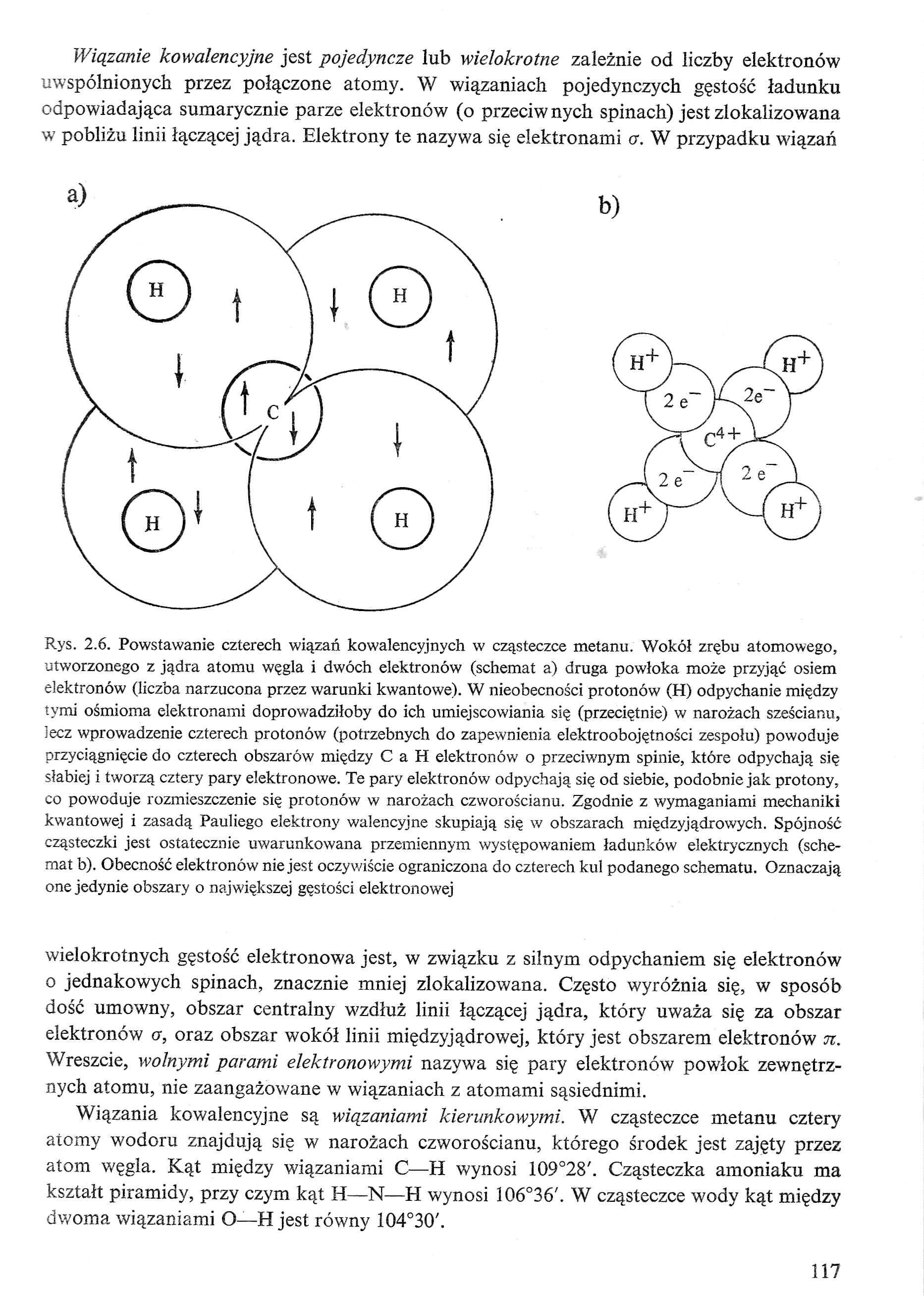
Rys. 2.6. Powstawanie czterech wiązań kowalencyjnych w cząsteczce metanu. Wokół zrębu atomowego, utworzonego z jądra atomu węgla i dwóch elektronów (schemat a) druga powłoka może przyjąć osiem elektronów (liczba narzucona przez warunki kwantowe). W nieobecności protonów (H) odpychanie między tymi ośmioma elektronami doprowadziłoby do ich umiejscowiania się (przeciętnie) w narożach sześcianu, lecz wprowadzenie czterech protonów (potrzebnych do zapewnienia elektroobojętności zespołu) powoduje przyciągnięcie do czterech obszarów między C a H elektronów o przeciwnym spinie, które odpychają się słabiej i tworzą cztery pary elektronowe. Te pary elektronów odpychają się od siebie, podobnie jak protony, co powoduje rozmieszczenie się protonów w narożach czworościanu. Zgodnie z wymaganiami mechaniki kwantowej i zasadą Pauliego elektrony walencyjne skupiają się w obszarach międzyjądrowych. Spójność cząsteczki jest ostatecznie uwarunkowana przemiennym występowaniem ładunków elektrycznych (schemat b). Obecność elektronów nie jest oczywiście ograniczona do czterech kul podanego schematu. Oznaczają one jedynie obszary o największej gęstości elektronowej wielokrotnych gęstość elektronowa jest, w związku z silnym odpychaniem się elektronów o jednakowych spinach, znacznie mniej zlokalizowana. Często wyróżnia się, w sposób dość umowny, obszar centralny wzdłuż linii łączącej jądra, który uważa się za obszar elektronów cr, oraz obszar wokół linii międzyjądrowej, który jest obszarem elektronów n. Wreszcie, wolnymi parami elektronowymi nazywa się pary elektronów powłok zewnętrznych atomu, nie zaangażowane w wiązaniach z atomami sąsiednimi.
Wiązania kowalencyjne są wiązaniami kierunkowymi. W cząsteczce metanu cztery atomy wodoru znajdują się w narożach czworościanu, którego środek jest zajęty przez atom węgla. Kąt między wiązaniami C—H wynosi 109°28'. Cząsteczka amoniaku ma kształt piramidy, przy czym kąt H—N—PI wynosi 106°36'. W cząsteczce wody kąt między dwoma wiązaniami O—H jest równy 1Q4°30'.
117
Wyszukiwarka
Podobne podstrony:
O jakimś państwie mówimy, że jest praworządne lub niepraworządne w zależności od tego, jak postępują
AS1 Dostosowanie cenowe, lub dochodowe, zależne od as elastyczności popytu, przez np. wzrost
skanuj0179 16 1. Co to jest strategia i zarządzanie strategiczne stwa i podejmowanie, kontrolowanie
EP 2 034 830 BI osobnikowi, w pojedynczych lub wielokrotnych dawkach w celu poprawy lub profilaktyki
31682 skanuj0024 (46) WIĄZANIE KOWALENCYJNE & Wiązanie międzyatomowe na skutek wspólnych par ele
37672 skanuj0116 (16) Wiązanie chemiczne w kwantowej teorii klatek Pojęcie klatek wprowadzone na s.
skanuj0022 szkoda Twojego wysiłku i gadania, koleżanko. Idinck wielokrotnie otrzymywał od nas swoją
Pokoloruj te elementy obrazka, których jest 11 lub 12. Wpisz kolejne liczby.Rok
73812 skanuj0006 (292) Dyplomacja sytuacji, w której niezależne państwo stałoby się „sprzymierzeńcem
więcej podobnych podstron