74858 s che 19

Dokładną wartość pH (do 0,1 lub 0,01 jednostki) uzyskać można mąt odą poteocj o metryczną (pomiar pH-metrem). Zasada oznaczania polega na pomiarze SEM ogniwa składającego się z elektrod', wskaźnikowej oraz porównawczej zanurzonych w badanym roztworze Przyrząd wskaźnikowy pH-metru wyekaiowacy jest w jednostkach pH, co bardzo upraszcza i przyspiesza pomiar.
Pehametr JN-512
Przyrząd służy do pomiaru pH w przedziale 0-14 z dokładnością ±0,1 (na skali przybliżonej) oraz ± 0,01 na skali dokładnej, a także do pomiaru siły elektromotorycznej ogniw w granicach 0-1400 raV z dokładnością do ± 10 ntV na pierwszej części skali i ± 1 mV na drugiej części skali. Schemat pehametru N-512 przedstawia rysunek 9.2.
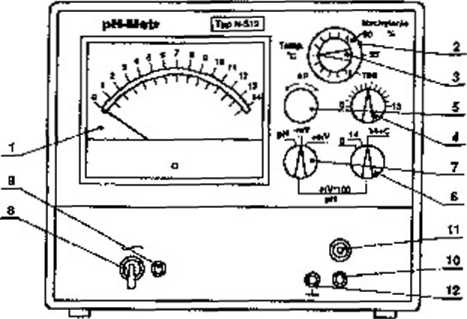
Rys. 9.2. Schemat pehametro N-512: 1-miernik, 2 - gałka ustawienia tempcr&tujy, 3-gałka kompensacji temperatury i dopasowania nachylenia charakterystyki elektrody, 4 - przełącznik kompensacji dla pomiarów dokładnych, 5 - gałka <£> wyrównania potencjału asymetrii, 6 - przełącznik pomiarów przybliżonych i dokładnych, 7 - pr/dącznrk pomiarn pH lub SEM, 8- wyłącznik sieciowy, 9 - lampka kontrolna wyłączenia do sieci, 10, 11 - gniazda wejściowe do przyłączenia elektrod, 12 - gniazdo do przyłączenia uziemienia.
Wykonanie pomiaru pH
Do pomiaru pil stosowana jest tzw. elektroda kombinowana, składająca się z elektrody szklaną i chlorosrebrową elektrody odniesienia, umieszczonych we wspólnej obudowie. Membrana elektrody szklaną wykonana jest ze specjalnego szkła o niskiej wytrzymałości mechanicznej, dlatego podczas pracy z elektrodą wymagane jest zachowanie szczególnej ostrożności.
Wykonanie;
1. Zanurzyć ostrożnie elektrodę w roztworze badanym.
2. Przełącznik (6) ustawić w pozycji 14.
3. Na mierniku (1) odczytać wartość pH (dolną skala).
4. Przełącznik (6) ustawić w pozycji 0.
5. Wyjąć elektrodę z roztworu, opłukać wodą destylowaną i osuszyć paskiem bibuły.
9.2. CZĘŚĆ DOŚWIADCZALNA
Doświadczenie 1: pH slaby di i mooiycb elektrolitów
Wykonanie:
1. Do 4 probówek nalać ok. 0,5 cm3 roztworu HCI, CHaCOOH, NaOH, NH3 ■ ŁbO o tym samym stężeniu (0,01).
2. Następnie dodać po 1 kropli oraniu metylowego i zanotować zabarwienie wskaźnika v»' roztworze.
3. Czynność (1) powtórzyć dodając po 1 kropli fecoloftaleiny i zanotować zabarwienie wskaźnika w roztworze.
4. Czynność (1) powtórzyć i w każdym z roztworów zanurzyć (zwilżyć) papierek wskaźnikowy uniwersalny. Zanotować wartości pH wg skali barw.
5. Zmierzyć pH podanych roztworów o tym samym stężeniu pH-meirctn. Zanotować wartości ph.
6. Obliczyć pH poszczególnych roztworów.
7. Wszystkie wyniki zapisać w tabelce.
|
Rortwór |
c |
oranż metylowy |
fcnoloftałeirta |
papierek wskaźnikowy |
wskazanie płi-metru |
pH obliczone |
|
HCI CH.COOH NaOH NHa* HiO |
0,01 <1,01 0,01 0.01 |
93. PYTANIA I ZADANIA
1. Oblicz stopień dysocjacji kwasu mrówkowego HCOOH w roztworze OJ molowym stosując wzór dokładny i przybliżony. K - 1,77 • 10"4
2. 0,04 g NaOH rozpuszczono w wodzie i otrzymano 1 dmł roztworu. Oblicz stężenie jonów OH" oraz pH tego roztworu.
3. W wyniku rozpuszczenia tlenku wapnia CaO w wodzie powstaje roztwór o pH większym niż 7. Jakie cząstki tlenku wapnia wywołują wzrost pil?
4. 20 cm3 0,2 molowego roztworu HCI rozcieńczono do objętości 2 dm\ Oblicz pH roztworu kwasu chlorowodorowego po rozcieńczeniu.
5. Do 20 cm3 0,05 molowego roztworu kwasu azotowego(V) dodano 30 cm3 0,02 molowego roztworu wodorotlenku potasu. Oblicz stężenie jonów hydroniowych oraz pH otrzymanego roztworu.
6. Po wprowadzeniu do wody gazowego amoniaku NH3 powstaje roztwór słabego elektrolitu (zasady amonowej), którego pH wynosi 11.
a) Czym jest spowodowana dobra rozpuszczalność gazowego NH? w wodzie?
*3
Wyszukiwarka
Podobne podstrony:
74858 s che 19 Dokładną wartość pH (do 0,1 lub 0,01 jednostki) uzyskać można mąt odą poteocj o metry
s che 19 Dokładną wartość pH (do 0,1 lub 0,01 jednostki) uzyskać można mąt odą poteocj o metryczną (
KONSTRUKCJE STALOWE STR245 245Procedura 7.7 (cd.) 1 2 19. Wyznaczenie wartości odniesienia do wyz
P1030371 (3) Kwasy karboksylowe - obniżają wartość pH do wartości niefizjologicznych dla mikroorgani
Centrum Kultury Sportu i Turystyki w Kalwarii Zebrzydowskiej W dniach od 04.01 do 08.01.2021 będzie
Picture�7 (4) IS Poboczna liczba kwantowa I przyjmuje wartości od / = 0 do / = n -1. Okre-la ona dok
skanuj0003 W celu dokładniejszego określenia wartości G należy do obliczeń zastosować jedną z metod
DSC00028 (26) 112 TABLICA IV. Wartości współczynników do obliczania przekrojów prostokątnych i teowy
Informacja do zadań 16.-17. Wartości pH wody oraz wodnych roztworów kwasów i wodorotlenków mogą uleg
ł) wartość w odniesieniu do rozstawu belek (50 lub 62.5) / pojedyncze żebro stropowe J) ponad ciężar
• Wykład (podać z dokładnością do 1 lub 2 godzin): Zawartość tematyczna poszczególnych godzin
- podstawowe funkcje animacji. • Wykład (podać z dokładnością do 1 lub 2 godzin): Zawartość
• Wykład (podać z dokładnością do 1 lub 2 godzin): Zawartość tematyczna poszczególnych godzin
• Wykład (podać z dokładnością do 1 lub 2 godzin): Zawartość tematyczna poszczególnych godzin
7 Kopia 51) Wskaż prawidłową wartość pH śliny: • A. od 6,0 do 8,0; B. od 2,5 do
więcej podobnych podstron