89778 skan0184 (2)

Zadania 187
|
m [mol • kg [] |
0,510 |
1,040 |
2,166 |
3,397 |
4,750 |
|
Ap [mm Hg] |
12,0 |
23,7 |
45,1 |
69,3 |
94,2 |
Obliczyć praktyczny współczynnik aktywności NH4C1 w roztworze 4,75-mo-lalnym, jeżeli w roztworze 0,510-molalnym wynosi on 0,68. Odp. y± = 0,46.
4f:l. Gęstość roztworów etanolu (2) w wodzie (1) w temperaturze 20°C dla szeregu stężeń w % wagowych etanolu wynosi
|
% wag. |
0 |
10 |
20 |
30 |
40 |
50 |
|
P [g' cm-3] |
0,9982 |
0,9818 |
0,9687 |
0,9539 |
0,9352 |
0,9139 |
|
% wag. |
60 |
70 |
80 |
90 |
100 | |
|
P [g' cm_3J |
0,8911 |
0,8676 |
0,8436 |
0,8180 |
0,7893 |
Obliczyć na podstawie tych danych cząstkowe molowe objętości etanolu i wody w roztworze 40%. Odp. Kj = 17,76; V2 = 55,57 cm3 • mol-1.
4f:2. Oznaczając indeksem 1 rozpuszczalnik oraz indeksem 2 substancję rozpuszczoną, wyprowadzić równanie na objętość pozorną <P [cm3 • mol-1]:
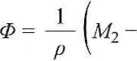
1000 p - p\ m p{
gdzie m oznacza mobilność [mol • kg ]], p - gęstość roztworu, px - gęstość rozpuszczalnika [g ■ cm-3], M2 - masę molową substancji rozpuszczonej [g • mol-1].
4f:3. W 20°C gęstość wody/?! = 0,9982 g • cm"3. Obliczyć pozorną objętość molowąMgCl2 w roztworze wodnym o gęstości w tej temperaturze p]2 = 1,0311 g • cm-3, zawierającym w 1 dm3 41,24 g MgCl2. Odp. 19,29 cm3 • mol-1.
4f:4. W 25°C gęstości wodnych roztworów HC1 o stężenich c = 0,580 M i 8,994 M wynoszą odpowiednio, 1,0074 i 1,140 g- cni-3, gęstość wody zaś P] = 0,9970 g • cm-3. Pozorna objętość molowa PICI w tym zakresie stężeń jest liniową funkcją >Jc. Obliczyć cząstkowe objętości molowe PJ20 i HC1 w roztworze o stężeniu 4 M. Odp. (p = 19,71 cm3 • mol-1; V] = 18,00 cm3 • mol-1; V2 = = 18,62 cm3 ■ mol-1.
4f:5. Gęstość roztworów J-fruktozy w wodzie w temperaturze 20°C wynosi (dla różnych stężeń procentowych):
|
% wag. |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
p [g • cm-3] |
0,9982 |
1,0385 |
1,0816 |
1,1276 |
1,1769 |
1,2295 |
1,2854 |
1,3443 |
Wyszukiwarka
Podobne podstrony:
50627 skan0318 Zadania 321 m [mol • kg 1
skan0143 (2) 146 Roztwory i równowagi fazowe Rozwiązanie. Zgodnie z (4.4) molalność roztworu m [mol
P32400139 Zadanie 2 — Ogniwa stężeniowe Tabela 2. Pomiary, obliczenia i wyniki AgNO, m * 0,01 mol-kg
arkusz3 5 ZADANIE 5. Obliczyć silę jonową roztworu wodnego zawierającego 0,002 niol/kg NaCI, 0,001 m
skan0104 Zadania 107 w temperaturze 298 K i 1000 K pod ciśnieniem 1 atm. Standardowe entalpie tworze
skan0114 Zadania 117 3f:9. Na podstawie poniższych danych obliczyć zależność AG0 od temperatury oraz
skan0179 Zadania 4a:l. Oznaczając indeksem 1 rozpuszczalnik oraz indeksem 2 substancję rozpuszczoną,
skan0180 Zadania 183 ła Henry’ego dla tlenu wynosi KH(02) = 4,399 • 10y Pa. Dla uproszczenia przyjąć
TORUS Kursy matematyki. Poziom podstawowy. Procenty. Zadanie 5. Ze 100 kg mleka o zawartości 3,8% tł
więcej podobnych podstron