![]()
Układy dwuskładnikowe
Stan układu dwufazowego i dwuskładnikowego określają parametry:
temperatura T
ciśnienie
skład fazy, czyli ułamki molowe jednego składnika (x1)α oraz (x1)β w obu fazach
Reguła faz Gibbsa określa ile parametrów można zmienić bez zakłócenia równowagi w takim układzie: dwie fazy (f=2) i dwa składniki (s = 2)
![]()
Zmienność układu dwufazowego i dwuskładnikowego z = 2
możemy dowolnie ustalić tylko dwa parametry, które determinują stan układu: np. temperaturę T i ułamek molowy jednego składnika w fazie ciekłej (x1)c, lub ciśnienie p i ułamek molowy składnika w fazie gazowej (x1)g,
pozostałe parametry są od nas niezależne.
Równowaga ciecz - gaz
Parametry wybrane:
temperatura T,
ułamek molowy składnika 1 w fazie ciekłej (x1)c.
Parametry, na które nie mamy wpływu:
ułamek molowy drugiego składnika w fazie ciekłej (x1)c,
skład fazy gazowej (ułamki molowe obu składników w (x1)g oraz (x2)g)
ciśnienia cząstkowe par składników (prężności składników) czyli ciśnienie pary nasyconej (prężność roztworu).
W stałej temperaturze zgodnie z prawem Raoulta ciśnienie pary nasyconej składnika (prężność składnika) pi jest proporcjonalne do ułamka molowego składnika w roztworze (xi)c.
![]()
pio jest ciśnieniem pary nasyconej czystego składnika (prężnością czystego składnika).
Potencjał chemiczny składnika w roztworze.
Potencjał chemiczny składnika w fazie gazowej dla T=const:
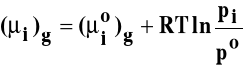
Z prawa Raoulta:
![]()
stąd:
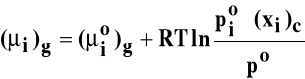
Z warunku równowagi:
![]()
Potencjał chemiczny składnika w roztworze:
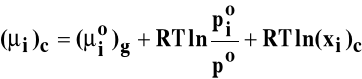
Ponieważ potencjał standardowy ciekłego składnika (μio)c jest równy:
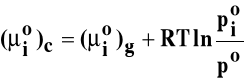
Potencjał chemiczny składnika w roztworze jest liniową funkcją logarytmu ułamka molowego składnika w roztworze:
![]()
Równowaga ciecz-gaz w układach o nieograniczonej rozpuszczalności obu składników w fazie ciekłej.
Zależność ciśnienia pary nasyconej od składu roztworu T=const.
![]()
Skład fazy gazowej ułamek molowy składnika w fazie gazowej (xA)g
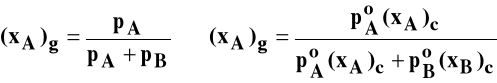
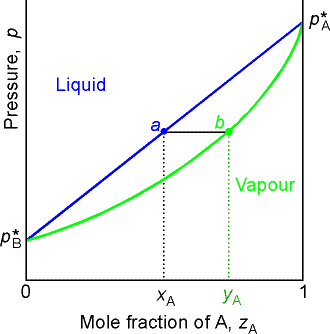
Cieczy, w punkcie a (ułamek molowy xA) odpowiada para, w punkcie b (ułamek molowy yA)
Powyżej prostej z punktami pA oraz pB układ ciekły, jednofazowy,
poniżej krzywej z punktami pA, b oraz pB para - układ jednofazowy.
Pomiędzy prostą i krzywą - dwie fazy w równowadze: ciecz i para.
Wpływ ciśnienia na równowagę ciecz-para
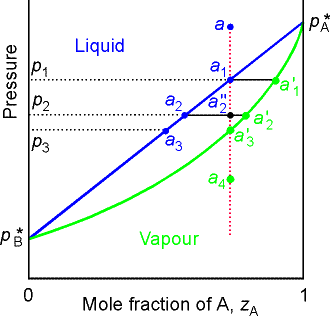
Linia przechodząca przez punkt a jest linią stałego składu.
Jeżeli p>p1 układ jednofazowy ciekły, ciecz a1
Jeżeli p< p3 układ jednofazowy gazowy - para nienasycona a3'.
Jeżeli p3<p<p1 czyli p=p2 dwie fazy: ciecz a2 i para nasycona a2'.
Stosunek liczby moli składnika A w obu fazach można obliczyć stosując regułę dźwigni:
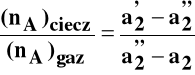
Wpływ temperatury na równowagę ciecz - para dla p = const.
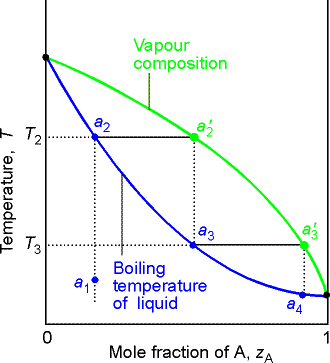
Składnik A jest bardziej lotny (wyższa prężność stąd niższa temperatura wrzenia pod normalnym ciśnieniem).
Ciecz o składzie a1 ogrzana do temperatury T2 wrze para o składzie a2', po skropleniu kondensat o składzie a3, który ogrzany do temperatury T3 wrze, dając parę nasyconą o składzie a3'.
W destylacji frakcyjnej (rektyfikacji) procesy wrzenia i kondensacji powtarzane są wielokrotnie, na kolejnych półkach kolumny rektyfikacyjnej.
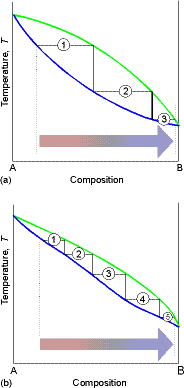
Liczba półek teoretycznych - liczba efektywnych procesów wrzenia i kondensacji, która jest niezbędna do otrzymania z mieszaniny wyjściowej destylatu o założonym składzie.
Liczba półek teoretycznych jest cechą charakterystyczną roztworu.
Azeotropy
Prężności składników mogą wykazywać znaczne odchylenia od liniowej zależności przewidzianej prawem Raoulta.
Jeżeli prężności obu składników roztworu są mniejsze niż przewiduje prawo Raoulta
![]()
zależność prozt(xA) dla T=const. wykazuje minimum, natomiast zależność Twrz(xA) dla p=const. wykazuje maksimum azeotrop ujemny.
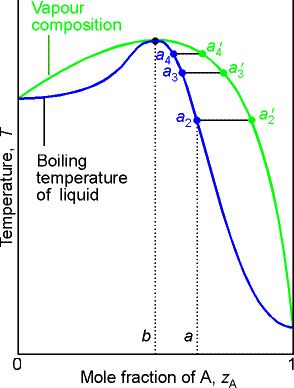
W punkcie azeotropowym b skład pary jest identyczny ze składem cieczy - wrzenie roztworu nie powoduje zmiany składu mieszaniny azeotropowej nie można rozdzielić metodą destylacji frakcyjnej.
Azeotropy ujemne: H2O+HNO3,
H2O+HCl
Prężność składnika, mniejsza od wartości oczekiwanej, wskazuje na silne przyciąganie pomiędzy cząsteczkami obu składników oddziaływania różnoimienne są silniejsze od oddziaływań jednoimiennych (Eij<Eii oraz Eij<Ejj).
Jeżeli prężności obu składników roztworu są większe niż przewiduje prawo Raoulta
![]()
zależność prozt(xA) dla T=const. wykazuje maksimum, natomiast zależność Twrz(xA) dla p=const. wykazuje minimum azeotrop dodatni.
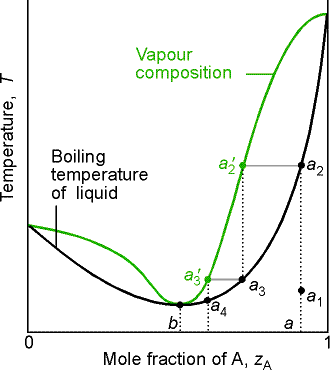
Przykłady azeotropów dodatnich:
benzen-metanol,
etanol- woda (skład azeotropowy - 96% molowych EtOH, twrz= 78,10C, azeotropu nie można rozdzielić przez destylację frakcyjną.
Prężność składnika, większa od wartości oczekiwanej, wskazuje na odpychanie cząsteczek obu składników oddziaływania jednoimiennych są silniejsze od oddziaływań (Eii<Eij oraz Ejj<Eij).
6
9