072 3

Jak to wyjaśnić? Siarczek srebra rozkłada się na srebro i siarkowodór. To. że zaszła reakcja elektrochemiczna, można łatwo wykazać.
Doświadczenie 2. Z metalicznego srebra (np. srebrnej łyżeczki), aluminium oraz ochłodzonego roztworu soli kuchennej i sody zestawiamy baterię. Potrzebujemy jeszcze drutów i słoika po dżemie. Podłączamy do baterii siłniczck modelarski. W naszym nowym ogniwie galwanicznym napięcie pomiędzy srebrem i aluminium jest wyższe niż napięcie pomiędzy cynkiem i miedzią w ogniwie z rozdz. 114. Pomimo tonie uda nam się rozżarzyć za jego pomocą małej żaróweczki.
Doświadczenie 3. Dwa srebrowo-glinowe ogniwa galwaniczne łączymy ze sobą według rys. 58. Roztwory powinny mieć temperaturę pokojową. Gdy wykonamy wszystkie połączenia, mała żarówcezka zaświeci się-udało nam się osiągnąć około 2 V napięcia elektrycznego. Napięcia ogniw połączonych szeregowo dodają się do siebie.
Wykorzystujemy:
miskę porcelanową, aluminiową folię. 2 słoiki, żaróweczkę, izolowane druty miedziane, siłniczck modelarski.
Perfumy, wiśnie i osmoza
120. Wszystko robi się czerwone
Doświadczenie /. Do wysokiego, wąskiego słoja wlewamy 6 łyżeczek czerwonego syropu owocowego i zaznaczamy jego poziom flamastrem. Następnie, bardzo powoli i ostrożnie wlewamy 0.25 dmJ wody. tak by nie zmieszała się z. syropem. Słój odstaw iamy w spokojne, wolne od wstrząsów i drgań mechanicznych miejsce. Codziennie mierzymy linijką poziom, do którego podniosło się zabarwienie cieczy (rys. 59a).
Wyjaśnienie: Sy rop owocowy ma większą gęstość niż woda. Dlatego początkowo pozostaje na dnie słoika. Z powodu ruchu częsteczek syrop z upływem czasu w znosi się powoli do góry - proces trwa. aż do całkowitego
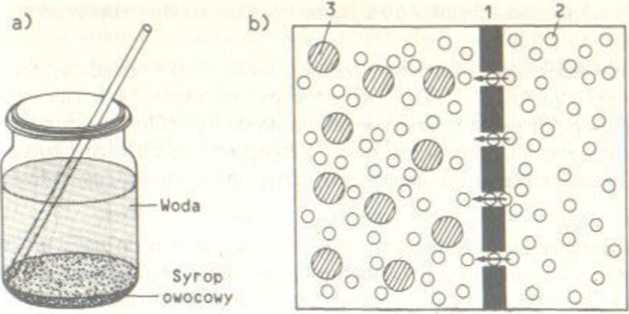
RyS. 59. Ruchy c/ąstcc/ek: ał po pewnym czasie cząsteczki cukru i barwnika zawarte w syropie wymieszają się równomiernie z wodą. b) osmoza. Błona półprzepusze żalna (/) działa
jak sito c/ąstcczkowe (2 - cząsteczki wody. 3 - cząsteczki cukru)
wymieszania się obu cieczy. Proces laki nazywa się dyfuzją (z łacińskiego diffundere- rozprzestrzeniać się) i odgrywa ważną rolę w chemii, biologii oraz fizyce.
Cząsteczki dyfundują z obszaru o dużym stężeniu w kierunku obszaru o mniejszym stężeniu. Dyfuzja zachodzi zarówno w cieczach, jak i w gazach.
Doświadczenie 2. Nieduże naczynie szklane napełniamy wodą i ostrożnie wkładamy na jego dno kry ształ nadmanganianu potasowego. Po kilku dniach możemy zauważyć, że dyfundujące cząsteczki soli zabarwiły wodę na różowo-fioletowy kolor. W pełni równomierne rozprzestrzenienie cząsteczek uzyskuje się dopiero po kilku tygodniach.
Doświadczenie 3. W rogu pokoju stawiamy otwartą buteleczkę z perfumami. Po pewnym czasie zapach jest wyczuwalny w całym pokoju. Dzięki swym ruchom cieplnym cząsteczki perfum rozprzestrzeniły się pomiędzy cząsteczkami powietrza. Dyfuzja zachodzi nawet wbrew sile ciążenia, to znaczy wtedy, gdy dyfundujące cząsteczki są cięższe od cząsteczek, pomiędzy którymi dyfundują. Największe szybkości dyfuzji są obserwowane w gazach.
Wykorzystujemy:
2 wysokie słoje, czerwony syrop owocowy, 1 kryształ nadmanganianu potasowego, perfumy.
143
Wyszukiwarka
Podobne podstrony:
072 (12) Jak to wyjaśnić? Siarczek srebra rozkłada się na srebro i siarkowodór. To, że zaszła reakcj
page0198 188 najmniej hypotetycznie postrzegane były przez obserwatora; jest to postrzeganie, zatem
IMGA08 W przypadku ogólnym wektor główny sił wewnętrznych Fw rozkłada się na składową N, o kierunku
zasilających kotły parowe, gdyż wodorowęglan sodowy podczas odparowywania wody w kotle rozkłada się
a *. ze nie nu wątpliwości — komu. I kobiet 2aś ów ../.ip,wh" rozkłada się .. . na całe ciało i
str 072 073 powstańcy, przemęczeni forsownym marszem, słaniali się na nogach, Edmund zarządził odpoc
CCF20101219�008 (3) • Przeguby walcowe. Prosta działania reakcji przegubu R jest nieznana. Reakcja r
zasilających kotły parowe, gdyż wodorowęglan sodowy podczas odparowywania wody w kotle rozkłada się
o0 JAK SIĘPRZYGOTOWAĆ Do żeglowania musisz przygotować się na lądzie PIERWSZA RZECZ, O KTÓRĄ POWINIE
DSC00290 Badania HUM/MAT Wybór grup zwiększenia założenia o Cała próba N = 390 rozkładała się na trz
Reakcje odwracalne CaC03(s) <d> CaO(s) + CO2(g) W wysokiej temperaturze węglan wapnia rozkłada
Reakcje odwracalne CaC03(s) <d> CaO(s) + CO2(g) W wysokiej temperaturze węglan wapnia rozkłada
Obraz070 spektywa ta jest co najmniej równie prawdziwa i powinna być interesująca dla pracownika soc
więcej podobnych podstron