43733 skanuj0005 (124)

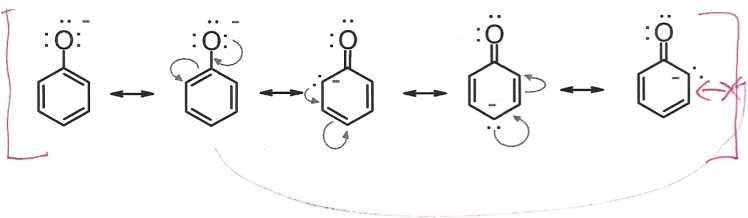
Kwas benzoesowy jest bardziej kwaśny od fenolu, w wyniku elektroujemności. Pary elektronowe wiązania C-0 przesunięte są w stronę atomu tlenu (atom tlenu jest bardziej elektroujemny od atomu węgla), co przyczynia się do „wyciągania" elektronów z pierścienia aromatycznego.
Duży wpływ na kwasowość związków aromatycznych wywierają podstawniki obecne w pierścieniu. Mogą one oddziaływać mezomerycznie lub indukcyjnie. Efekt mezomeryczny jest skuteczny z położenia orto- lub/i para-.
Grupy elektrodonorowe wykazujące efekt +M (EDG), np. -CH3, -OCH3, -NH2, -NHR czy -NR2 obniżają kwasowość fenoli, natomiast grupy o efekcie -M (EWG), np. halogeny, -N02, -COOH i -CN zwiększają moc kwasową fenoli.
Atom azotu „wyciąga" elektrony z pierścienia, gdyż jest bardziej elektroujemny od atomu węgla, po czym elektrony te wraz z elektronami wiązania N-0 przesuwają się w kierunku atomu tlenu (atom tlenu bardziej elektroujemny od atomu azotu).
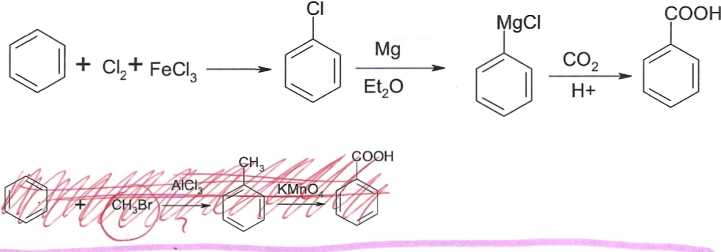
|?| Zaproponuj metodę otrzymywania kwasu benzoesowego z benzenu i dowolnych odczynników nieorganicznych.
5. W jaki sposób można otrzymać oktan-4-on, mając do dyspozycji butan-l-ol, jako
jedyne źródło atomów węgla w cząsteczce produktu i inne odczynniki nieorganiczne?
1) Jeden mol butan-l-olu należy utlenić PCC do aldehydu (butanalu, C3H7CHO).
2) Drugi mol butan-l-olu po wytrząśnięciu ze stęż. HCI daje 1-chlorobutan
Wyszukiwarka
Podobne podstrony:
skanuj0017 222 Kwas benzoesowy jest bezbarwną i bezwonną krystaliczną substancją słabo rozpuszczalną
skanuj0006 (278) Rysunek 8 pokazuje, że dla każdego poziomu stopy dyskontowej przedsięwziąć A jest b
skanuj0037 Każdy robi, co do ricgo należy. Nikt nie jest bardziej wartościowy od innych. Tc rzeczy,
skanuj0007 [800x600] Mimo, że wzór (1) jeat już uproazczoną postacią wzoru ofilnego, to jednak jest
Slajd37 (29) POTENCJAŁ RÓWNOWAG! DLA JONÓW Na+ Potencjał równowagi dla jonów Na+jest bardziej dodatn
skanuj0087 174 piawo Ohma, a opór właściwy elektrolitu jest dużo większy od oporu właściwego elektro
kawaly - Co jest bardziej niekomfortowe od kamyka w bucie? - Zia
Wilk(1) Wilczy trop jest bardziej zwarty od psiego, każda opuszka palcowa odciska się wyraźnie. Podu
72581 skanuj0011 (192) W intencjach starego jest może noc, ale w ich wyniku — na pewno sprawiedliwoś
Strona�5 5 Molibden (temperatura topnienia 2622°C, gęstość 10,2 [kg/m3]), jest bardziej miękki od wo
Szum informacyjny- to co utrudnia komunikowanie Dialog jest bardziej naturalny od monologu Różn
nasycenie) - jest bardziej użyteczna od wektorowej, gdyż trudno jest "przełożyć na krzywe"
więcej podobnych podstron