72724 skanuj0014

fosfataza
R-O-PO3H +h2o
» R-OH + H2P04
Do oznaczeń aktywności fosfataz stosujemy nie fizjologiczny substrat: fosforan p-nitrofenolu (pNPP). Fosfatazy hydrolizują wiązanie estrowe pNPP zgodnie z reakcją:
O
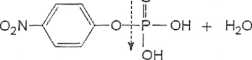
fosfatazo

.p-nitrofenol (pNP)
j?-nitrofenylofosforan (pNPP)
Produktem tej reakcji jest p-nitrofenol, który w silnie alkalicznym pH ma barwę żółtą. Natężenie tej barwy jest wprost proporcjonalne do ilości zhydrolizowanych wiązań estrowych i ilości uwolnionego fosforanu.
Jednostką aktywności enzymatycznej (U) jest taka ilość enzymu, która katalizuje przemianę 1 jimola substratu w ciągu 1 min w temp. 30°C w optymalnym dla enzymu stężeniu substratu oraz związków lub jonów niezbędnych dla jego sprawności katalitycznej, inaczej mówiąc w warunkach optymalnych dla badanego enzymu.
W preparatach uzyskanych z tkanek roślin i zwierząt wyznaczamy również aktywność właściwą enzymów.
Aktywność właściwa to liczba jednostek aktywności (U) przypadająca na 1 mg białka (U/mg białka).
Odczynniki:
1. 8mM fosforan p-nitrofenolu w H20
2.0. 2 M bufory octanowe pH 4,0 - 6,5 3. 0,1 MNaOH
4.0. 9% NaCl
Przygotowanie enzymu:
Schłodzony w lodówce ziemniak obierz i zetrzyj na tarce. Uzyskaną masę wyciśnij starannie przez nylon do niewielkiej zlewki. Otrzymany przesącz wiruj przez 10 min przy 3000 obrotów/min. Supematant przenieś do probówki, oznacz stężenie białka metodą Bradford i używaj do dalszych analiz. Pamiętaj, aby uzyskany ekstrakt przechowywać w lodówce, bowiem większość białek jest stabilna w niskich temperaturach (0 do 4°C)!
Ekstrakt z ziemniaka rozcieńcz 250-krotnie 0,9% NaCl (w kolbie miarowej).
Analiza wpływu pH na aktywność fosfatazy kwaśnej:
Do 18 probówek napipetuj po 0,25 ml 8mM roztworu fosforanu p-nitrofenolu i 0,25 ml buforu o pH od 4,0 do 6,5. Zestaw obejmuje 12 probówek, w których oznaczamy aktywność i 6 probówek stanowiących próby „0”. Próbówki ogrzej przez 5 min w łaźni wodnej o temp. 37°C. Następnie posługując się stoperem w odstępach 30 sekundowych dodaj do każdej z
Wyszukiwarka
Podobne podstrony:
skanuj0102 186 SANATORIUM POD KLEPSYDRĄ Zadrżałem do głębi na ten widok. Nie mogło być wątpliwości.
skanuj0048 (6) Pm linieli >
53932 skanuj0061 (68) PORADNIK mocno pikantny smak - do serów preferowanych przez smakoszy. Nie rozt
skanuj0003 WŁASNOŚCI SPEKTRALNE NUKLEOTYDÓW PIRYDYNOWYCH (NAD+, NADP4) OZNACZANIE AKTYWNOŚCI TRANSAM
29421 Str371 ■ 371 19.5. CHROPOWATOŚĆ POWIERZCHNI pn-iso 13021996 Do oznaczenia chropowatości powier
skanuj0003 WŁASNOŚCI SPEKTRALNE NUKLEOTYDÓW PIRYDYNOWYCH (NAD+, NADP4) OZNACZANIE AKTYWNOŚCI TRANSAM
IMG00371 371 19.5. CHROPOWATOŚĆ POWIERZCHNI PN-ISO 1302:1996 1. Do oznaczenia chropowatości powierzc
więcej podobnych podstron