75376 skanuj002001 (2)
Wszystkie fluorowce tworzy cząsteczki dwuatomowe. Można oczekiwać zmnicj-%/ania się energii wiązania cząsteczek Xj ze wzrostem rozmiarów atomów, powodującym mniej efektywne nakładanie się orbitali Prawidłowość tę obserwuje się w przypadku Cl,. Itr: i I, (tubl. 5.17). Fncrgia wiązania w F, jest anormalnie mała <159 kJ mol co jest spowodowane odpychaniem się elektronów niewiążących; jest lo główna przyczyna dużej reaktywności fluoru. W przypadku chloru, bromu i jodu mogą powstawać wiązania wielokrotne z udziałem orbitali d.
joiumcji clcklronowe
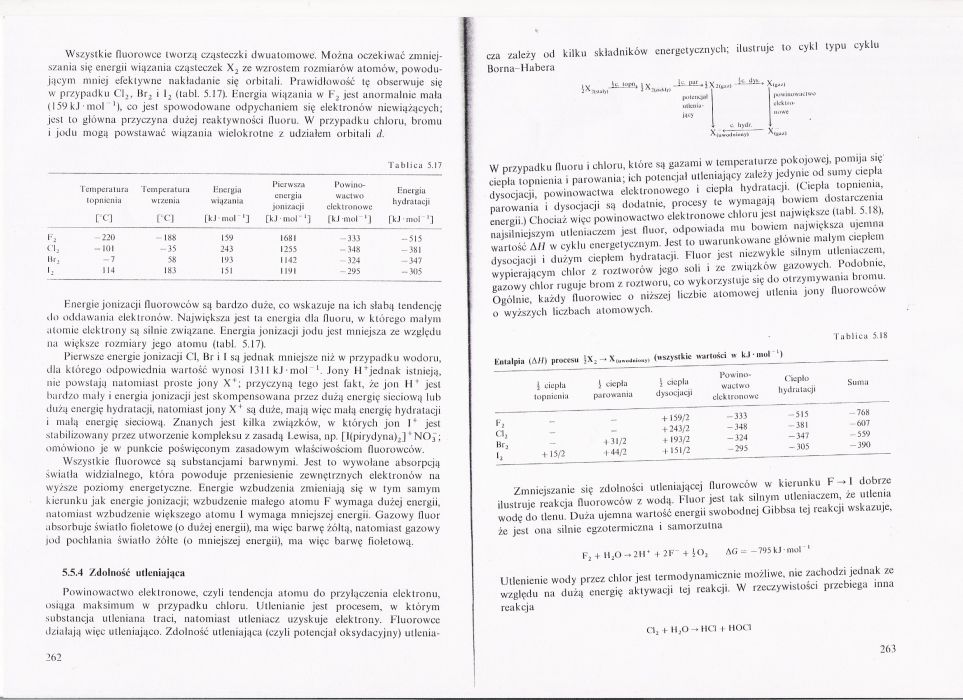
cza zależy o«l kilku składników energetycznych; ilustruje to Borna Habera
cykl typu cyklu

W przypadku fluoru i chloru, które są gazami w temperaturze pokojowej, pomija się ciepła topnienia i parowania: ich potencjał utleniający zależy jedynie od sumy ciepła dysocjacji, powinowactwa elektronowego i ciepła hydratacji. (Ciepła topnienia, parowania i dysocjacji są dodatnie, procesy «e wymagaj;| bowiem dostarczenia energii) Chociaż więc powinowactwo elektronowe chloru jest największe (tabl. 5 18), najsilniejszym utleniaczem jest fluor, odpowiada mu bowiem największa ujemna wartość Ali w cyklu energetycznym. Jest to uwarunkowane głównie małym ciepłem dysocjacji i dużym ciepłem hydratacji. Fluor jest niezwykle silnym utleniaczem, wypierającym chlor z roztworów jego soli i ze związków gazowych. Podobnie, gazowy chlor ruguje brom z roztworu, co wykorzystuje się do otrzymywania bromu. Ogólnie, każdy fluorowicc o niższej liczbie atomowej utlenia jony fluorowców o wyższych liczbach atomowych.
knulpia (Alit prwou - X,—4««*y*lkk twlotó » U-mul I

+ 15/2
Wyszukiwarka
Podobne podstrony:
skanuj002001 (2) Wszystkie fluorowce tworzy cząsteczki dwuatomowe. Można oczekiwać zmnicj-%/ania się
skanuj0020 174 Magdalena Podsiadło cząstek”. Mimo to opuszcza Brooklyn i przenosi się na Manhattan.
skanuj0020 174 Magdalena Podsiadło cząstek”. Mimo to opuszcza Brooklyn i przenosi się na Manhattan.
0000025 (17) Powyższe rozważania można zilustrować dla przykładu obliczeniem energii wiązania jądra
skanuj0037 (110) 74 Metody nauczania i wychowania (można zapytać, czy wszystko można głosować); w pr
skanuj0034 [Oryginalna Rozdzielczość] awdzawe są odpowiedzi gju wszystkie V 1.2.3.5 1.3, 4,5 1.2.5 2
skanuj0085 TAO DAJE ŻYCIE WSZYSTKIM ISTOTOM... TWORZY. NICZEGO SOBIE NIE PRZYWŁASZCZAJĄC, DZIAŁ
skanuj0153 38 ZARZĄDZANIE ZASOBAMI LUDZKIMI de wszystkim w tych firmach, w których nie można stwierd
75928 skanuj0037 (110) 74 Metody nauczania i wychowania (można zapytać, czy wszystko można głosować)
52889 skanuj0016 (313) tem są wszystkie dobra materialne i usługi, które można zaoferować na rynku n
więcej podobnych podstron