25

Tabela 12.2. Osoczowc czynniki krzepnięcia krwi
|
Czynnik |
Rola w krzepnięciu, budowa, właściwości |
M.ez. |
Stężenie |
w osoczu | |
|
[miejsce syntezy] |
(kDa) |
(ig/rnl | |||
|
I |
Fibrynogen |
Prekursor fibryny, dimcrycz.na struktura cząsteczki, 3 pary łańcuchów' [wątroba] |
340 |
3000 |
8,82 |
|
1) |
Protrombina |
proenzym przekształcany w proteazę serynową (trombinę), 1-łańcuchowa CIP* zależna od witaminy K [wątroba] |
72 |
100 |
1,39 |
|
11) |
Czynnik tkankowy (TF) |
kofaktor, integralna GP* błon komórkowych, aktywna w połączeniu z fosfolipidami | |||
|
IV |
Jony wapnia | ||||
|
V |
Proakccleryna |
prokofaktor cz. Va, 1-łańcuchowa GP* szybko inaktywowana działaniem aktywnego białkti C [wątroba] |
330 |
10 |
0,03 |
|
VI |
Prokonwcrlyna |
proenzym przekształcany w proteazę serynową (cz. V!fa), I-łańcuchowa GP* zależna od witaminy K |
50 |
0,5 |
0,01 |
|
VIII |
cz. pi/.cciw-hemofiiowy A |
prokofaktor cz. VIIla, 1 łańcuch, w osoczu występuje w kompleksie z czynnikiem von Willebranda, szybko inaktywowany przez aktywne białko 0; niedobór lub anomalia przyczyna hemofilii A [wątroba] |
330 |
OJ |
0,0003 |
|
IX |
cz. p rzec i w-hcmofiłowy B |
proenzym przekształcany w proteazę serynową (ez. lXa), 1 łańcuch, zależny od witaminy K; niedobór lub anomalia przyczyną hemofilii B [wątroba j |
56 |
5 |
0,089 |
|
X |
cz. Stuarta -Powera |
proenzym przekształcany w proteazę .serynową {cz. Xa), 2 łańcuchy, zależny od witaminy K [wątroba] |
58 |
9 |
0,153 |
|
XI |
cz. przed w-hcmofilowy (i |
proenzym przekształcany w proteazę serynową (cz. XIa), 2 łańcuchy; niedobór lub anomalia przyczyną hemofilii C [wątroba] |
160 |
ś |
0,0312 |
|
XII |
cz. Ha gema na |
proenzym przekształcany w proteazę serynową (cz. XIla), 1-łańcuchowa GP* |
80 |
90 |
1,125 |
|
XIII |
cz. stabilizujący fibrynę |
proenzym przekształcany w transglutarni-nazę (cz. Xllla), 2 pary łańcuchów [ śród-błonek, megakariocyty, makrofagi, mono-cyty, wątroba] |
320 |
10 |
0,0312 |
|
Prekalikreina |
proenzym przekształcany w proteazę serynową (kalikreinę), 1 łańcuch [wątroba?] |
86 |
50 |
0,581 | |
|
Kininogcn wielkocząsteczkowy |
kofaktor białkowy |
110 |
70 |
0,638 | |
|
* Gf> ■■ |
■ glikoprotcina. |
cz. X uległ aktywacji wc wspomnianym już układzie wewnątrzpochodnym, czy zewnątrzpochodnym. W tym drugim ciąg reakcji rozpoczyna się od aktywacji czynnika VII przez cz. tkankowy (TF). Dwuskładnikowy kompleks aktywny przekształca cz. X —► Xa. Pojęcie wewnąlrzpochodny i zewnątrzpochodny układ krzepnięcia krwi wprowadzili badacze angielscy w połowic lat 60. dla podkreślenia występowania 2 ścieżek wytwarzania trombiny. Oba systemy, jak dzisiaj wiadomo,
Aktywacja wewnątrzpochodna Aktywacja zewnątrzpochodna
(odsłonięcie powierzchni) (uszkodzenie komórek)
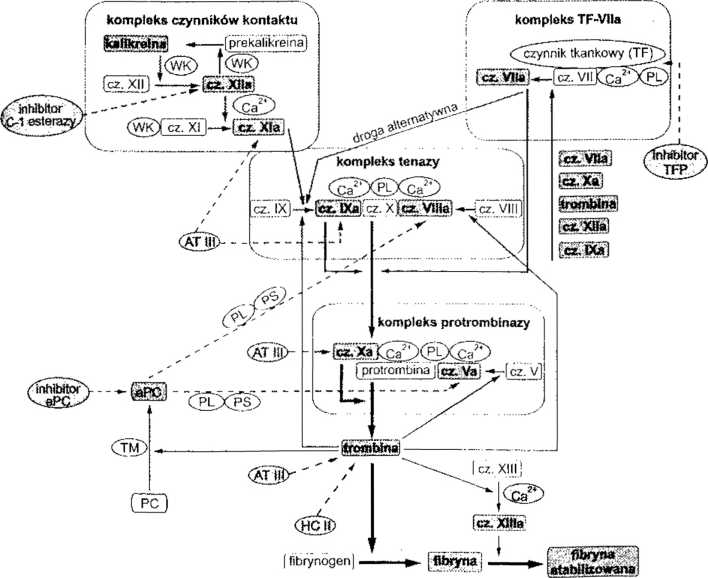
-—- aktywacja
.....► hamowanie
[ | czynnik nieaktywny
gggg czynnik aktywny C kofaktor r> inhibitor
WK wielkocząsteczkowy kininogen PL fosfolipid
PC białko C aPC aktywne białko C PS białko S TM trombomodulina AT III antytrombina III HC II kofaktor II heparyny TFP inhibitor zewnątrzpochodnego krzepnięcia działający za pośrednictwem TF
Rys. 12.10. Schemat kaskadowego mechanizmu krzepnięcia krwi z uwzględnieniem udziału ważniejszych inhibitorów
625
Wyszukiwarka
Podobne podstrony:
Grupy krwi Tabela 12.8. Genotypy i fenotypy grupy krwi Xg Pteć Genotypy Fenotypy Częstość
082061890BF377741C964A1D0C482A6C?5667 m OSOCZOWE CZYNNIKI KRZEPNIĘCIA KRWI I Fibry
^Kjoarowania czynnikiem ludzkim Tabela 9.12. Produkcja, przeciętna liczba mac..... ł koszty stałe w
Tabela V. Charakterystyka nicieniaDirofilaria repens (12,20) Czynnik etiologiczny nicień Dirofilar
Tabela V. Charakterystyka nicienia Dirofilaria repens (12,20) Czynnik etiologiczny nicień Dirofila
DSC01772 [^■następstwa krwotoku W kontakcie z tkankami dochodzi do aktywacji osoczowych czynników kr
momentu pobrania i zawiera wszystkie osoczowe czynniki krzepnięcia, w tym nietrwałe - V oraz VIII. C
DSCN2955 (2) Leki stosowane w skazach osoczowych Preparaty osoczowych czynników krzepnięcia Wazopres
Tabela 2. Określenie wagi czynników w diagramie relacji dla problemu „Dlaczego herbata jest niesmacz
Czas. Stomatol., U. Kaczmarek i in. Tabela 5 . Związek wybranych czynników z wyborem technik opracow
więcej podobnych podstron