44 (358)

46
Struktura pierwszorzędowa białek
Kolejność występowania aminokwasów, czyli ich sekwencja w łańcuchu polipeptydowym, określa strukturę pierwszorzędową. Sekwencja aminokwasów jest warunkowana genetycznie (wyznacza ją sekwencja nukleotydów w DNA).
— Arg — Val —Glu — Lys —Met — Val — Leu — Ala —Gly Rys. 31. Struktura pierwszorzędowa (sekwencja aminokwasów)
Dwadzieścia rodzajów aminokwasów występujących w białkach można uważać za litery białkowego alfabetu; każde białko oznaczone jest słowem utworzonym z liter aminokwasów.
Struktura drugorzędowa białek
Regularne pofałdowanie regionów łańcucha polipeptydowego określa strukturę drugorzędową białka. Najczęściej występującymi sposobami pofałdowania są a helisa i struktura p.Wa helisie aminokwasy ustawiają się w ten sposób, że powstaje regularna konformacja przypominająca cylinder. Tlen karbonylowy każdego wiązania peptydowego jest połączony wiązaniem wodorowym z wodorem grupy aminowej czwartego z kolei aminokwasu. Wszystkie łańcuchy boczne aminokwasów znajdują się na zewnątrz cylindrycznej helisy.
3,6 aminokwasów na obrót
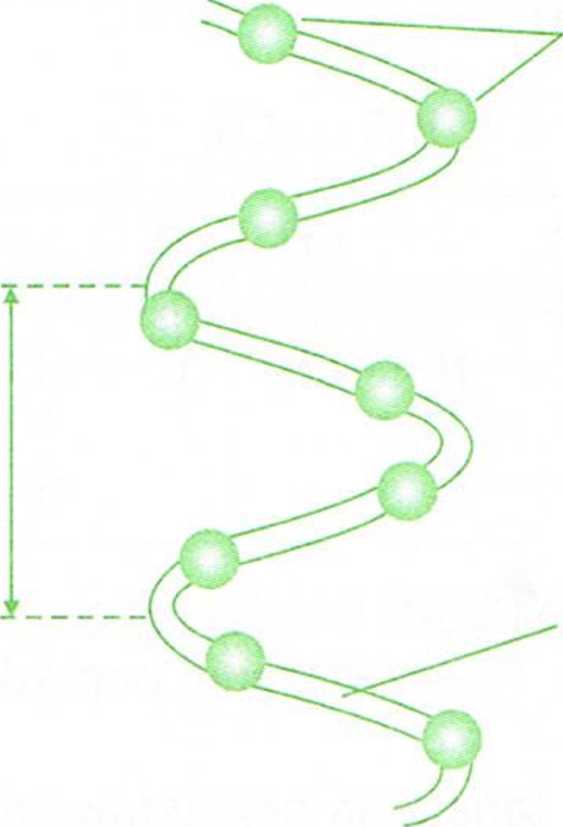
atomy Ca kolejnych reszt aminokwasów
położenie szkieletu polipeptydowego złożonego z atomów Ca i C-N wiązania peptydowego

|
H |
H |
H |
0 |
H |
H |
H |
0 II |
H | |||
|
N - |
-C —C |
—N |
—C- |
-c |
—N - |
C C |
-N |
—C- |
-c- |
-N |
C C |
|
H |
R, 0 |
H |
r3 ó |
R, |
H |
R5 0 |
t
L___________________________
wiązanie wodorowe
Rys. 32. Fałdowanie się łańcucha polipeptydowego w a helisę. A - model a helisy; B - w helisie grupa CO reszty n jest połączona wiązaniem wodorowym z grupą NH reszty (n + 4).
Wyszukiwarka
Podobne podstrony:
Zdjecie2111 Rozwój osobniczy przebiega przez kolejno występujące po sobie stadia. Sekwencja zmian ro
68770 P1060815 Struktura białek Jest 20 aminokwasów = 10 polarnych i 10 niepolamych Struktura pierws
104 Tomasz Gugala SOWINIEC nr 44 nizacji Małopolski. Pierwsze spotkanie odbyło się 7 grudnia 19
Scan0160 ~mmm HBIIII •> fili Pierwsza uzda. Kolejny krok procesu, który niezmiennie kończy się ty
page0044 44 jak ci pierwsi poszukiwacze złota, którzy poszli go szukać do Klondyke w Alasce. Ich ene
JUŻ WIEM POTRAFIĘ W MIEŚCIE (05) Opowiedz historyjkę obrazkową. Ponumeruj obrazki według kolejności
K ?jna DIALEKTY POLSKIEz823 Y pierwszym łypie stale występowało w temacie długie a powstałe ze ściąg
17094 SDC10993 na palatalizację, podane w kolejności występowania w tekście: kmiźmikomi, por. kimga;
więcej podobnych podstron