42C

42 Ćwiczenia rachunkowe z chemn Jizu zncj
Rozwiązanie
Sialu równowagi K = —gdzie pco jest prężnością dysocjacji,
< P
a p = 1.013 10 |Pa| (I |a(m]) — ciśnieniem standardowym. Stosując równanie i/ohary Van*t HofTa:
Air
RT2
’ dr
otrzymujemy:
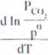
AM"
RT2
M ‘ iii
Ponieważ Al I = const., to oznaczając
P
T» = 1195 |K|, można napisać:
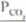
P
= p2dl.t

In p2 = In 83440 +
sti|d:
12.021
2.66 • 10* |J mol *| (I 193 - II65)|KI
8,314 U -mol’1 K '| II95(KJ 1165 |K|
st;|d
p2 = 1.66 I0\ a pJ C0 = 1,66 I05 (Pa|
Uwaga: W obliczeniach przyjęto, że 1,013 • 105 [Pal » I • 10 [Pa].
4.3. Dla reakcji syntezy acetylenu:
2C(ł) + H2(ł)£i C2Hj(<)
Rozdział 4
43
w zakresie temperatur od 7(K) ♦ 1500 |K| standardowa entalpia reakcji jest funkcją temperatury
Air = 2.29X 10* - 6.573 T |J/nml|
Obliczyć wartość stałej równowagi Kn w temp. 1500 |KJ. jeżeli w temp. 700 [KI Kp = 7,94 |0‘\
Rozwiązanie
Stosujemy równanie i/.obary Van*t Moffa:
ll 1,1 KP _ Alf _ 2,298 IOł - 6.573 T d T ' KT; RT5
stąd pi» statkowaniu:
|
-5" Kr.» |
2.29X ■ !()' ( 1 u [f; |
1 1 6.573 . Tj |
|
InK , |
= 32.00 | |
|
p-1 | ||
|
InK , n. I |
= 32,00 + 21.059 |
- 0.6025 = 52.456 |
Stąd
Kp,,500 = 6.05 - I0i!
4.4. Stała równowagi reakcji C + 2H2 = CH, w temp. T, = 973 [K] wynosi Kp.| = 0.195. Obliczyć Kp,wT, = 1023 (KJ jeżeli standardowa entalpia reakcji AHJooo = -89.792 [kJl. '
R = 8.314 (J • mol'1 ■ K'l
Wyszukiwarka
Podobne podstrony:
ELEMENTARZ ĆWICZENIA W PISANIU I CZYTANIU CZ1 42 3. Wpisz wyraz, który jest rozwiązaniem krzyżówk
56W 5(5 Ćwiczenia rachunkowe z chemii fizycznej Rozwiązanie Korzystamy z odpowiednio przekształconeg
ORTOGRAFIA KL1 4 ZESZYT 4 CH H (42) ĆWICZENIA UTRWALAJĄCE I SPRAWDZAJĄCE 1. Rozwiąż rebusy i napisz
Metody nauczania ćwiczenia rachunkowe I rozwiązywanie przykładowych zadań na tablicy przy
rachunekkosztów RACHUNEK KOSZTÓW - ĆWICZENIA Z2012/2013 KALKULACJA KOSZTÓW - ROZWIĄZANIA ZADAŃ - KAL
ORTOGRAFIA KL1 4 ZESZYT 4 CH H (42) ĆWICZENIA UTRWALAJĄCE I SPRAWDZAJĄCE Rozwiąż rebusy i napisz ro
fiz0 Zadania na ćwiczenia rachunkowe z fizyki w dniu 17 grudnia 2007INFORMATYKA GEOLOGICZNA I ROK 1.
skanuj0008 (450) MSG ćwiczenia praca samodzielna Studia Dzienne Rozwiąż zadanie: Jesteś Prezesem fir
Metody dydaktyczne: Wykład (multimedialny) 15 tygodni (45 godzin), konwerstaorium 1 (ćwiczenia rachu
PRACUJĘ Z SZEŚCIOLATKIEM ZESZYT ĆWICZEŃ (42) a Ćwiczenie 16
makroekonomia ćwiczenia (7) Rachunek produktu i dochodu narodowego Przykład 1. Obliczanie PKB metod
ELEMENTARZ ĆWICZENIA W PISANIU I CZYTANIU CZ1 52 2. Rozwiąż krzyżówkę. 1. Natrę
więcej podobnych podstron