60
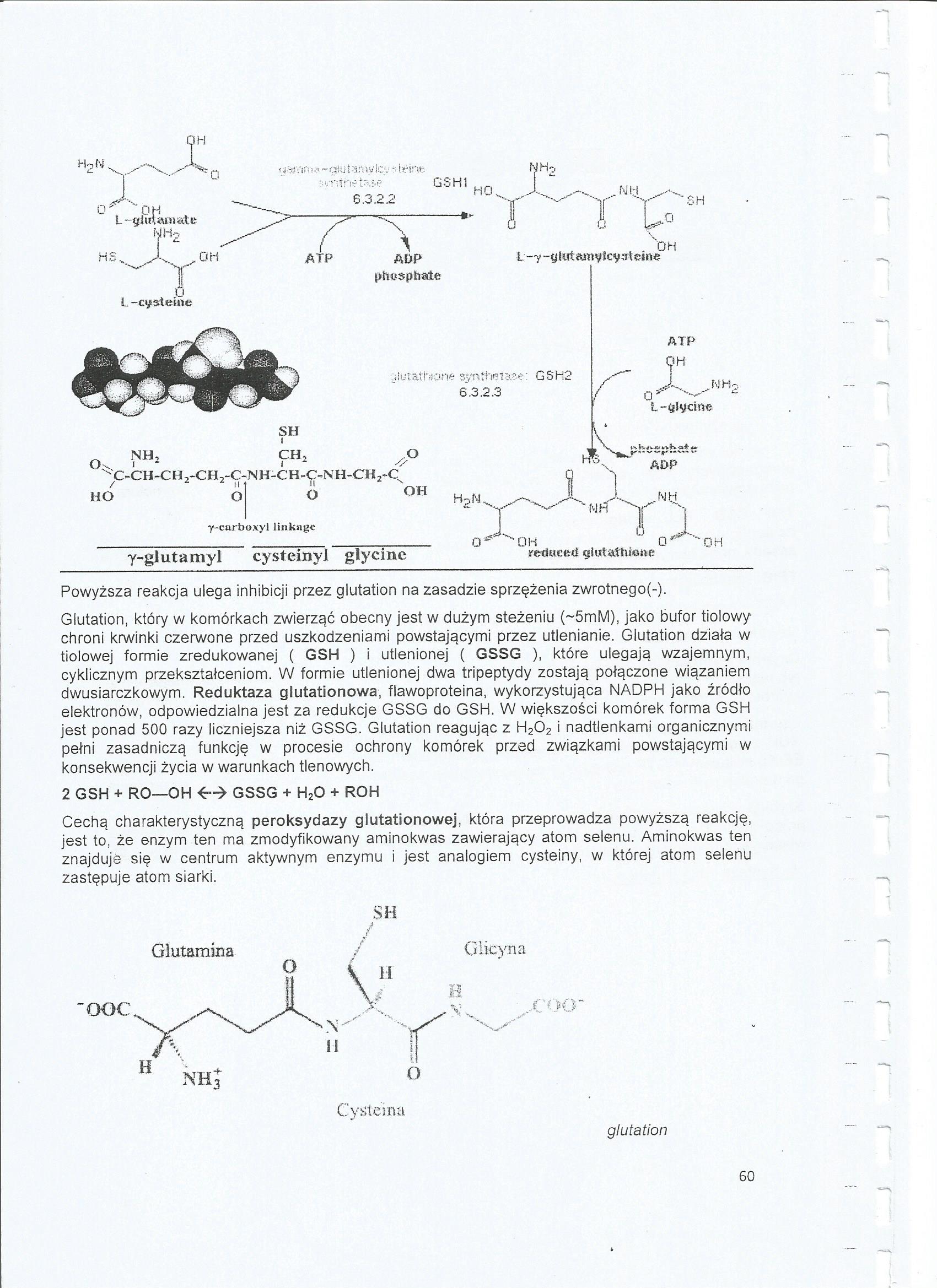
Ł-Y-glutamylcystehM?
NHo
OH
^ NHt
Oiv 1
SH
i
CH,
ulutatNone synthat^' GSH2 6.3.2.3
O
\
ATP
;ih
MH-
-glycine
HO
C-CH-CH2-CH2-C-NH-CH-ę-NH-CH2-C
AOP
O
O
OH
y~carboxył linkngc
y-glutamyl cysteiny! glycine
oi'OH
MH
MH
retłuce-tf git.tlaliuone
jH
Powyższa reakcja ulega inhibicji przez glutation na zasadzie sprzężenia zwrotnego(-).
Glutation, który w komórkach zwierząć obecny jest w dużym stężeniu (~5mM), jako bufor holowy chroni krwinki czerwone przed uszkodzeniami powstającymi przez utlenianie. Glutation działa w tiolowej formie zredukowanej ( GSH ) i utlenionej ( GSSG ), które ulegają wzajemnym, cyklicznym przekształceniom. W formie utlenionej dwa tripeptydy zostają połączone wiązaniem dwusiarczkowym. Reduktaza glutationowa, flawoproteina, wykorzystująca NADPH jako źródło elektronów, odpowiedzialna jest za redukcje GSSG do GSH. W większości komórek forma GSH jest ponad 500 razy liczniejsza niż GSSG. Glutation reagując z H202 i nadtlenkami organicznymi pełni zasadniczą funkcję w procesie ochrony komórek przed związkami powstającymi w konsekwencji życia w warunkach tlenowych.
2 GSH + RO—OH GSSG + H20 + ROH
Cechą charakterystyczną peroksydazy glutationowej, która przeprowadza powyższą reakcję, jest to, że enzym ten ma zmodyfikowany aminokwas zawierający atom selenu. Aminokwas ten znajduje się w centrum aktywnym enzymu i jest analogiem cysteiny, w której atom selenu zastępuje atom siarki.
SH
i
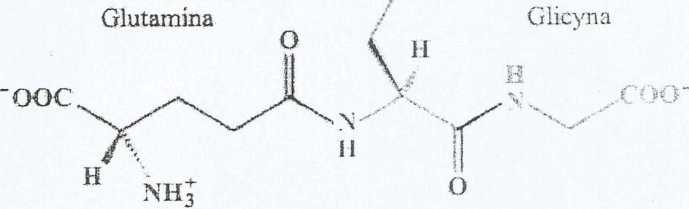
Cysteina
glutation
60
Wyszukiwarka
Podobne podstrony:
19wz1 Ł2ł2
59wz 969 Sgsjfl : 080-047-8000 Ł^si ago
69994 Synchroniczne0009 AEw -O noc ciMNnb nkiznuy sh a/ ch p.o a/i c-z w ej pa."*- * pmc.v //a
59wz 969 Sgsjfl : 080-047-8000 Ł^si ago
GHs-OH HO-C7H + CHrO-(P) R,-C-S-CoA RrC-S-CoA R7C-O-CH K’ CHr0-(P) + 2Co A-SH [15-19] Wytworzony
hydroksykwasy ch2cooh II CH3—CH—COOH i OH OH Kwas glikolowy Kwas mlekowy COOH I CH, 1
skanuj0019 (217) CHjO-OC-Ri R,-C0-0-CH OI II CH2—O—P—OH OH
img275 CH,— OH I c = o I CHj— o — po!- NADH + H+ fosfodihydroksyaceton dehydrogenaza
2 1.4- 1.2 £ 1.0 Ul, 0.8 bD 0.6 oh B 0.4 0.2- o-l Ch lorophy 11 a
SPEKTROSKOPIA NMR W BADANIACH STRUKTURALNYCH KWASÓW NUKLEINOWYCH CZĘSC I 55 O OH O P O O CH t NM O P
więcej podobnych podstron