Berylowce
Be - odkrył 1798 L.N. Vauquelin, a w czystej postaci wyizolował 1828 F.
WOhler-nazwa z greckiego beryllios - nazwa minerału 8e3AI, [Si60,s]; Mg, magnesium łac. -kraina w Tesalił metaliczny magnez otrzymał w 1808 H.B. Davy (Sir Humphry Bartholomew). (w czystej postaci - 1829 A.A. Bussy).
Ca, calcium, łac. Calx -wapno pierwiastek odkrył (otrzymał w wyniku elektrolizy) 1808 H.B. Davy.
Ba, barium, (z grec. Ba rys = ciężki) odkrył 1774 K.W. Scheele, a wyizolował w czystej postaci 1808 H. B.Dayy.
Sr, strontium (nazwa pochodzi od Szkockiego miasta Strontian),
otrzymany 1808 H.B. Davy.
Ra, radium, (łac. -radius = promień) rad został odkryty 1898 przez M. Skłodowską-Curie i P. Curie (w postaci metalicznej otrzymany 1910 przez Skłodowską-Curie,^

|
Właściwość |
Be |
Mg |
Ca |
Sr |
Ba |
Ra | |
|
H - [U moł-1] (298K) | |||||||
|
atomłzacjl |
324 |
146 |
178 |
164 |
178 |
130 | |
|
I AH Jonizacji M(a)-*M{#)* |
899,5 |
737,7 |
589,8 |
549,5 |
502,8 |
509,3 | |
|
II M2ł |
1757 |
1451 |
1145 |
1064 |
965,2 |
979,0 | |
|
III M** |
14850 |
7733 |
4912 |
4138 |
3619 |
3300 | |
|
Entalpia hydratacji | |||||||
|
-2500 |
-1931 |
-1586 |
-1456 |
-1316 | |||
|
Temp. top. [K] |
1560 |
923 |
1115 |
1040 |
1000 |
973 | |
|
Temp. wrzenia [K] |
*3040 |
1380 |
1757 |
1657 |
1913 |
1413 | |
|
Std. Potencjał Redukcji | |||||||
|
E*..* IV] |
-2,37 |
-2.87 |
-2,89 |
-2,90 |
-2,92 | ||
|
Promień metaliczny r^ |
112 |
160 |
197 |
215 |
224 |
- | |
|
ppm dla koordynacji 12 |
hep |
hep |
cep |
ccp |
bcc |
bcc | |
|
Promień jonowy r ^ w ppm | |||||||
|
dla koordynacji 4 dla Be3* |
27 |
72 |
100 |
126 |
142 |
148 | |
|
16 dla pozostałych | |||||||
|
Wykłady |
• PKXr torszensztejr | ||||||
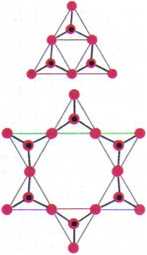
beryl - Be3AI2 [Si60,8]; —■» cykliczne aniony krzemianowe
Ogólny wzór:
SZMARAGD - odmiana berylu
0 zielonej barwie, przypisywanej
zwykle drobnej domieszce chromu; ceniony kamień szlachetny; używany w jubilerstwie (od starożytności). AKWAMARYN akwamaryna,
minerał, niebieskawo zielona, przezroczysta odmiana berylu; cenny kamień szlachetny; gt. złoża w Brazylii
1 na Madagaskarze; używany w jubilerstwie.
MORGANIT & HEUODOR
2 n-’3n
Wkłady - Płotr Kirszensztejn
• =0
• = Si
Występowanie
skorupa ziemska:
Be- 2,8x10-*; Mg-2,33 ; Ca- 4,15; Sr- 10 2; Ba - 10 2
Ra (blenda uranowa - smolista lg Ra - 10T rudy)
% wagowe
Konfiguracja atomowa: ns2
|
Pierwiastek |
Be |
Mg |
Ca |
Sr |
Ba |
Ra |
|
U. atomowa |
4 |
12 |
20 |
38 |
56 |
88 |
|
Izotopy (ile’ i najbardziej trwały) |
° 1 |
3 ;:.Mg r,Mg %Mg |
e ;cb (42; 43; 44; 46; 48) |
4 ™Sr (84; §& 8Z;90) |
7 Ba (130; 132 134,135 136:137) |
4 a,P,Y Od 42 min do 1599 lat |
Właściwości fizyczne
Punctum guaestionis-
W przypadku pierwiastków grypy metali ziem alkalicznych -podobnie jak dla litowców obserwuje sie wyraśny wpływ wzrostu promienia atomowego i jonowego na właściwości fizyczne i chemiczne
1. Wzrasta mechaniczna twardość w porównaniu do 1 grupy I. wskazuje na wzrost siły wiązania metalicznego
i. konsekwencja wzrostu ilości dostępnych elektronów
2. Promienie atomowe grupy 2 są mniejsze aniżeli grupy 1 i. To zmniejszenie promienia prowadzi do
I. Ich większej gęstości
i. Co prowadzi do większej ich twardości, wyższych temperatur topnienia i wrzenia)
ii. Wyższych energii jonizacji (w odniesieniu do grupy 1)
i. Energie jonizacji obniżają się w dół grupy (jako, że promienie się zwiększają)
ii. w konsekwencji pierwiastki stają się bardziej reaktywne i bardziej eiektrododatrye i łatwiej tworzą jon +2
iii. To obniżenie energii jonizacji znajduje swoje odbide w trendach
_potencjałów standardowych pary M-7M_
1
Wyszukiwarka
Podobne podstrony:
Chemia rep39 małą rozpuszczalność stężenie jonów w roztworach osiąga niskie wartości. Metale ziem al
metale1 NAZWISKO 1 IMIĘ’. ..U* GRUPA: ...3.................. GRUPA: KONSTRUKCJE METALOWE SEM,i EGZAM
47001 IMGf41 [slajdy] Skład szkła tlenki zasadowe metali alkalicznych (Na20, KzO) i ziem alkalicznyc
5 Szerokie stosowanie metali alkalicznych z recyklingu lub metali ziem alkalicznych w
img143 oCa2+ + C2042 -» CaC204 4 CaC204 ■l + FU —> Ca2 + HC204 GRUPA V Mg2+ kation magnezu 1.
skanowanie0010 (134) Normy żywienia dla ludności Polski: Skfadniki mineralne (i)1 Grupa pteć, wiek
skanowanie0023 (57) Normy żywienia dla ludności Polski: Składniki mineralne (I)1 Grupa pięć, wiek&
69427 skanowanie0023 (57) Normy żywienia dla ludności Polski: Składniki mineralne (I)1 Grupa pięć,
skanowanie0010 (134) Normy żywienia dla ludności Polski: Skfadniki mineralne (i)1 Grupa pteć, wiek
img143 oCa2+ + C2042 -» CaC204 i CaC204i + H* -» Ca2+ + HC204 GRUPA VMg2+ kation magnezu 1.
skanowanie0010 (134) Normy żywienia dla ludności Polski: Skfadniki mineralne (i)1 Grupa pteć, wiek
pdr11 Magnez i wapńJakie właściwości mają magnez i wapń ? lagnez i wapń to metale o srebrzystobialej
pdr14 ► Magnez i wapń to srebrzystobiałe metale o charakterystycznym połysku, .w:&
69427 skanowanie0023 (57) Normy żywienia dla ludności Polski: Składniki mineralne (I)1 Grupa pięć,
więcej podobnych podstron