DSC00846
Kanały A^-zależne
Specjalne miejsce zajmują kanały, których światło regulowane jest różnicą potencjału błonowego (AT). Można je uznać za formę receptorów jonotropowych, które nie mają miejsc wiążących ligandy, ale w których sygnał (spadek potencjału w najbliższym otoczeniu) powoduje przesunięcie oligomerowej struktury podjednostek tworzących kanał.
Gęstość AY-zależnych kanałów sodowych w nagim aksonie i na początku elementu presy-naptycznego jest niewielka. 5-500/pnr. a więc ~1:I06 białek błonowych. Kanały te są od siebie oddalone średnio o ok. 200 nm. Zgodność tych danych liczbowych potwierdzono zarówno techniką „patch-clamping". jak i mierzeniem związania w błonie aksonu radioaktywnie znakowanych toksyn — ligandów dla kanałów (np. tetrodotoksyny i saksitoksyny).
Oczyszczony A^F-zależny kanał Na' płytki nerwowo-mięśniowej węgorza (źródło izolacji o bardzo dużym zagęszczeniu kanałów) jest pojedynczym polipetydem o masie 250-270 kD (w A^-zaleźnym kanale Na+ mózgu szczura występuje dodatkowo łańcuch P, — 39 kD i — 37 kD). Jego sekwencję wydcdukowano z klonowanego cDNA. Białko to zawiera 4 homologiczne domeny transbłonowe po ok. 300 aminokwasów każda, połączone i osłonięte przez krótsze odcinki reszt niehomołogicznych. Każda z domen składa się z sześciu helis transbłonowych. Pięć z tych helis jest wybitnie hydrofobowych, natomiast helisa 4 jest silnie naładowana dodatnio (rys. 32.5). Uważa się. że w helisach 4 każdej z domen zlokalizowany jest czujnik kanału wobec AS*. Helisy tych pętli, pełniące funkcję furtki, zawierają liczne (prawie co trzecia) reszty argininy lub lizyny. Pewne z tych reszt lub całe helisy 4 w momencie otwierania kanału przesuwają swą pozycję od strony cytoplazmatycznej ku zewnętrznej powierzchni błony komórkowej.
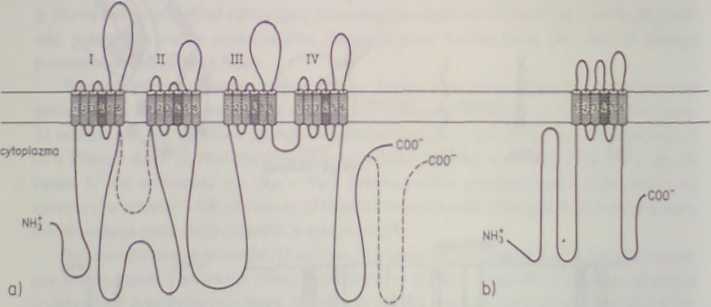
Ryk. 32.5. Przypuszczalna tram błonowa Mruk tura białek tworzących .Vl' /alc/nc kanały; a — białko tworzące AT-za-le/ny kanał Na* (1800-2000 AA): przerywana linią zaznaczono jedyne różnice występujące w analogicznym białku A¥-zaleZnegokanału Ca2*; b—białko tworzące .VH-/ależny kanał K* (-400 AA. shaker); cztery takie białka wytwarzają kanał K\ Helisy N*4 każdej domeny działają jako czujnik potencjału i zawierają liczne reszty argininy i lizyny
AY-zalcźny kanał Ca:\ obecny w elemencie presynaptycznym, ma budowę molekularną bardzo podobną do AY-zalcżnego kanału Na\ z którym wykazuje 30% identyczności oraz dalszych 36% wyraźnego podobieństwa sekwencji.
Jeden z AY-zależnych kanałów K\ wyizolowany z Drosophila (tzw. shaker) jest peptydem 3-4 razy krótszym (616 aminokwasów), o budowie bardzo zbliżonej do pojedynczej domeny
576
Wyszukiwarka
Podobne podstrony:
DSC00844 Kanały i ich przewodnictwo Pompy, receptory i kanały są tymi kompleksami białek błonowych,
DSC00840 2 SZWEDZKI KURS PODSTAWOWYprzeczenia W zdaniu przeczącym pierwsze miejsce zajmuje podmiot,
DSC00840 (10) SZWEDZKI KURS PODSTAWOWY4 wmm W zdaniu przeczącym pierwsze miejsce zajmuje podmiot, na
DSC00840 (12) SZWEDZKI KURS PODSTAWOWY ♦ Erzeczenia W zdaniu przeczącym pierwsze miejsce zajmuje pod
skanuj0009 (389) OBLICZANIE DŁUGOŚCI POMIAROWEJ PO ZERWANIU Długość pomiarową L. po zerwaniu w zależ
zdjęcie0606 Spółgłoski • w zależności od miejsca artykulacji wyróżnia
stat2a S. Jakie metody wnioskowania zastosujesz w analizie zależności między miejscem zamieszkania b
IMG 20 Podział i rodzaje odracnoww zależności od: * Miejsca zadziałania - własne,
Wsrod liter znajdz i zamaluj nazwy 8 miejscowości na Podkarpaciu, w których są zamki omawiane w czas
IMG?65 ®QŁ*l r AM- - 2 i;., ! w zależności od miejsca, wies
page0247 SCTILEIRRMACIIER. 245 po nich lub obok nich Biesiada, Fedrus, Me n e x e n. Ostatnie miejsc
page0733 725Rzymska literatura najwyższe bez wątpienia miejsce zajmuje Titus Livius (z przydomkiem P
49636 skanuj0009 (389) OBLICZANIE DŁUGOŚCI POMIAROWEJ PO ZERWANIU Długość pomiarową L. po zerwaniu w
Znaczące miejsce zajmuje Polska także w produkcji owoców jagodowych (truskawek, malin i porzeczek)
więcej podobnych podstron