3582327079
|
Laboratorium chemii fizycznej |
Warszawa, 13.05.2003 | |
|
Sprawozdanie z ćwiczenia: ..Badanie kompleksowych jonów metali metodą polarografii zmiennoprądowej prostokątnej." | ||
|
Ćwiczenie przeprowadzili: |
Ocena z przygotowania: |
Ocena ze sprawozdania: |
|
- Łuka siak Paweł | ||
|
- Pietruszko Adam | ||
|
- SyzdekJarosław | ||
l.Ceł ćwiczenia.
Celem ćwiczenia jest wyznaczenie zależności potencjału półfali jonu kompleksowego wzglądem NEK w funkcji stążenia ligandu: Ei# = /t[L3) i wyznaczenie na tej podstawie liczby koordynacyjnej kompleksu oraz stałej
trwałości kompleksu [3 w temperaturze_°C.
2.Wprowadzenie teoretyczne.
Obiektem badań jest kompleks winianowy kationów miedzi (li) o wzorze ogólnym: [Cu(C4H406)p322p, tworzący sią zgodnie z równaniem:
Cu2+ + pC4H4062- o [Cu(C4H406)p]2'2p
[cu(C4H406)p~2p
Stała równowagi tej reakcji nazywa się trwałości kompleksu: /? =
Cuił][c4HaOe!-]'
(1)
Dla nieskompleksowanych kationów Cu zachodzi reakcja na elektrodzie Cu2+ + 2e -> Cu, dla której równanie Nernsta ma postać:
RT, [CuH + zFln [Cu]
Uwzględniając (1) i podstawiając za [Cu2+] otrzymujemy: RT, |cu{C4H406)2"2p
E = EL,ar
, gdzie: z = 2.
E = E° . n. +-ln-f-
7 zF j8.[cu]-[c4h4o;
Uwzględniając fakt, że stężenie ligandu jest dużo większe od stężenia jonu kompleksowego możemy otrzymać wzór na potencjał półfali jonu kompleksowego [Cu(C4H406)p]2_2p:
RT
2zF
ln
D
\
d(cu2+)
(cu(c4H4i
cl
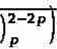
\
)
Wyszukiwarka
Podobne podstrony:
Laboratorium chemii fizycznej Warszawa, 13.05.2003 Protokół pomiarów do ćwiczenia: „Badanie
Laboratorium chemii fizycznej Warszawa, 29.04.2003 Sprawozdanie z ćwiczenia: „Fizykochemiczna
Laboratorium chemii fizycznej Warszawa, 01.04.2003 Sprawozdanie z ćwiczenia: „Wyznaczanie
Laboratorium chemii fizycznej Warszawa, 01.04.2003 Protokół pomiarów z
P4180001 $ JiOU Politechnika Wrocławska Laboratorium Chemii Fizycznej (1*30) 13 Potencjometryczny
nia laboratoryjne z chemii fizycznej. Wyd. 2 przejrz. i rozszerz. Warszawa s. 66—70, tab. 2191.
Sprawozdanie z laboratorium chemii fizycznej. Krytyczne stężenie micelizacji 4. Zestawienie i opraco
Laboratorium chemii fizycznej Sprawozdanie z ćwiczenia: „Adsorpcja oranżu metylowego na
Sprawozdanie z laboratorium chemii fizycznej.Przewodność roztworów elektrolitów (2.5.) A00 = lim^o
Sprawozdanie z laboratorium chemii fizycznej. Badanie kinetyki reakcji inwersji sacharozy. 4. Opraco
Laboratorium chemii fizycznej Sprawozdanie z ćwiczenia: „Badanie kinetyki reakcji inwersji
więcej podobnych podstron