37250
Entalpia - w termodynamice i chemii to wielkość fizyczna będąca funkcją stanu mająca wymiar energii, będąca też potencjałem termodynamicznym, której wartości bezwzględnej nie można poznać. Można natomiast wyznaczyć AH, metodami bezpośrednimi lub pośrednimi. Proces, w którym wzrasta entalpia układu, tzn. AH jest dodatnie nazywamy endotermicznym. I odwrotnie, jeśli entalpia układu maleje, czyli AH jest ujemne proces nazywamy egzotermicznym.
Entropia - termodynamiczna funkcja stanu, określająca kierunek przebiegu procesów spontanicznych (samorzutnych) w odosobnionym układzie termodynamicznym. Jest wielkością ekstensywną. Zgodnie z drugą zasadą termodynamiki, jeżeli układ termodynamiczny przechodzi od jednego stanu równowagi do drugiego, bez udziału czynników zewnętrznych (a więc spontanicznie), to jego entropia zawsze rośnie. Pojęcie entropii wprowadził niemiecki uczony Rudolf Clausius.
II. Przebieg doświadczenia:
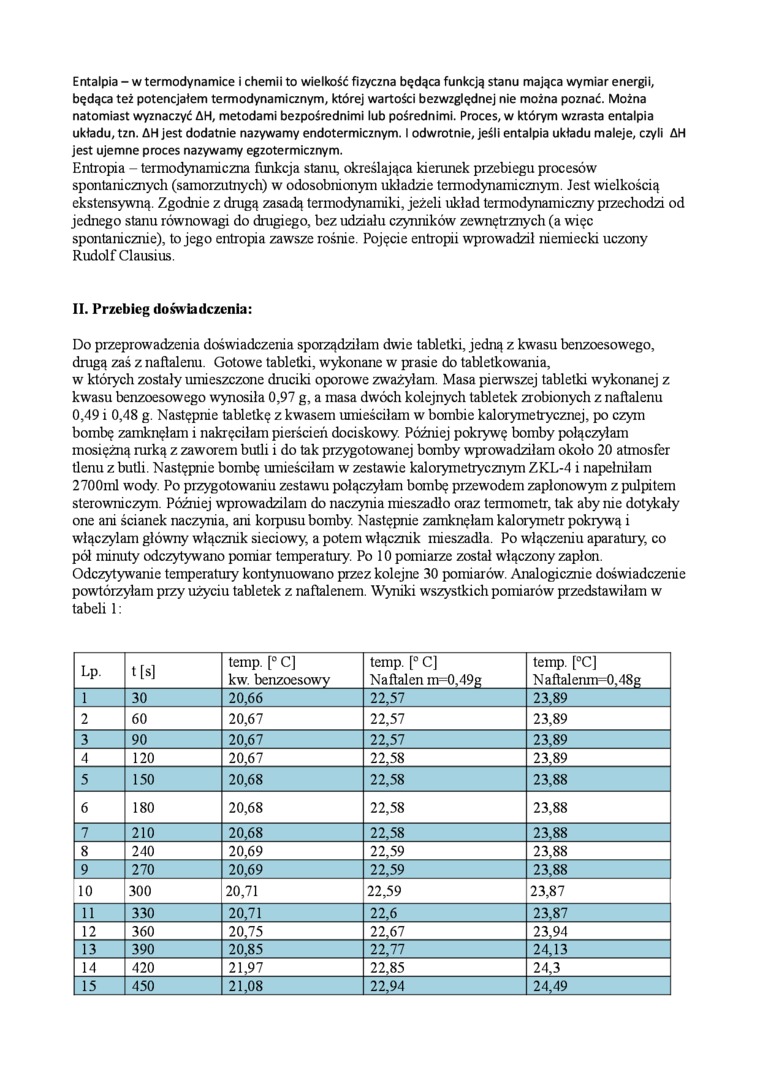
Do przeprowadzenia doświadczenia sporządziłam dwie tabletki, jedną z kwasu benzoesowego, drugą zaś z naftalenu. Gotowe tabletki, wykonane w prasie do tabletkowania, w których zostały umieszczone druciki oporowe zważyłam. Masa pierwszej tabletki wykonanej z kwasu benzoesowego wynosiła 0,97 g, a masa dwóch kolejnych tabletek zrobionych z naftalenu 0,49 i 0,48 g. Następnie tabletkę z kwasem umieściłam w bombie kalorymetrycznej, po czym bombę zamknęłam i nakręciłam pierścień dociskowy. Później pokrywę bomby połączyłam mosiężną rurką z zaworem butli i do tak przygotowanej bomby wprowadziłam około 20 atmosfer tlenu z butli. Następnie bombę umieściłam w zestawie kalorymetrycznym ZKL-4 i napełniłam 2700ml wody. Po przygotowaniu zestawu połączyłam bombę przewodem zapłonowym z pulpitem sterowniczym. Później wprowadziłam do naczynia mieszadło oraz termometr, tak aby nie dotykały one ani ścianek naczynia, ani korpusu bomby. Następnie zamknęłam kalorymetr pokrywą i włączyłam główny włącznik sieciowy, a potem włącznik mieszadła. Po włączeniu aparatury, co pół minuty odczytywano pomiar temperatury. Po 10 pomiarze został włączony zapłon. Odczytywanie temperatury kontynuowano przez kolejne 30 pomiarów. Analogicznie doświadczenie powtórzyłam przy użyciu tabletek z naftalenem. Wyniki wszystkich pomiarów przedstawiłam w tabeli 1:
|
Lp. |
t[s] |
temp. [° C] kw. benzoesowy |
temp. [° C] Naftalen m=0,49g |
temp. [°C] Naftalenm=0,48g |
|
1 |
30 |
20,66 |
22,57 |
23,89 |
|
2 |
60 |
20,67 |
22,57 |
23,89 |
|
3 |
90 |
20,67 |
22,57 |
23,89 |
|
4 |
120 |
20,67 |
22,58 |
23,89 |
|
5 |
150 |
20,68 |
22,58 |
23,88 |
|
6 |
180 |
20,68 |
22,58 |
23,88 |
|
7 |
210 |
20,68 |
22,58 |
23,88 |
|
8 |
240 |
20,69 |
22,59 |
23,88 |
|
9 |
270 |
20,69 |
22,59 |
23,88 |
|
10 |
300 |
20,71 |
22,59 |
23,87 |
|
11 |
330 |
20,71 |
22,6 |
23,87 |
|
12 |
360 |
20,75 |
22t67 |
23,94 |
|
13 |
390 |
20,85 |
22,77 |
24,13 |
|
14 |
420 |
21,97 |
22,85 |
24,3 |
|
15 |
450 |
21,08 |
22,94 |
24,49 |
Wyszukiwarka
Podobne podstrony:
6.7. Entropia i LIZT ■ Nowa wielkość fizyczna - S będąca funkcją stanu,
Wielkość wektorowa, wielkość fizyczna będąca wektorem. skalar w fizyce - wielkość o charakterze
Dynamika punktu materialnego - c.d.1 DEFINICJE Masa m ciała to wielkość fizyczna, charakteryzująca
Parametr technologiczny jest to wielkość fizyczna lub fizykochemiczna określająca warunki przebiegu
Temperatura Jedna z podstawowych wielkości fizycznych, będąca miarą nagrzania. Temperaturę
Produktywność biosfery Energia- wielkość fizyczna wyrażająca zdolność do wykonywania pracy Energia
Energia swobodna - jest jednoznaczną funkcją stanu układu, np. energia Helmoltza (F) jest to układ o
Slajd65 Pierwsza zasada termodynamiki. Entalpia H = U + pV Funkcja stanu materii opisywana przedsta
ENTALPIA- H [ J ], [ J mol1] TERMODYNAMICZNA FUNKCJA STANU dH = H2-H, AH = Hjj - H,H = U + p V dH =
uR=Ri = E(l -e-to) Wielkość ta ma wykres: W pomiarach na ekranie można obserwować tylko funkcję napi
Pomiary Pomiar jest to czynność porównania danej wielkości fizycznej z inną wielkością tego samego
Układ dynamiczny to układ: A. w którym sygnały czyli przebiegi wielkości fizycznyc
biotermo5 2. Potencjał chemiczny - jest to wielkość charakterystyczna dla danej substancji, określa
CCF090613�000 1.18. Co to są szumy? Szumy są to, najogólniej biorąc, wszelkie niepożądane zmiany wie
termodynamika 2 TERMODYNAMIKA AL. POJĘCIA PODSTAWOWE - wielkość
Analiza wymiarowa oparta jest na następującej własności: Wymiar wielkości fizycznej to wielkość
więcej podobnych podstron