Justyna Iwińska
Izabela Kaźmierczak
Joanna Grzybek
Roman Jędrzejowski
Krzysztof Juszczyk
Szczecin 20.01.2003r.
REAKTORY CHEMICZNE
ĆWICZENIE 3
Półprzepływowy reaktor absorpcyjny
Celem ćwiczenia jest określenie stopnia absorpcji oraz szybkości procesu utleniania SO2 w roztworze w zależności od temperatury, zawartości katalizatora w zawiesinie, stężenia katalizatora w roztworze przy różnych składach mieszaniny gazowej zasilający reaktor półprzepływowy.
Zasada działania reaktora półprzepływowego
Reaktorem półprzepływowym lub półokresowym nazwano reaktor zbiornikowy zaopatrzony w mieszadło i pracujący w warunkach niestacjonarnych. Należy podkreślić, że stan niestacjonarny jest charakterystyczny dla każdego reaktora zbiornikowego. W strumieniu wpływającym i wypływającym występują tylko pewne reagenty(nie wszystkie). Zazwyczaj występuje tylko jeden strumień, tzn., że albo któryś z substratów jest doprowadzany do reaktora, albo też któryś z produktów jest wyprowadzany z reaktora w sposób ciągły. W ten sposób można kontrolować stężenie mieszaniny reakcyjnej, a więc i szybkości reakcji, co w konsekwencji umożliwia prowadzenie reakcji w pożądanym kierunku i łatwą regulację wymiany ciepła. Te zalety usprawiedliwiają dosyć szerokie zastosowanie reaktorów pólprzepływowych w praktyce. Można wymienić trzy następujące grupy reakcji, dla których reaktor półprzepływowy jest szczególnie korzystny:
-reakcje odwracalne-gdy jeden z produktów może być łatwo odbierany. Wtedy na początku wprowadza się wszystkie substraty do reaktora i po zainicjowaniu reakcji wyprowadza w sposób ciągły określony produkt. W tym więc przypadku F1m=0, a F2m≠0. Tak np. w reakcji estryfikacji woda może być odprowadzona przez odparowanie podczas wrzenia mieszaniny. Korzyścią jest tu wzrost szybkości reakcji oraz osiągnięcia wyższego stopnia przemiany na skutek odprowadzenia jednego z produktów reakcji odwracalnej.
-reakcje złożone, -w których powstają produkty uboczne, np.
A+B→P
A+A →X
Gdzie P- produkt pożądany.
W tym przypadku do reaktora ładuje się całkowitą masę substratu B, natomiast substrat A dozuje się w sposób ciągły, tzn. że F1m≠0, a F2m=0. Utrzymuje się więc stężenie A na niskim poziomie, nie dopuszczając w ten sposób do wzrostu szybkości reakcji ubocznych. Przykładem może być otrzymywanie benzenu, gdzie chlor jest stopniowo dozowany do reaktora.
Reakcje silnie egzotermiczne(nawet zupełnie proste)- w przypadku, których przez stopniowe dozowanie substratu do reaktora można łatwo kontrolować temperaturę reakcji.
W przeważającej większości przypadków w reakcjach nadających się do prowadzenia metodą półprzepływową muszą brać udział, co najmniej dwa substraty. Również najczęściej występuje równocześnie strumień zasilający F1m, a szczególnie wtedy, gdy F1m=F2m jest mało typowy dla reaktora półprzepływowego. Taki stan odpowiada praktycznie rozruchowi reaktora zbiornikowego.
W niniejszym ćwiczeniu należy dokonać oceny przebiegu procesu, który prowadzony jest w reaktorze półprzepływowym, pracującym w układzie absorpcyjnym. W układzie tym stosuje się cyrkulacje roztworu, ponieważ jednorazowe jego przejście przez absorber odbywa się w czasie zbyt krótkim dla uzyskania zadowalającej wydajności procesu. Krotność cyrkulacji zależy od szybkości procesu i wymiarów aparatury. Gaz przepływa w przeciwprądzie do cieczy, poprzez przegrodę perforowaną, powodującą dyspersję strumienia na drobne pęcherzyki. Podstawą tego procesu jest reakcja:
SO2+1/2O2+H2O![]()
H2SO4
Przebieg tej reakcji katalizują jony metali zmiennowartościowych z bloku 3d. Katalizator może być wprowadzony do roztworu absorpcyjnego w formie soli odpowiednich metali(np. soli Fe)lub do zawiesiny w formie tlenków np. FeO*TiO2 . Powyższa reakcja umożliwia oczyszczenie gazów odlotowych, odpadowy SO2 przeprowadzany jest w użyteczny produkt- kwas siarkowy. Bardzo charakterystyczną jaj cechą jest spadek szybkości postępujący ze wzrostem stężenia tworzącego się H2SO4.
W omawianym procesie przemiana chemiczna (utlenianie SO2) jest jednym z etapów. Najpierw musi nastąpić absorpcja gazowych reagentów(SO2 i O2), której towarzyszą procesy wnikania masy i przenikania masy z gazowej do ciekłej. W literaturze bilans masy i energii oraz równania projektowe reaktora półprzepływowego formułowane są głównie dla reakcji biegnących w układzie homogenicznym. Stąd też formalnie nie mogą być ekstrapolowane do warunków pracy reaktora absorpcyjnego, w którym przebiega skomplikowany, omawiany wyżej proces. Dla oceny przebiegu procesu zaproponowano następujący sposób postępowania. Przyjmując jako składnik kluczowy w układzie reakcyjnym dwutlenek siarki(A)i oznaczając ilości moli na wlocie jako noA =noSO2 a na wylocie nA=nSO2, z różnicy noA-nA możemy obliczyć ilość moli przereagowanego SO2.
Natomiast wyrażenie:
αA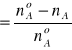
pozwoli na określenie względnej ilości moli przereagowanego substratu w stosunku do ilości wylotowej. Wielkość αA nazywa się stopniem przemiany. Gdy przedstawimy ją jako ułamek jedności zawiera się ona w przedziale 0≤αA≥1, a jeśli określamy ją procentowo to 0%≤αA≥100%.
Powyższy wzór jest wzorem definicyjnym, określającym sens fizyczny stopnia przemiany. W praktyce dogodniej jest stosować stężenia składnika kluczowego na wlocie i wylocie z reaktora. Gdy możemy przyjąć, że objętość fazy gazowej jest stała w czasie przebiegu procesu stopień przemiany możemy obliczyć po określeniu stężeń objętościowych(%) na wlocie i wylocie:
αA 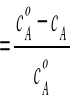
Komentarza wymaga fakt, że przedstawiona wcześniej reakcja przebiega ze zmianą objętości. Należy jednak zauważyć, że zawartości SO2 w gazach odlotowych są na ogół rzędu ułamków procenta i przereagowanie tak niewielkich względnie ilości substancji wywołuje nieznaczną zmianę objętości fazy gazowej. Wartości stopnia absorpcji, wyznaczone dla różnych wartości analizowanego parametru, umożliwiają określenie odpowiadających im wartości szybkości procesu(rA). Zależność na szybkość procesu można wyprowadzić na podstawie obliczeń bilansowych. Oznaczając przez V[![]()
] objętościowe natężenie oraz przeliczając CoA na ułamek objętościowy XoA można obliczyćobjętośćSO2 doprowadzanego do reaktora
V*XoA[![]()
]
A mnożąc przez stopień absorpcji obliczyć objętość przereagowanego SO2 :
V* XoA*αA[![]()
]
Po podzieleniu przez objętość molową SO2 VM=21,86[dm3/mol] uzyskamy ilość moli przereagowanego SO2:
V* XoA*αA*![]()
![]()
Z kolei po podzieleniu przez objętość roztworu reakcyjnego Vr=0,1[dm3] uzyskamy ostatecznie szybkość procesu odniesioną do jednostki czasu i jednostki objętości reaktora:
rA=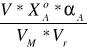
![]()
Nie mamy podanej wartości natężenia objętościowego V[![]()
] więc przyjmijmy ze równa się ono V=50 [![]()
] i wtedy dopiero możemy obliczyć szybkość reakcji dla podanego zakresu temperatur(od 20'C do 80'C -skok co 10'C).
αA 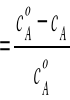
Temperatura
|
Stężenie |
Stężenie |
Stopień |
w reaktorze ['C] |
w reaktorze(%) |
początkowe(%) |
przemiany[[mol/dm3*h] |
20 |
0,0932 |
0,3 |
0,68933333 |
30 |
0,0348 |
|
0,884 |
40 |
0,0554 |
|
0,8153333 |
50 |
0,0634 |
|
0,788666 |
60 |
0,0805 |
|
0,731666 |
70 |
0,0876 |
|
0,708 |
Omówienie wykresu: proces absorpcji przebiega najlepiej(dla tej reakcji) w granicach temperatur od ok. 250C do 350C i ta reakcja, jeżeli już by zachodziła to powinna zachodzić w tych temperaturach.
4
Wyszukiwarka
Podobne podstrony:
Budowa i zasada działania pamięci półprzewodnikowych
Budowa i zasada działania reaktora jądrowego
skaner zasada dzialania1
F 1 Zasada działania tranzystora bipolarnego
Budowa pojazdów samochodowych -Zasada działania silnika dwusuwowego semestr 1, Motoryzacja
Budowa i zasada działania układu pneumatycznego z?S oraz kryteria oceny
Zasada Dzialania PID
Budowa i zasada działania FDD
Zasada działania maszyny indukcyjnej a
22 Zasada dzialania i charakteryst (2)
Czujniki pomiarowe Budowa i zasada dzialania
Budowa i zasada działania mikroskopu optycznego metalograficznego
ZASADA DZIAŁANIA?M
Budowa i zasada działania lasera, fizyka, Referaty
ZASADA DZIAŁANIA SILNIKA DWUSUWOWEGO, MOTORYZACJA, ▼ Silniki Spalinowe ▼
Budowa i zasada działania galwanometru statycznego
Zasada działania oczyszczalni ścieków
Budowa pojazdów samochodowych zasada działania silnika czterosuwowego i?z rozrządu semestr 1 (2)
więcej podobnych podstron