63309

(7.45)
pH = -log(a ) = -log(f [HjO* ]) = -log
f \
f .V
Vo* c
b y
(7.46)
(7.47)
Jeśli w roztworze buforowym stała protolizy Kb zasady Bronsteda B ma większą wartość od stałej protolizy K, kwasu HB' to do wyprowadzenia wzorów obliczeniowych używamy stałej protolizy zasady.
b + h2o = bh+ + oh~
[HB*]-[OH ]
b [B]
[HjO*] ^ [OH~] Kb fj cB ~ [B] [HB* J c
[OH-]=Kb
[HjO*] =
K.
(7.48)
(7.49)
(7.50)
[OH ] Kb [B]
PH = -log(aH Q.) = -log(fH0. • [H,0 ]) = -log
H.O*
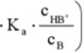
(750)
Na podstawie wzorów do obliczania stopnia protolizy słabych elektrolitów w roztworach buforowych (7.45) i (7.48) można stwierdzić, że w tym przybliżeniu stopnie protolizy kwasów i zasad w roztworach buforowych praktycznie nie zależą od ich stężeń, a zależą od stężeń ich sprzężonych partnerów'. Porównując wzory do obliczania stopnia protolizy słabych kwasów i zasad bez obecności wspólnego jonu i w jego obecności można stwierdzić, że w pierwszym przypadku zależy on od pierwiastka z K/c, a w drugim - od stosunku K/c w pieiwszej potędze.
Roboczy zakres skutecznego działania roztworu buforowego wynosi około ±1 jednostki pH w pobliżu pK», co odpowiada zakresowi stosunków stężeń kwasu do sprzężonej z nim zasady od 1:10 do 10:1. Biochemicy używając niezbyt stężonych roztworów buforowych (o sumarycznym stężeniu składników roztworu buforowego w granicach 0,05+0,1 M) zawężają ten przedział do około ±(0,7+0,8) jednostki pH, co odpowiada zakresowi stosunków stężeń kwasu do sprzężonej z nim zasady od około 1:5 do 5:1.
Obliczenia dla roztworów buforowych wykonuje się w następujących etapach:
1. Obliczenie stężeń obu składników w roztworze (kwasu Bronsteda oraz sprzężonej z nim zasady) z uwzględnieniem ewentualnych reakcji chemicznych zachodzących w roztworze oraz rozcieńczania (czasem warunki zadania są tak sformułowane, że ten etap można pominąć).
2 Obliczenie siły jonowej roztworu pochodzącej od elektrolitów mocnych tworzących roztwór buforowy oraz ewentualnych mocnych elektrolitów nie posiadających wspólnych jonów z układem buforowym - siki jonowa jest sumą sil jonowych wszystkich mocnych elektrolitów obecnych w roztworze W niewielkiej części na początku obliczeń zadań nie można określić siły jonowej -w takim przypadku liczymy zadanie stosując termodynamiczną stalą protolizy (dokładniejsze wyniki dla tych zadań można uzyskać metodą iteracyjną).
Wyszukiwarka
Podobne podstrony:
68830 skan0219 222 Kinetyka chemiczna Stąd po scałkowaniu mamy 222 Kinetyka chemiczna CB k„ a a h -
60374 strona 5 (8) ST&PA Pd&Cb d i o U Ą "k® ś
strona 5 (8) ST&PA Pd&Cb d i o U Ą "k® śposc^/
CB Regia
/i J jd^H V * 1A
100B52 C-iO Xc- <L ^CP)CB 13 "O yfI 2ad Z U £*- - k L c & d Cy, dX-~LC a T-i^s k~ Oi§dĄ
100B52 C-iO Xc- <L ^CP)CB 13 "O yfI 2ad Z U £*- - k L c & d Cy, dX-~LC a T-i^s k~ Oi§dĄ
fL-ĆfĄUM1 /Mf= Ou HB.rtbś -IWtrrtAuoi- CCHifiE *M/HtlM K£ (Poi -
Li Oi -i_U5U 1 h c k— — 5 CofV j ^—ij) Cb Y ^^Jvo.^e<i«5p
2010 01 12 3517 AiłUMłkł ATcfit# ,Y(Unii.^iU auv A1n1a ttiajx»i . Mł ISBN mm1 14.HB-4. C ty WN r»N 2
2010 01 12 4033 AiłUMłkł ATcfit# ,Y(Unii.^iU auv A1n1a ttiajx»i . Mł ISBN mm1 14.HB-4. C ty WN r»N 2
tekst 2 ■K nj óyi •hb/en^e frj* ^o..cu^yi^p o< u?"l! <*-■
więcej podobnych podstron