68830 skan0219
222 Kinetyka chemiczna
Stąd po scałkowaniu mamy
222 Kinetyka chemiczna
CB
k„ a
a
h - k
(cxp (-kał) - exp (~kbt)).
(5.27)
a
Wstawiając to wyrażenie do (5.24c) można łatwo otrzymać
cc = a\\ +
ka exp (~kh t) - kh exp (~ka /)
kh-k
(5.28)
cl
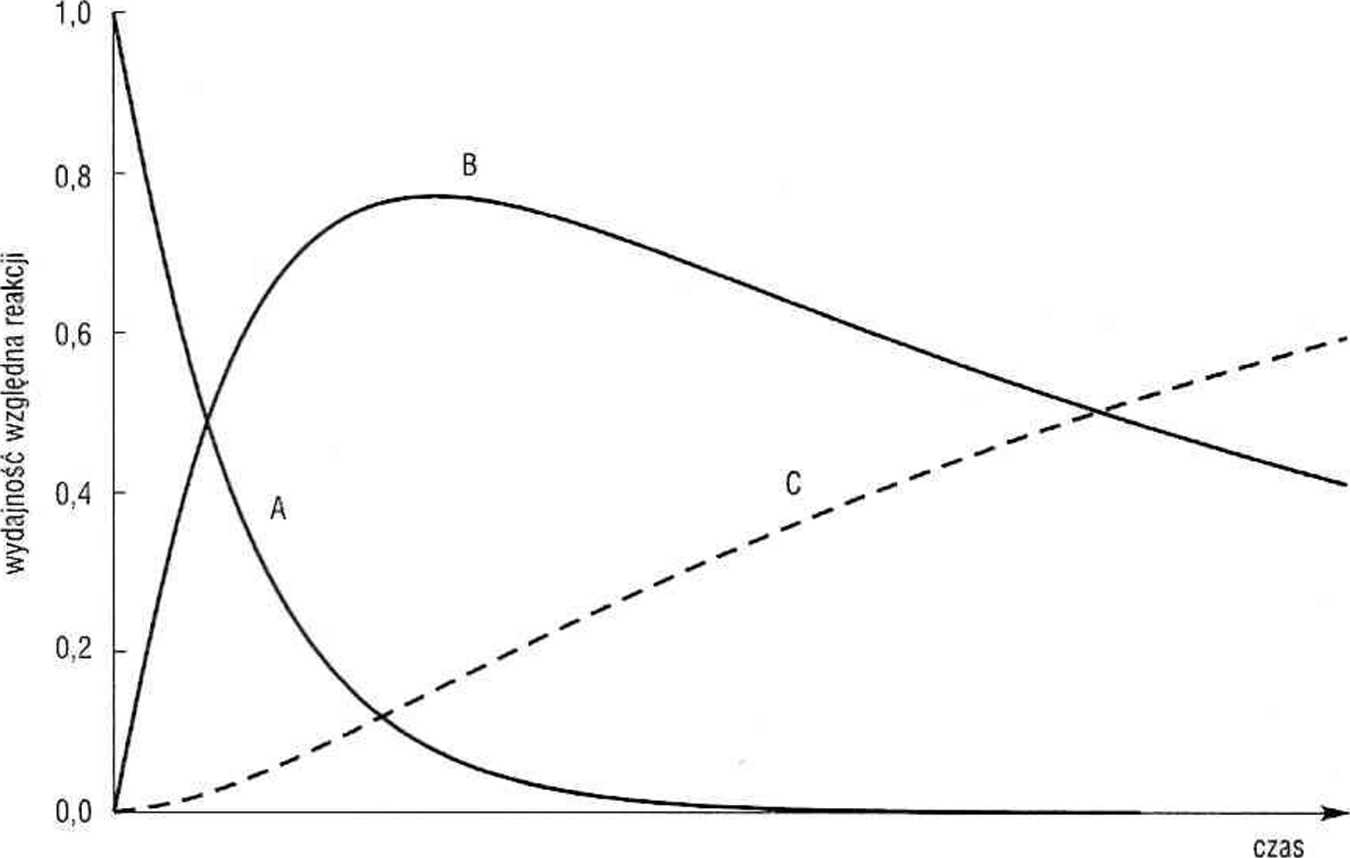
Stężenie B przechodzi przez maksimum (rys. 5.7).
ku kit
Rys. 5.7. Wydajność względna reakcji następczych typu A —» B —» C
Różniczkując równanie (5.27) względem t, z warunku, iż (dcB/dt)max = 0, znajdziemy czas, po którym uzyska się maksymalną wydajność produktu B:
ln (kQ/kb)
^max / /
A' - ki
(5.29)
a
a także samą wydajność maksymalną:
(cB)max a
l- \kbkh ,~ka) Ka
(5.30)
Gdy ka = kb = k, równanie (5.26) będzie miało postać
d
dt
(cBexp(A7)) = ka.
(5.31)
Wyszukiwarka
Podobne podstrony:
P1030565 Stąd po scałkowaniu w podanych wcześniej granicach otrzymamy: lmk r Po zamianie logarytmów
skan0220 Kinetyka chemiczna 223 Po jego scałkowaniu otrzymamy wyrażenie cB = akt cxp (-kt).
skan0233 236 Kinetyka chemiczna Tak więc, po drobnych przekształceniach mamy 236 Kinetyka chemiczna
450 [1024x768] KINETYKA CHEMICZNA Po scałkowaniu otrzymujemy = kt (6.14) 1 _ f (2b
453 [1024x768] ILOŚCIOWY OPIS SZYBKOŚCI REAKCJI CHEMICZNYCH Po scałkowaniu tego równania kinetyczneg
skan0205 208 Kinetyka chemiczna więc po zlogarytmowaniu ln/1/2 = const + (1 - ń) ln c0 powinno się o
skan0215 218 Kinetyka chemiczna Obliczoną stąd stałą szybkości k = (1,22 ± 0,01) • 10 8 Pa 1 • s 1
skan0217 220 Kinetyka chemiczna Podstawiamy to do równania różniczkowego i po kilku prostych przeksz
skan0237 240 Kinetyka chemiczna Przykład 5.17. Stałe szybkości reakcji w fazie gazowej 1. &nbs
skan0251 254 Kinetyka chemiczna a — «<*, w którym a0 jest kątem skręcenia płaszczyzny polaryzacji
więcej podobnych podstron