450 [1024x768]

KINETYKA CHEMICZNA
Po scałkowaniu otrzymujemy
= kt (6.14)
1 _ f (2b-a)lx b(a-2x)]
(2b-óy [ a(a-2x) a(b-x) J
Najczęstszym przypadkiem reakcji trzeciego rzędu jest udział dwóch rodzajów substratów, przy czym reakcja jest drugiego rzędu względem jednego ^ z nich.
Wyznaczanie rzędu reakcji
Najprostszy sposób, choć mało precyzyjny i nie zawsze skuteczny, wyznaczania rzędu reakcji, to sprawdzanie stałości k w równaniach kinetycznych odpowiednich rzędów.
O wartości rzędu reakcji informuje nas także zachowanie się czasu połówkowego reakcji. Widzieliśmy, że dla reakcji pierwszego rzędu czas ten nie zależy od stężenia początkowego. Dla innych rzędów czas ten w różny sposób zależy od c0. I tak, dla reakcji II rzędu, zgodnie z równaniem (6.8),
TllrMd * (6.15) a dla reakcji III rzędu, zgodnie z (6.12),
3
Tlllnąd - Jj—g (6.16)
Ogólnie
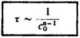
(6-17)
gdzie n jest rzędem reakcji. Dla reakcji rzędu zerowego czas połówkowy jest proporcjonalny do stężenia początkowego.
Najdokładniejszą metodą wyznaczania rzędu reakcji, jak i zresztą w ogóle badania meęHamzmuTeakćji, jest porównywanie początkowej szybkości reakcji dla określonych stężeń początkowych.. Przez zastosowanie dużego nadmiaru wszystkich pozostałych substratów w stosunku do badanego składnika można określić rząd reakcji względem konkretnych składników. Badanie szybkości reakcji w stadium początkowym jest ważne i z tego względu, że eliminujemy ewentualny wpływ reakcji odwrotnych. Trzeba bowiem podkreślić, że niemal
Wyszukiwarka
Podobne podstrony:
453 [1024x768] ILOŚCIOWY OPIS SZYBKOŚCI REAKCJI CHEMICZNYCH Po scałkowaniu tego równania kinetyczneg
454 [1024x768] KINETYKA CHEMICZNA miast a—jest stężeniem początkowym wyjściowego substratu A. Równan
470 [1024x768] KINETYKA CHEMICZNA pomiędzy cząsteczkami. Przyjmując taki wyidealizowany model, możem
474 [1024x768] KINETYKA CHEMICZNA Rys. 6.9. Analizator aminokwasów A AA 881 prod. KOVO ilości zaadso
484 [1024x768] KINETYKA CHEMICZNAStruktura enzymów Enzymy —BtOKATALI- ZATORY Biokatalizatory —enzymy
488 [1024x768] KINETYKA CHEMICZNA 3) następuje wzbudzenie do tak wysokich stanów o
490 [1024x768] KINETYKA CHEMICZNA przy czym r = ^ określa czas życia stanu wzbudzonego D* w nieobecn
P1070057 134 Czfdć 11. Rozwiązania i odpowiedzi a zatem dp = p(<o2 rdr—gdz). Po scalkowaniu otrzy
DSCF0039 (2) Po scalkowaniu otrzymamy e° Qo~ vP*L (77) Jeżeli opuści się wartości
MENABREI2 (*-/)d* = 0 O / Po scałkowaniu otrzymujemy układ równań 5„ &
Po scałkowaniu otrzymamy: ln(S(x))^P P^gx + C Stałą C wyznaczamy z warunku że dla x = 0 pole S(x) =
50717 skan0204 Kinetyka chemiczna 207 D = 1 Dla x = 0 otrzymamy Wab = 1 + a stąd ( b - 2 a)2 2 a&nbs
więcej podobnych podstron