470 [1024x768]

KINETYKA CHEMICZNA
pomiędzy cząsteczkami. Przyjmując taki wyidealizowany model, możemy wyprowadzić wyrażenie określające równowagę adsorpcji.
Podczas równowagi termodynamicznej szybkość adsorpcji musi być równa szybkości desorpcji. Szybkość adsorpcji będzie proporcjonalna do ciśnienia (jeżeli adsorpcja zachodzi ze stanu gazowego) lub stężenia (z roztworu) substancji adsorbowanej oraz do ułamka miejsc niezajętych adsorbentu:
r.*, = *./>( 1-0) (6.49)
gdzie O oznacza ułamek miejsc zajętych.
Natomiast szybkość desorpcji będzie proporcjonalna do
t>d„ - ka9 (6.50)
Przyrównując te wielkości otrzymujemy
kA0 — kmp{ 1 —0) i ostatecznie
a _ *.P___bp
kt+k,p 1 +bp
(6.51)
gdzie b = Y~
ua Krzywa opisująca tę zależność, czyli tzw. izoterma adsorpcji, pokazana jest 01 na rys. 6.6. Dla małych ciśnień (lub stężeń) obserwuje się w przybliżeniu li-
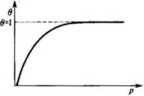
Rys. 6.6. Zależność stopnia pokrycia powierzchni adsorbentu od ciśnienia adsorbowanego gazu (izoterma adsorpcji Langmuira) niową zależność między 0 i ciśnieniem (1 P bp). Dla wysokich ciśnień natomiast, gdy bpP 1, krzywa zbliża się asymptotycznie do wartości 1.
W przypadku adsorpcji substancji z roztworów często stosowane jest empiryczne równanie Freundlicha (1907):
RÓWMANłt
Fkhunoucma
w = kct,m
(6.52)
Wyszukiwarka
Podobne podstrony:
490 [1024x768] KINETYKA CHEMICZNA przy czym r = ^ określa czas życia stanu wzbudzonego D* w nieobecn
448 [1024x768] KINETYKA CHEMICZNA /(s) Ap(mm Hg) 390 96 777
450 [1024x768] KINETYKA CHEMICZNA Po scałkowaniu otrzymujemy = kt (6.14) 1 _ f (2b
454 [1024x768] KINETYKA CHEMICZNA miast a—jest stężeniem początkowym wyjściowego substratu A. Równan
474 [1024x768] KINETYKA CHEMICZNA Rys. 6.9. Analizator aminokwasów A AA 881 prod. KOVO ilości zaadso
484 [1024x768] KINETYKA CHEMICZNAStruktura enzymów Enzymy —BtOKATALI- ZATORY Biokatalizatory —enzymy
488 [1024x768] KINETYKA CHEMICZNA 3) następuje wzbudzenie do tak wysokich stanów o
skan0206 (2) Kinetyka chemiczna 209 Eliminując z nich liczbę moli azotu, ;?N, możemy obliczyć w każd
456 [1024x768] 466 KINETYKA CHEMICZNA Z ma wymiar szybkości reakcji; wyraża liczbę cząsteczek reaguj
444 [1024x768] część szósta kinetyka chemiczna
446 [1024x768] 456 KINETYKA CHEMICZNA Współczynniki potęgowe przy stężeniach w równaniach kinetyczny
452 [1024x768] 462 KINETYKA CHEMICZNA Przykład Przebieg reakcji 3 HCNO=(HCNO)j badano na podstawie s
458 [1024x768] 468 KINETYKA CHEMICZNA Przykład 3 Pewna reakcja w lemp. 40°C po upływie 15 min. zacho
462 [1024x768] 472 KINETYKA CHEMICZNA Szybkość więc reakcji będzie określonad[C] d / *K*lA][B]. (6.4
468 [1024x768] 47* KINETYKA CHEMICZNA Strzałkami zaznaczono kierunek przenoszenia ładunku ujemnego p
472 [1024x768] 482 KINETYKA CHEMICZNA stosuje się różne związki, najczęściej celit (glinokrzemian),
478 [1024x768] 488 KINETYKA CHEMICZNA wymieniacza. Dla ilościowego opisu równowagi można także posłu
480 [1024x768] 490 KINETYKA CHEMICZNA centrów aktywnych. Jeżeli wyrazimy izotermę Langmuira w postac
więcej podobnych podstron