456 [1024x768]

466 KINETYKA CHEMICZNA
Z ma wymiar szybkości reakcji; wyraża liczbę cząsteczek reagujących w przc-£nerc.ia ciągu sekundy. £n nosi nazwę energii aktywacji. Sens fizyczny energii aktywacji kiywacji wyjaśnimy na przykładzie prostej reakcji H; + J2 = 2HJ. Jeżeli podczas spotkania cząsteczek H: i J. ma powstać nowe indywiduum chemiczne HJ,

to muszą ulec rozerwaniu pierwotne wiązania H—H i J—J i na ich miejsce powstać dwa nowe wiązania H J. Musi być więc pokonana pewna bariera energetyczna, zgodnie z rys. 6.3. £u(l) jest energią aktywacji dla reakcji przebiegającej w prawo, £.,(2) zaś energią aktywacji reakcji odwrotnej. Różnica pomiędzy tymi wielkościami równa jest zmianie energii reakcji chemicznej.
Przeciętna wartość energii aktywacji jest rzędu 20—40 kcal/mol. Można więc wnosić, że dla pokonania bariery energetycznej reakcji nic jest potrzebne całkowite rozrywanie wiązań. Energia dysocjacji większości wiązań jest przeciętnie około 2 razy większa. Przemiana chemiczna, tj. przejście od wiązań w substratach do wiązań w produktach odbywa się w sposób kooperatywny. Pełniejsze wyjaśnienie tego zagadnienia daje nam teoria aktywnych stanów przejściowych, przedstawiona w następnym podrozdziale.
Powróćmy do zagadnienia temperaturowej zależności szybkości reakcji. Równanie (6.30) poci.}ga za sobą fakt, że len sam typ zależności wystąpi
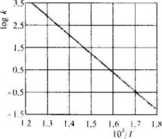
Rys. 6 4. Zależność logaryimu stfltej szybkości reakcji syntezy jodowodoru od odwrotności temperatury-
Wyszukiwarka
Podobne podstrony:
skan0209 212 Kinetyka chemiczna Obliczyć stałą szybkości reakcji zmydlania estru, traktując ją jako
462 [1024x768] 472 KINETYKA CHEMICZNA Szybkość więc reakcji będzie określonad[C] d / *K*lA][B]. (6.4
452 [1024x768] 462 KINETYKA CHEMICZNA Przykład Przebieg reakcji 3 HCNO=(HCNO)j badano na podstawie s
458 [1024x768] 468 KINETYKA CHEMICZNA Przykład 3 Pewna reakcja w lemp. 40°C po upływie 15 min. zacho
468 [1024x768] 47* KINETYKA CHEMICZNA Strzałkami zaznaczono kierunek przenoszenia ładunku ujemnego p
472 [1024x768] 482 KINETYKA CHEMICZNA stosuje się różne związki, najczęściej celit (glinokrzemian),
478 [1024x768] 488 KINETYKA CHEMICZNA wymieniacza. Dla ilościowego opisu równowagi można także posłu
480 [1024x768] 490 KINETYKA CHEMICZNA centrów aktywnych. Jeżeli wyrazimy izotermę Langmuira w postac
482 [1024x768] 492 KINETYKA CHEMICZNA to po wstawieniu (6.61) do (6.60) otrzymamy ((ES)*)
486 [1024x768] 496 KINETYKA CHEMICZNA 2) najkorzystniejsza wzajemna orientacja rea
492 [1024x768] 502 KINETYKA CHEMICZNA fenonu. S0 oznacza tu singletowy stan podstawowy, S,,S2 — dwa
494 [1024x768] 504 KINETYKA CHEMICZNA 1 cal powoduje ro2pad - — ’6,023 *,oaj cz4st
496 [1024x768] 506 KINETYKA CHEMICZNA ko—ffcw Porównać pojęcia rzędowości, cząstcczkowości i współcz
498 [1024x768] 508 KINETYKA CHEMICZNA 21 Chloroform ulega fotoutlcnieoiu do fosgenu z wydajnością kw
DSC02177 Kinetyka reakcji chemicznych 1. Kinetyka chemiczna zajmuje się szybkością
Definicja szybkości reakcji chemicznej Reakcja chemiczna: substraty -> produkty Szybkość reakcji
skan0247 250 Kinetyka chemiczna gdzie dla rozważanej reakcji ~A = -2, zB = — 1. Dla dwóch różnych si
więcej podobnych podstron