skan0209
212 Kinetyka chemiczna
Obliczyć stałą szybkości reakcji zmydlania estru, traktując ją jako pierwszo-rzędową. Ile wyniosło to opóźnienie?
Rozwiązanie. Reakcja zmydlania estru, przy dużym nadmiarze wody, może być traktowana jako reakcja pscudojednocząsteczkowa:
CH3COOC2H5 + H20 C2H5OH ± CH3COOH.
Oznaczmy stężenie aktualne estru przez c, stężenie powstałego kwasu octowego zaś przez A'. Równanie bilansu a = c ± x musi być spełnione w każdej chwili /; początkowe stężenie estru a wyznacza się z końcowego miareczkowania, oczywiście wtedy, gdy reakcja przebiega do końca (dla t = °o, c = 0 i a = xoa).
Chwilowe stężenie kwasu octowego x można obliczyć z relacji uwzględniającej stężenie HC1 w mieszaninie reakcyjnej:
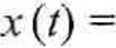
^zas (0 ^‘zas ^próbki
cHC’l-
Ze względu na to, że reakcja zaczęła się wcześniej niż rozpoczęto pomiar czasu, stałą szybkości obliczymy, całkując równanie kinetyczne w granicach tj - ti+1 (zob. tab. 5.4 w poprzednim przykładzie - sposób b). Wyniki obliczeń przedstawiono w tab. 5.6.
Tabela 5.6
|
t [min] |
^zas [cm ] |
A [M] |
ln (a - a) |
1 c «—• rO O T—< |
to tmin] |
|
0 |
8,4 |
0,01 |
-0,8557 |
-12,92 | |
|
30 |
9,3 |
0,0325 |
-0,9101 |
1,813 |
-13,14 |
|
60 |
10,15 |
0,0538 |
-0,9643 |
1,808 |
-13,27 |
|
90 |
10,95 |
0,0738 |
-1,0182 |
1,796 |
-13,21 |
|
120 |
11,7 |
0,0925 |
-1,0715 |
1,777 |
-12,82 1 |
|
150 |
12,4 |
0,11 |
-1,1239 |
1,748 |
-11,96 |
|
180 |
13,1 |
0,1275 |
-1,1793 |
1,845 |
-12,71 |
|
210 |
13,75 |
0,1438 |
-1,2336 |
1,810 |
-12,87 |
|
240 |
14,35 |
0,1588 |
-1,2864 |
1,763 |
-12,24 |
|
270 |
14,95 |
0,1738 |
-1,3423 |
1,861 |
-13,26 |
|
00 |
25,4 |
0,435 |
r Średnia |
1,802 ±0,012 |
-(12,84 ±0,14) |
f
Średnia z 9 pomiarów dobrze zgadza się z wartością stałej szybkości wyznaczonej graficznie - zob. rys. 5.2 z równaniem linii prostej y = -(8559 ±5)-10“4--(1,800 ±0,003) • 10~3 t.
Wyszukiwarka
Podobne podstrony:
skan0250 Zadania 253 5a:14. Znaleźć rząd i stałą szybkości reakcji zmydlania estru etylowego kwasu
skan0215 218 Kinetyka chemiczna Obliczoną stąd stałą szybkości k = (1,22 ± 0,01) • 10 8 Pa 1 • s 1
456 [1024x768] 466 KINETYKA CHEMICZNA Z ma wymiar szybkości reakcji; wyraża liczbę cząsteczek reaguj
skan0247 250 Kinetyka chemiczna gdzie dla rozważanej reakcji ~A = -2, zB = — 1. Dla dwóch różnych si
skan0237 240 Kinetyka chemiczna Przykład 5.17. Stałe szybkości reakcji w fazie gazowej 1. &nbs
skan0207 210 Kinetyka chemiczna można go uniknąć, obliczając stałe szybkości za pomocą wyrażeń otrzy
75540 skan0249 252 Kinetyka chemiczna 252 Kinetyka chemiczna Odp. k2 = 5a:9. Wyprowadzić równanie na
Scan1 Egzamin z chemii ogólnej i żywności 20.09.2010 l.Jak zmieni się stała szybkości reakcji chemic
47714 skan0253 256 Kinetyka chemiczna szybkość powstawania produktu w funkcji [A] i stałych szybkośc
więcej podobnych podstron