skan0215

218 Kinetyka chemiczna
Obliczoną stąd stałą szybkości k' = (1,22 ± 0,01) • 10 8 Pa 1 • s 1 można wyrazić w zwyczajowo przyjętych jednostkach (M-1 • s-1)
k= k' RT• 103 = 1,22 - lO”8 • 8314 - 523,15 - 103 =
= (5,31 ±0,04)- 10"2M-’ -s"1. ■
Jako reakcje odwracalne (przeciwbieżne) definiujemy te przemiany chemiczne, w których nie można zaniedbać procesu odtwarzania substratów przez reagujące ze sobą produkty
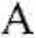
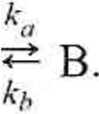
Dla uproszczenia przyjmijmy, iż obie reakcje są I rzędu. Ponadto załóżmy, że w chwili / = 0 składnik B jeszcze się nie utworzył, a w konsekwencji bilans stężeń reagentów wyraża się równaniem a = cA + cB, spełnionym w każdej chwili. Szybkość tej reakcji można opisać następująco:
cJcq
dt
K,Ca ~ Kcb = Kia - cB) - kbcB = kaa - (ka + kh)cB.
(5.17)
W stanie równowagi, dla t = °<>5 dcBidt = 0, a stężenie B = (cB)r, toteż
kaa = (ka +kh)(cB\. (5.18)
Całkując (5.17) z warunkiem początkowym t = 0, cB = 0, otrzymujemy
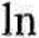
kaa~(ka + kh)cB kaa
-~{ka + kh)t.
(5.19)
Jeśli podstawić (5.18) do równania (5.19), to otrzyma się, po uproszczeniu.
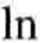
(CB)r
(cb)t ~ CB
- (ka + kb)t
(5.20)
lub, korzystając z równania bilansu a = cA + cB, a zatem a = (eA)r + (cB)r,
a — (f/Or
Ca - (cA)r
W niektórych podręcznikach, przez analogię do (5.13), suma (ka + kh) nazywana jest efektywną stałą szybkości reakcji.
Jeżeli dla t = 0, [B]0 = ń, to równanie kinetyczne (5.17) przybierze postać
dcB _ d(b + x) ~dt ~ dt
dx
dt
= ka(a - x) - kh(b + x),
(5.21)
Wyszukiwarka
Podobne podstrony:
skan0209 212 Kinetyka chemiczna Obliczyć stałą szybkości reakcji zmydlania estru, traktując ją jako
skan0237 240 Kinetyka chemiczna Przykład 5.17. Stałe szybkości reakcji w fazie gazowej 1. &nbs
skan0207 210 Kinetyka chemiczna można go uniknąć, obliczając stałe szybkości za pomocą wyrażeń otrzy
75540 skan0249 252 Kinetyka chemiczna 252 Kinetyka chemiczna Odp. k2 = 5a:9. Wyprowadzić równanie na
68830 skan0219 222 Kinetyka chemiczna Stąd po scałkowaniu mamy 222 Kinetyka chemiczna CB k„ a a h -
47714 skan0253 256 Kinetyka chemiczna szybkość powstawania produktu w funkcji [A] i stałych szybkośc
38958 skan0235 238 Kinetyka chemiczna gdzie Aą i h oznaczają, odpowiednio, stałą Boltzmanna i stałą
skan0233 236 Kinetyka chemiczna Tak więc, po drobnych przekształceniach mamy 236 Kinetyka chemiczna
skan0251 254 Kinetyka chemiczna a — «<*, w którym a0 jest kątem skręcenia płaszczyzny polaryzacji
więcej podobnych podstron