38958 skan0235

238 Kinetyka chemiczna
gdzie Aą i h oznaczają, odpowiednio, stałą Boltzmanna i stałą Plancka, natomiast cA oraz cB są aktualnymi stężeniami substratów.
Przyjmijmy, w dużym uproszczeniu, że powstawanie kompleksu (AB/ jest reakcją odwracalną ze stałą równowagi K*t toteż stałą szybkości reakcji powstawania produktów możemy zapisać, zgodnie z definicją stałej równowagi - zob. (3.76), jako
a- = /L = ML K»(„sp, (5.56)
n cAcB n
gdzie Lvy jest liczona dla współczynników reakcji powstawania kompleksu (5.54).
Logarytmując, a następnie różniczkując to równanie względem T, możemy powiązać stałą szybkości reakcji ze standardowymi wielkościami termodynamicznymi, charakteryzującymi proces przejścia substratów w kompleks aktywny - zob. (3.87)
(5.57)
d\nk cłlnK? 1 AUm + RT
clT dT + T “ RT2
Porównując to wyrażenie z równaniem Arrheniusa (5.44), otrzymamy związek między energią aktywacji Ea a zmianą energii wewnętrznej lub entalpii reakcji powstawania kompleksu (AB/:
Ea = AU** + RT = AH°*-RT(Ang- 1), (5.58)
gdzie Ang dotyczy wyłącznie reakcji powstawania aktywnego kompleksu - zob. wyrażenie (3.22), przy czym sumowaniu podlegają jedynie współczynniki ste-chiometryczne reagentów gazowych (ze znakiem (+) dla produktów i znakiem (-) dla substratów):
Ang (Lv,jg ^Agaz.kompleksu ^ ^"gaz. substratów (5.59)
Dla reagentów w fazie gazowej wygodniej jest operować pojęciem zmiany entalpii swobodnej AG°* reakcji powstawania kompleksu (AB/, a ponieważ, zgodnie z (3.74),
AG°# = -RT lnKp = AHof' - TAS°\
więc
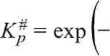
AGoft\ RT I
exp
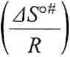

AHoU\ RT /
(5.60)
Równocześnie, z relacji między Kc a Kp - zob. (3.80):
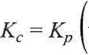
c® RT ) •
Wyszukiwarka
Podobne podstrony:
skan0247 250 Kinetyka chemiczna gdzie dla rozważanej reakcji ~A = -2, zB = — 1. Dla dwóch różnych si
50424 skan0241 244 Kinetyka chemiczna gdzie 7«mon jest masą gazu niezbędną do utworzenia pojedynczej
skan0233 236 Kinetyka chemiczna Tak więc, po drobnych przekształceniach mamy 236 Kinetyka chemiczna
skan0237 240 Kinetyka chemiczna Przykład 5.17. Stałe szybkości reakcji w fazie gazowej 1. &nbs
skan0251 254 Kinetyka chemiczna a — «<*, w którym a0 jest kątem skręcenia płaszczyzny polaryzacji
68830 skan0219 222 Kinetyka chemiczna Stąd po scałkowaniu mamy 222 Kinetyka chemiczna CB k„ a a h -
skan0207 210 Kinetyka chemiczna można go uniknąć, obliczając stałe szybkości za pomocą wyrażeń otrzy
skan0223 226 Kinetyka chemiczna wynosi 37 fis. W tej temperaturze gęstość wody wynosi 0,9970 g ■ cm
47714 skan0253 256 Kinetyka chemiczna szybkość powstawania produktu w funkcji [A] i stałych szybkośc
więcej podobnych podstron