skan0223

226 Kinetyka chemiczna
wynosi 37 fis. W tej temperaturze gęstość wody wynosi 0,9970 g ■ cm 3, a jej iloczyn jonowy jest równy Ksv = 1 • 10-14. Obliczyć stałe szybkości ka i kh.
Rozwiązanie. Szybkość reakcji dysocjacji wody możemy opisać równaniem
^[H+]
dt
Oznaczmy stężenia w chwili / jako [H+] = [OH ] = cB oraz [H20] - a — cB, gdzie, jak zwykle, a = [H2O]0. Zgodnie z tym zapisem
dc^
dt
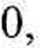
ka(“ ~ cb) ~ h<&‘
W stanie równowagi
czyli ka[a - (cB)r] - kh(cB)2T = 0.
dcB
dt
Wytrącając reakcję dysocjacji ze stanu równowagi, zmieniamy wartość (Cb)t na CB
CB = (cB)r + AcB,
zatem
dcB = d (AcB),
a równanie na szybkość dochodzenia do nowego stanu równowagi będzie miało postać
= ka[a - AcB - (cB)r] - kh[AcB + (cB)r]2.
Jeśli Acb jest wystarczająco małe, aby można było pominąć (AcB)2, to. uwzględniając warunek równowagi, otrzymujemy równanie
djAcB) _ ri ,n]ł ...
--[ka + -kh(cB)T}AcB,
którego rozwiązaniem jest funkcja
Acb = (zlcB)0exp {-[ka + 2kh(cB\] /}.
Po porównaniu jej z (5.40) dostajemy czas relaksacji
__1
ka + 2kf,(cB\
Wyszukiwarka
Podobne podstrony:
skan0201 204 Kinetyka chemiczna Czas połówkowy reakcji rzędu pierwszego wynosi (5.8) _ ln 2 ^1/2 —
skan0233 236 Kinetyka chemiczna Tak więc, po drobnych przekształceniach mamy 236 Kinetyka chemiczna
skan0237 240 Kinetyka chemiczna Przykład 5.17. Stałe szybkości reakcji w fazie gazowej 1. &nbs
skan0251 254 Kinetyka chemiczna a — «<*, w którym a0 jest kątem skręcenia płaszczyzny polaryzacji
68830 skan0219 222 Kinetyka chemiczna Stąd po scałkowaniu mamy 222 Kinetyka chemiczna CB k„ a a h -
skan0207 210 Kinetyka chemiczna można go uniknąć, obliczając stałe szybkości za pomocą wyrażeń otrzy
47714 skan0253 256 Kinetyka chemiczna szybkość powstawania produktu w funkcji [A] i stałych szybkośc
więcej podobnych podstron