47714 skan0253

256 Kinetyka chemiczna
szybkość powstawania produktu w funkcji [A] i stałych szybkości, przy założeniu stanu stacjonarnego dla A*.
W jakich warunkach jest to a) reakcja pseudopierwszorzędowa, b) pseudo-drugorzędowa? Odp. dcyjdl = Aą A'-,c\!{kx + k_^cA); a) duże stężenie substratu (MA] > Aą); b) małe stężenie substratu.
5b:6. Cyklobutanon, C4H60, ulega termicznemu rozkładowi według dwóch równoległych reakcji I rzędu. Na podstawie poniższych danych, odnoszących się do 383°C i
|
t [min] |
0,5 |
1,0 |
3,0 |
6,0 | |
|
[C2H4] |
105, M |
0,31 |
0,68 |
1,53 |
2,63 |
|
[C3H6] |
O k |
0,21 |
0,47 |
1,24 |
2,20 |
C4H60
_ c2h4 + c2h2o
c3h6 + co stężenia początkowego cyklobutanonu równego 6,5-10 5 M, obliczyć stałe szybkości k] i k2. Odp. A ] = (8,30 ± 0,27) • 10-2 min-1, k2 = (7,21 ± 0,09) • 10-4 min-1.
5b:7. Reakcja bromowania nitrobenzenu do monobromopochodnej jest reakcją I rzędu. Po 67 minutach reakcji stężenie nitrobenzenu zmniejszyło się
0 20%. Produkt zawierał 4% (molowych) izomeru orfo, 74% izomeru meta i 22% izomeru para. Obliczyć stałe szybkości reakcji bromowania nitrobenzenu do odpowiedniej pochodnej.
Odp. korto = 1,33-10-4; kmeta = 2,46 -10-3; kpara = 7,33-10-4 min-1.
5b:8. Izotop 2§4Pb ulega rozpadowi fi, tworząc 2g4Bi, z którego, po dalszym rozpadzie fi powstaje 2x4Po. Czasy połówkowego rozpadu wynoszą dla 2g4Pb
1 2^4Bi, odpowiednio, 26,8 min i 19,7 min. Obliczyć liczby atomów' Pb, Bi i Po po 30 minutach, jeżeli w chwili t = 0 było 1000 atomów' 2s2Pb. Czy' liczba atomów- Bi może osiągnąć wartość 500? Odp. n?b- 460, /7Po= 228, /?Bi = 312. Nie, («Bj)maks = = 313.
A'a
5b:9. Produkt B powstaje w wyniku reakcji A —> B, a ten ulega rozkładowi
A ^
B —» C. Obie reakcje są I rzędu. Zakładając, że w chwili t = 0, [B]0 = 0, obliczyć maksymalną wydajność względną, ([B]/[A]0)maks, oraz czas jej osiągnięcia, gdy 1) Aa = 0,4; Ab = 0,2 min-1; 2) A'a = 0,2; Ab = 0,4 min-1; A'a = Ab = 0,2 min-1.
Odp. 1) 50%; 3,47 min; 2) 25%; 3,47 min; 3) 36,8%; 5 min.
5b:10. Rozważyć reakcję odwracalną (obie reakcje sąl rzędu)
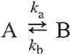
z warunkami początkowymi [A]0 = a, [B]0 = 0. Oznaczając dla dowolnego czasu /, [A] = a - x, [B] = x, wykazać, że
Wyszukiwarka
Podobne podstrony:
skan0237 240 Kinetyka chemiczna Przykład 5.17. Stałe szybkości reakcji w fazie gazowej 1. &nbs
skan0207 210 Kinetyka chemiczna można go uniknąć, obliczając stałe szybkości za pomocą wyrażeń otrzy
75540 skan0249 252 Kinetyka chemiczna 252 Kinetyka chemiczna Odp. k2 = 5a:9. Wyprowadzić równanie na
skan0209 212 Kinetyka chemiczna Obliczyć stałą szybkości reakcji zmydlania estru, traktując ją jako
skan0215 218 Kinetyka chemiczna Obliczoną stąd stałą szybkości k = (1,22 ± 0,01) • 10 8 Pa 1 • s 1
skan0233 236 Kinetyka chemiczna Tak więc, po drobnych przekształceniach mamy 236 Kinetyka chemiczna
skan0251 254 Kinetyka chemiczna a — «<*, w którym a0 jest kątem skręcenia płaszczyzny polaryzacji
68830 skan0219 222 Kinetyka chemiczna Stąd po scałkowaniu mamy 222 Kinetyka chemiczna CB k„ a a h -
skan0223 226 Kinetyka chemiczna wynosi 37 fis. W tej temperaturze gęstość wody wynosi 0,9970 g ■ cm
więcej podobnych podstron