skan0201

204 Kinetyka chemiczna
Czas połówkowy reakcji rzędu pierwszego wynosi
(5.8)
_ ln 2
^1/2 — 7
Szybkość reakcji rzędu drugiego (n = 2) zależy od stężenia A według równania kinetycznego
dc
~dt
(5.9)
które, po scałkowaniu przy warunku początkowym t = Q,c = c0, daje
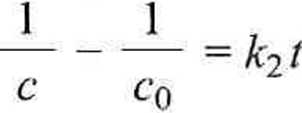
L co-°
t C0C
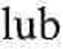
(5.10)
Czas połówkowy reakcji rzędu drugiego wynosi
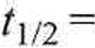
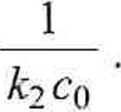
(5.11)
Inną, często spotykaną, formą przedstawiania równań kinetycznych jest oznaczanie stężenia powstałego produktu przez x. Dla reakcji A —> B równanie bilansu stężeń reagentów
a = c + x,
gdzie a jest stężeniem początkowym A, zaś x jest stężeniem B, musi być spełnione w każdej chwili t. Wówczas, dla reakcji rzędu pierwszego, zamiast wyrażenia (5.5), będziemy mieli
dx
— = A'j(a -x) (5.12)
i odpowiednio
7 1 , a
*! = —In-. (5.13)
t a - x
Zapis taki jest szczególnie użyteczny w reakcjach z udziałem kilku cząsteczek o niejednakowych stężeniach początkowych.
Niekiedy zaawansowanie reakcji określa się przez stopień przereagowania w, gdzie ilość produktu jest odniesiona do początkowej ilości jednego ze substratów, oczywiście, z uwzględnieniem stechiometrii reakcji. Np. dla reakcji 2A —> X
w[%]= 100%.
a
Wyszukiwarka
Podobne podstrony:
13894 skan0203 206 Kinetyka chemiczna Warto zauważyć, że jedynie dla reakcji pierwszego rzędu czas p
12447 skan0208 Kinetyka chemiczna 211 Rys. 5.1. Wyznaczanie rzędu i stałej szybkości reakcji metodą
51801 skan0211 214 Kinetyka chemiczna [E], M Rys. 5.3. Wyznaczanie czasów połówkowych reakcji dla ró
skan0237 240 Kinetyka chemiczna Przykład 5.17. Stałe szybkości reakcji w fazie gazowej 1. &nbs
skan0200 (2) Kinetyka chemiczna 203 Szybkość reakcji A B zgodnie z równaniem (5.1) wyraża się
skan0209 212 Kinetyka chemiczna Obliczyć stałą szybkości reakcji zmydlania estru, traktując ją jako
skan0247 250 Kinetyka chemiczna gdzie dla rozważanej reakcji ~A = -2, zB = — 1. Dla dwóch różnych si
więcej podobnych podstron