50424 skan0241
244 Kinetyka chemiczna
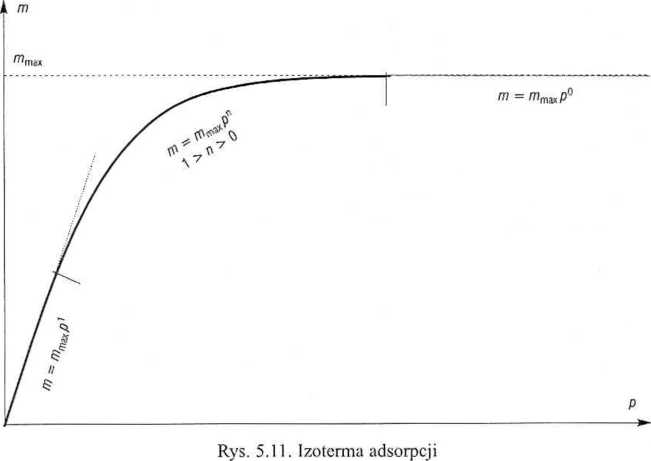
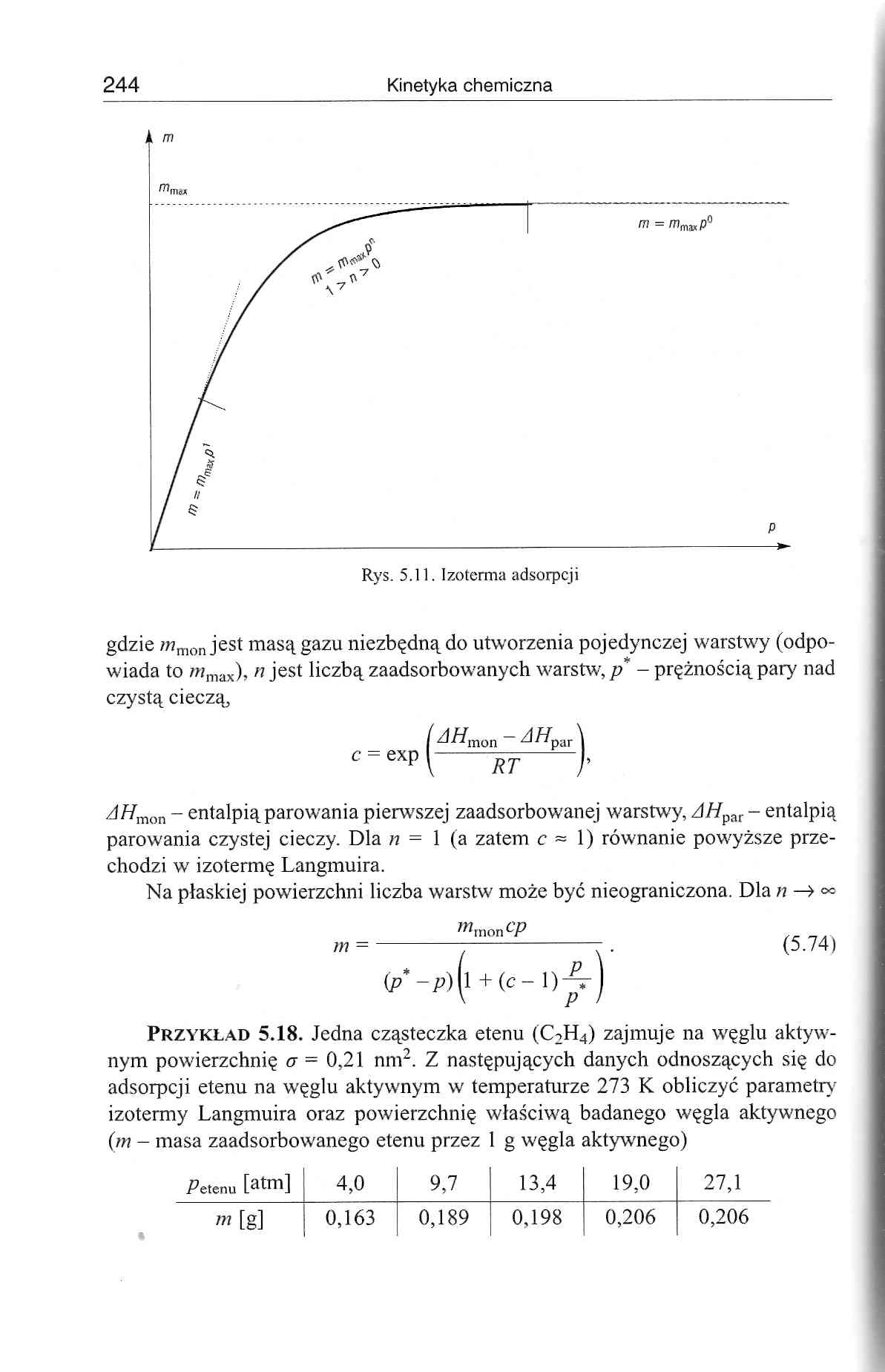
gdzie 7«mon jest masą gazu niezbędną do utworzenia pojedynczej warstwy (odpowiada to wmax), //jest liczbą zaadsorbowanych warstw,/?* - prężnością pary nad czystą cieczą,
c = exp
RT
A//mon - entalpią parowania pierwszej zaadsorbowanej warstwy, AHpar - entalpią parowania czystej cieczy. Dla n = 1 (a zatem c ~ 1) równanie powyższe przechodzi w izotermę Langmuira.
Na płaskiej powierzchni liczba warstw może być nieograniczona. Dla n —>
m
^mon ^P
(p -p) 1 + (c- 1)
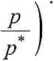
(5.74)
Przykład 5.18. Jedna cząsteczka etenu (C2H4) zajmuje na węglu aktywnym powierzchnię a = 0,21 nnr. Z następujących danych odnoszących się do adsorpcji etenu na węglu aktywnym w temperaturze 273 K obliczyć parametry izotermy Langmuira oraz powierzchnię właściwą badanego węgla aktywmego (m - masa zaadsorbow'anego etenu przez 1 g węgla aktywnego)
|
ketenu [3tm] |
4,0 |
9,7 |
13,4 |
19,0 |
27,1 |
|
™ [g] |
0,163 |
0,189 |
0,198 |
0,206 |
0,206 |
Wyszukiwarka
Podobne podstrony:
skan0247 250 Kinetyka chemiczna gdzie dla rozważanej reakcji ~A = -2, zB = — 1. Dla dwóch różnych si
38958 skan0235 238 Kinetyka chemiczna gdzie Aą i h oznaczają, odpowiednio, stałą Boltzmanna i stałą
skan0233 236 Kinetyka chemiczna Tak więc, po drobnych przekształceniach mamy 236 Kinetyka chemiczna
skan0237 240 Kinetyka chemiczna Przykład 5.17. Stałe szybkości reakcji w fazie gazowej 1. &nbs
skan0251 254 Kinetyka chemiczna a — «<*, w którym a0 jest kątem skręcenia płaszczyzny polaryzacji
68830 skan0219 222 Kinetyka chemiczna Stąd po scałkowaniu mamy 222 Kinetyka chemiczna CB k„ a a h -
skan0207 210 Kinetyka chemiczna można go uniknąć, obliczając stałe szybkości za pomocą wyrażeń otrzy
skan0223 226 Kinetyka chemiczna wynosi 37 fis. W tej temperaturze gęstość wody wynosi 0,9970 g ■ cm
47714 skan0253 256 Kinetyka chemiczna szybkość powstawania produktu w funkcji [A] i stałych szybkośc
więcej podobnych podstron