452 [1024x768]

462
KINETYKA CHEMICZNA
Przykład
Przebieg reakcji 3 HCNO=(HCNO)j badano na podstawie spadku ciśnienia w warunkach izochorycznych. W jednym doświadczeniu ciśnienie spadło w ciągu 23 godzin z 188,8 do 153 mm Hg, w drugim zaś w ciągu 20 godzin z 79.1 do 76,8 mm Hg. Jaki jest rząd reakcji?
Zgodnie z równaniem (6.21) r2ąd reakcji można określić porównując szybkości reakcji dla dwu różnych stężeń początkowych. W naszym przypadku rolę stężeń spełniają ciśnienia.
Szybkości reakcji obliczymy jako wielkości średnic, zastępując pochodne skończonymi zmianami ciśnień.
Dla pierwszego doświadczenia
*Pt .
Ar,
Dla drugiego doświadczenia
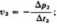
rząd reakcji
2,99.
log 188,8-log 79.1
Rząd reakcji jest więc zgodny z wartością przewidzianą przez równanie stechiomełryczne i można wnioskować, że reakcja jest trójcząsteczkowa.
Reakcje złożone
Reakcja Reakcje odwrotne należą do najczęściej spotykanych reakcji złożonych. W poprzednim podrozdziale nadmieniano, źe niemal wszystkie reakcje są odwracalne i po pewnym czasie, od chwili rozpoczęcia reakcji, szybkość ich jest wypadkową z reakcji w jednym i drugim kierunku. Ujęcie takiego procesu za pomocą jednego równania kinetycznego jest przeważnie bardzo trudne, a w wielu przypadkach w ogóle niemożliwe. Tylko dla reakcji o prostym mechanizmie i niskiej całoliczbowej rzędowości możliwe jest ścisłe ilościowe ujęcie sumarycznej kinetyki procesu. Jeżeli reakcje zachodzące zarówno w prawo jak i w lewo są pierwszego rzędu, wówczas
= *, a-(*,+*_, )x (6.22)
Symbol k na stałą szybkości z ujemnym indeksem u dołu oznacza zawsze stałą szybkości reakcji odwrotnej.
Wyszukiwarka
Podobne podstrony:
458 [1024x768] 468 KINETYKA CHEMICZNA Przykład 3 Pewna reakcja w lemp. 40°C po upływie 15 min. zacho
462 [1024x768] 472 KINETYKA CHEMICZNA Szybkość więc reakcji będzie określonad[C] d / *K*lA][B]. (6.4
Przykładowe przebiegi mocy mechanicznej i elektrycznej, obliczone na podstawie przedstawionych powyż
skan0237 240 Kinetyka chemiczna Przykład 5.17. Stałe szybkości reakcji w fazie gazowej 1. &nbs
456 [1024x768] 466 KINETYKA CHEMICZNA Z ma wymiar szybkości reakcji; wyraża liczbę cząsteczek reaguj
skan0200 (2) Kinetyka chemiczna 203 Szybkość reakcji A B zgodnie z równaniem (5.1) wyraża się
43071 skan0198 5. Kinetyka chemiczna Miarą szybkości reakcji w chwili / jest zmiana liczby moli któr
446 [1024x768] 456 KINETYKA CHEMICZNA Współczynniki potęgowe przy stężeniach w równaniach kinetyczny
468 [1024x768] 47* KINETYKA CHEMICZNA Strzałkami zaznaczono kierunek przenoszenia ładunku ujemnego p
472 [1024x768] 482 KINETYKA CHEMICZNA stosuje się różne związki, najczęściej celit (glinokrzemian),
478 [1024x768] 488 KINETYKA CHEMICZNA wymieniacza. Dla ilościowego opisu równowagi można także posłu
480 [1024x768] 490 KINETYKA CHEMICZNA centrów aktywnych. Jeżeli wyrazimy izotermę Langmuira w postac
482 [1024x768] 492 KINETYKA CHEMICZNA to po wstawieniu (6.61) do (6.60) otrzymamy ((ES)*)
486 [1024x768] 496 KINETYKA CHEMICZNA 2) najkorzystniejsza wzajemna orientacja rea
więcej podobnych podstron