462 [1024x768]

472
KINETYKA CHEMICZNA
Szybkość więc reakcji będzie określona
*K*lA][B].
(6.43)
6/f* jest oczywiście stałą szybkości reakcji drugiego rzędu. Stała b w równaniu (6.40) jest czynnikiem częstości, określa szybkość z jaką aktywny kompleks przejściowy przechodzi do stanu końcowego, lub początkowego reakcji. Jest więc odwrotnością czasu życia takiego kompleksu. Czas życia jest zaś bardzo krótki. Atomy znajdują się w stanie ciągłego ruchu oscylacyjnego o częstości rzędu 10,3s_l i z taką częstością zmieniają swoje położenie. Przyjmuje się najczęściej, żc
b
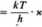
(6.44)
gdzie: k — stała Boltzmanna, h — stała Plancka, a x jest współczynnikiem Współczynnik transmisji, który podaje prawdopodobieństwo, że aktywny kompleks przeobrazi się w produkt, a nic z powrotem w substrat.
Stałą równowagi K* wyrazić można za pomocą funkcji termodynamicznych tworzenia aktywnego kompleksu, zgodnie z równaniem
AG0* = -RT\nK* (6.45)
Stan standardowy w tym przypadku będzie określony jednostkowymi stężeniami molowymi. Ponieważ AC0* = AH°* — TAS°* otrzymujemy
k
kT
h
xeAS<>+/*e-AH0*/*r
(6.46)
Entropia
Wielkości AS0* i AH°* noszą nazwę entropii i entalpii aktywacji.
AKTYWACJI
Przykład I
Stałe szybkości reakcji rozkładu czterometylosilanu Si(CHj)« w temperaturach 7I7°C i 659*0 wynoszą odpowiednio 6,72- 10-3 i 5,27- 10‘4s"1. Obliczyć entropię i entalpię aktywacji tej reakcji (AS* i A//♦). Zakładamy, ie x = 1.
Zgodnie z teorią absolutnych szybkości reakcji stałe szybkości wyrazimy za pomocą
Wyszukiwarka
Podobne podstrony:
458 [1024x768] 468 KINETYKA CHEMICZNA Przykład 3 Pewna reakcja w lemp. 40°C po upływie 15 min. zacho
452 [1024x768] 462 KINETYKA CHEMICZNA Przykład Przebieg reakcji 3 HCNO=(HCNO)j badano na podstawie s
456 [1024x768] 466 KINETYKA CHEMICZNA Z ma wymiar szybkości reakcji; wyraża liczbę cząsteczek reaguj
472 [1024x768] 482 KINETYKA CHEMICZNA stosuje się różne związki, najczęściej celit (glinokrzemian),
P5101344 Kinetyka i równowaga chemicznaPodstawowe zagadnienia kinetyki chemicznej Szybkość reakcji c
skan0233 236 Kinetyka chemiczna Tak więc, po drobnych przekształceniach mamy 236 Kinetyka chemiczna
47714 skan0253 256 Kinetyka chemiczna szybkość powstawania produktu w funkcji [A] i stałych szybkośc
446 [1024x768] 456 KINETYKA CHEMICZNA Współczynniki potęgowe przy stężeniach w równaniach kinetyczny
468 [1024x768] 47* KINETYKA CHEMICZNA Strzałkami zaznaczono kierunek przenoszenia ładunku ujemnego p
478 [1024x768] 488 KINETYKA CHEMICZNA wymieniacza. Dla ilościowego opisu równowagi można także posłu
480 [1024x768] 490 KINETYKA CHEMICZNA centrów aktywnych. Jeżeli wyrazimy izotermę Langmuira w postac
482 [1024x768] 492 KINETYKA CHEMICZNA to po wstawieniu (6.61) do (6.60) otrzymamy ((ES)*)
486 [1024x768] 496 KINETYKA CHEMICZNA 2) najkorzystniejsza wzajemna orientacja rea
więcej podobnych podstron