9402139836
jednoznacznie powiedzieć czy starzejemy się, bo starzeją się nasze komórki czy starzenie komórkowe towarzyszy starzeniu organizmu. Jednakże biorąc pod uwagę fakt, że komórka jest podstawową cegiełką budującą tkanki i narządy można spekulować, że to właśnie zmiany w niej zachodzące pociągają za sobą zmiany na wyższych poziomach organizacyjnych. Starzenie poszczególnych tkanek i narządów najprawdopodobniej spowodowane jest akumulacją komórek starych, które to poprzez zmieniony metabolizm wpływają na komórki sąsiadujące. Wytwarzają specyficzne mikrośrodowisko, a wydzielane białka mogą oddziaływać zarówno w sposób parakrymiy jak i autokrynny. Wpływ ten głównie wynika z wydzielania przez stare komórki związków odpowiedzialnych za wytworzenie stanu zapalnego. Prowadzi to do podwyższenia ogólnoustrojowego stanu zapalnego, związanego również z podwyższoną produkcją wolnych rodników. Chroniczny stan zapalny obserwuje się u osób w podeszłym wieku (ang. Iow grade inflammation) i towarzyszy on w zasadzie wszystkim chorobom wieku podeszłego [3].
RODZAJE STARZENIA KOMÓRKOWEGO I JEGO PRZYCZYNY
Możemy wyróżnić dwa rodzaje starzenia komórkowego: replikacyjne i przyspieszone. Starzenie replikacyjne wynika z wyczerpania limitu podziałowego i dotyczy większości typów komórek somatycznych zarówno in vitro jak i in vivo [4], Jego przyczyną jest skracanie się telomerów (Ryc. 1). Telomery u człowieka składają się z tysięcy powtórzeń motywów zbudowanych z 6 par zasad TTAGGG. U człowieka jest to około 10 kpz, a u myszy ok. 40 kpz [5]. Są one swoistym replikometrem komórki (licznikiem podziałów). Ich funkcja polega na zabezpieczaniu zakończeń chromosomów przed łączeniem się. Dzięki temu w komórce zachowana jest integralność genomu. Uważa się, że do starzenia komórki dochodzi, gdy telomery ulegną skróceniu do połowy swojej wyjściowej długości i dotyczy to większości typów komórek. Ostatnie badania wykazały, że do uruchomienia procesu starzenia komórkowego wystarczy skrócenie do krytycznej długości telomerów na 5 chromosomach [6]. Skracanie telomerów ma miejsce z powodu nierównocennej replikacji obydwu nici DNA, tzw. problemu końca replikacji. Ciągła synteza nowej nici odbywa się zawsze od końca 3' do końca 5'. Powstająca na matrycy 3'-5' nić wiodąca jest syntetyzowana w całości, natomiast powstająca na matrycy 5'-3' nić opóźniona powstaje fragmentarycznie. W celu powielenia nici opóźnionej najpierw dobudowane zostają startery RNA inicjujące proces syntezy DNA, potem miedzy nimi syntetyzowane są tzw. fragmenty Oka-zaki. Następnie startery są usuwane, a fragmenty Okaza-ki łączone, ale końcowy fragment nici opóźnionej zawsze pozostaje krótszy (Ryc. 2).
Budowa zakończeń chromosomów jest bardzo specyficzna. Tworzą one dwie pętle (D i T). Dzięki wyjątkowemu upakowaniu nici DNA nie dochodzi do aktywacji ścieżki związanej z wykrywaniem uszkodzeń DNA. Rozpoznawanie pęknięć DNA może mieć miejsce wtedy, gdy struktura nici DNA jest liniowa. Gdyby zakończenia chro
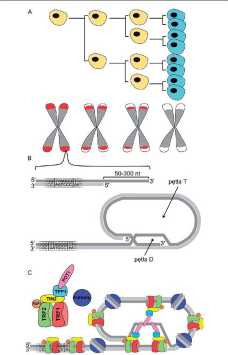

mosomów zostały rozpoznane przez czynniki naprawy jako uszkodzenia DNA, to doszłoby do łączenia chromosomów. Oprócz powtórzeń motywów TTAGGG struktura wspierana jest przez białka, zwane szelterynami (ang. shelterin). Obecnie znanych jest 6 takich białek i należą do nich TRF1, TRF2, POT1, TPP1, TIN2 oraz Rapl (Ryc. 1) [7,8]. Białka te zapewniają utrzymanie specyficznej struk-
148
i .postepybiochemii.pl
Wyszukiwarka
Podobne podstrony:
img080 80 Zatem pytania o istnienie i jednoznaczność funkcji interpolującej i sprowadza się do tego,
IMG# Powiedz, czy Ania ubrała się w sukienkę, czy spodnie. Poszukaj naklejki z sukienkę dla lalki i
3 (406) Słuchając wiersza, wskazuj występujących tam bohaterów. Powiedz, czy dzieci zachowywały się
Untitled 30 Rymujące się pary słów, część 6 i 7 Posłuchajcie uważnie, jak brzmią pary słów. Powiedzc
Trudno powiedzieć czy dokonują się zmiany profilu osobowościowego. Forma kwalifikacji na zajęcia poz
zielińska 2(1) Cykl komórkowy (CK). Regulacja starzenia się i śmierć komórki • Co
Od roku 1989 wiele się zmieniło w naszym kraju. Proszę powiedzieć, czy i co, Pana(i) zdaniem zmienił
rymy0012 Rymujące się pary słów, część 6 i 7 Posłuchajcie uważnie, jak brzmią pary słów. Powiedzcie
Litery drukowane maĹ‚e strona32 Przyjrzyj się dokładnie parom liter zapisanym w kratkach. Powiedz, c
Wymieszaj wskazane kolory i pomaluj plamy. Jakie barwy powstały? Powiedz, czy powstałe barwy kojarzą
ale trudno powiedzieć, czy to właśnie miał Pawłów na myśli. Ograniczył się on tylko do pokazania pew
więcej podobnych podstron