6060121183
a) 02
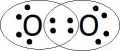
Tlen ma 6 elektronów walencyjnych.
W cząsteczce tlenu występuje wiązanie kowalencyjne niespolaryzowane.
Wzór elektronowy:
Wzór strukturalny: 0=0
b) Br2
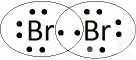
Brom ma 7 elektronów walencyjnych.
W cząsteczce bromu występuje wiązanie kowalencyjne niespolaryzowane.
Wzór elektronowy:
Wzór strukturalny: Bf-Br
c) Cl20
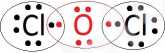
Chlor ma 7 elektronów walencyjnycj, a tlen ma 6 elektronów walencyjnych.
W cząsteczce tlenku chloru(l) występuje wiązanie kowalencyjne spolaryzowane.
Wzór elektronowy:
Wzór strukturalny: CI-O-CI
d) Si02
Krzem ma 4 elektrony walencyjne, a tlen ma 6 elektronów walencyjnych.
W cząsteczce tlenku krzemu(IV) występuje wiązanie kowalencyjne spolaryzowane.
e) MgCl2
Magnez ma 2 elektrony walencyjne, a chlor ma 7 elektronów walencyjnych.
W cząsteczce chlorku magnezu występuje wiązanie jonowe.
Wzór elektronowy:
Wzór strukturalny:
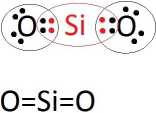
Wzór elektronowy: *C|t Mg tCI I Wzór strukturalny: [Cl] Mg2* [Cl]
f) aif3
Glin ma 3 elektrony walencyjne, a fluor ma 7 elektronów walencyjnych.
W cząsteczce fluorku glinu występuje
wiązanie jonowe. j*p*.
• •
Wzór elektronowy: Al
:f:
Wzór strukturalny:
Wyszukiwarka
Podobne podstrony:
P5101283 Zadani* 2 (1 punkt) Wyjaśnij. podając wzór elektronowy, dlaczego w cząsteczce tlenu występu
Slajd5 ALOTROPIA TLENU TLEN - występuje w dwóch odmianach alotropowych -02 tlen i 03 ozon. Tlen jest
Atom tej domieszki ma trzy elektrony walencyjne, związane z sąsiednimi atomami krzemu. Do wypełnieni
• • 101.7 pm jt . -V J>H
• • 101.7 pm jt . -V J>H
P1020192 11. Jaku jest rola czerwonych krwinek w transporcie 02? Cząsteczki tlenu rozpuszczone w oso
te łączą się z innymi cząsteczkami tlenu dając cząsteczki ozonu 02 +hv(fale <240)= 0+0 a 0+02= 03
DSC02062 16 grupa: 02 (tlen jest paramagnetyczny tzn. jest wciągany przez pole magnetyczne, ma wobec
DSC01348 (9) Cząsteczki wieloatomowe - NH3 Liczba elektronów walencyjnych w NH3 wynosi 8. NH,: iMj2
DSC01349 (10) Hiperwalencyjność W przypadku cząsteczki SF6 liczba elektronów walencyjnych wynosi 12.
więcej podobnych podstron