8970952870
Zależność pomiędzy współczynnikiem aktywności - /, a siłą jonową - Sj została podana przez Debye’a-Huckla wzór (8).
log± f = ~
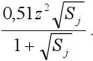
(8)
Dla roztworów o sile jonowej nie przekraczającej wartości 0,01, można stosować w postaci uproszczonej tzw. graniczne prawo Debye’a-Huckla (9):
(9)
log/, =-0,52.-!1/s7>
gdzie: z - jony o dodatnich i ujemnych stopniach utlenienia elektrolitu, 0,52- współczynnik tylko dla roztworów wodnych.
Z wzorów (8 i 9) wynika, że ze wzrostem stężenia roztworu maleje współczynnik aktywności i tym samym aktywności są coraz mniejsze w stosunku do roztworów wyjściowych.
Dalsze badania nad tym zagadnieniem prowadzili Stokes-Robinson oraz Bjemim i inni wprowadzając dodatkowe poprawki, co pozwoliło wyznaczyć współczynniki aktywności dla wyższych stężeń roztworów.
Gdy wartość siły jonowej jest bliska zeru (roztwory bardzo rozcieńczone), współczynnik aktywności wynosi 1. Wówczas aktywności nie różnią się od stężeń molowych.
W tabeli 1 podano zależności współczynników aktywności - /, od różnych wartości siły jonowej - SV oraz od jonów na kilku stopniach utlenienia. Tabela 1 [1],
|
Siła jonowa - Sj |
0 |
0,001 |
0,002 |
0,005 |
0,01 |
0,02 |
0,05 |
0,10 |
|
Wartości współ, aktywności - f dla jonów o stopniach utlenienia | ||||||||
|
± pierwszym |
1,00 |
0,97 |
0,95 |
0,93 |
0,90 |
0,87 |
0,81 |
0,76 |
|
± drugim |
1,00 |
0,87 |
0,82 |
0,74 |
0,66 |
0,56 |
0,43 |
0,33 |
|
± trzecim |
1,00 |
0,73 |
0,64 |
0,51 |
0,39 |
0,28 |
0,15 |
0,08 |
13
Wyszukiwarka
Podobne podstrony:
Outokumpu014 Zawartoić Cu w kamieniu. % Ryi. 5.23. Zależność pomiędzy współczynnikami podziału pomię
P3073609 Stąd zależność pomiędzy współczynnikiem przejmowania ciepła i wymienionymi wielkościami wyz
DSC07796 aiuauiicu wuuno-ccmcmowy Rys. 7.3. Zależność pomiędzy współczynnikiem wic a przepuszczalnoś
DSCF5535 Zależność pomiędzy strukturą a aktywnością O SAR (Quantitative Structme - Acthrtty Relation
DSCF5536 Zależność pomiędzy struktur a aktywnością (eipannilaaM w nmbli - altem dla substancji
Rys. 2. Zależności pomiędzy kątem chwytu i kątem tarcia: a) w momencie chwytu metalu przez walce, b)
Slajd30 (101) Zależności pomiędzy stałymioptycznymi. Współczynnik absorpcji Zakładamy, że wzdłuż osi
wspolczynniki wzmocnienia pradowego Podaj zależność pomiędzy wsp6kz>tmiiam» wzmocnienia prądowego
2 04 70 Tablica 7.3 Współczynniki określające zależność pomiędzy rezystancją zestyku a jej rozrzutem
1. Układ sił w zespole gwintowym, zależność pomiędzy siłą wzdłużną w śrubie a momentem niezbędnym do
DSC00656 (7) Na podstawie prawa Hookea opisać można zależność pomiędzy siłą F a odkształceniem e
2 04 70 fTablica 7.3 Współczynniki określające zależność pomiędzy rezystancją zestyku a jej rozrzute
lista3 2 2) Wybierz poprawną zależność pomiędzy silą osiową A a naprężeniami normalnymi w przekroju
więcej podobnych podstron