2212791086
10P. SPEKTROFOTOMETRYCZNE WYZNACZANIE STAŁYCH DYSOCJACJI PURPURY m-KREZOLOWEJ
Związek o charakterze słabego kwasu (HA) ulega w rozpuszczalnikach typu wody (SH) reakcji dysocjacji:
HA + SH » SH2ł + A'
której równowagę charakteryzuje stała dysocjacji kwasowej:
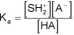
Podobnie moc zasady (B) reagującej z rozpuszczalnikiem wg równania: B + SH S- + BH+
określa stała dysocjacji zasadowej:
Kb
(2)
(3)
Logarytmowanie obu stron równania (1) daje wyrażenie: pKa=PH+ig["1
Powyższa zależność pozwala znaleźć stałą dysocjacji na podstawie pomiaru stosunku stężeń sprzężonej pary kwas-zasada w roztworze o znanym pH.
Wygodnym obiektem do zapoznania się z metodą jest dwubarwny wskaźnik stężenia jonów wodorowych, wykazujący charakter słabego kwasu.
Jeżeli stan równowagi w roztworze wskaźnika opisać równaniem:
InH -^=a! H+ + Irr
to wyrażenie (1) przyjmie postać:
pK„ = pH + lgM (4)
Fi
W roztworze dostatecznie kwaśnym wskaźnik będzie miał barwę charakterystyczną dla jego postaci niezdysocjowanej InH, natomiast w roztworze dostatecznie zasadowym przyjmie barwę właściwą anionowi ln\ Przy określonej wartości pH zawartej między wartościami granicznymi dla której [InH] = [In'] równanie (4) przybiera wtedy postać:
pKm = pH (5)
Wyznaczenie stałej dysocjacji sprowadza się wtedy do eksperymentalnego wyznaczenia pH, przy którym spełniona jest powyższa zależność.
Wyszukiwarka
Podobne podstrony:
Celem ćwiczenia jest zapoznanie studenta z metodą wyznaczenia stałych dysocjacji kwasowej purpury
Spis treści 24. Wyznaczanie stałych dysocjacji fluorescencyjnych indykatorów
Zdjęcie0843 (2) Kwasy wioloprotonowe Różnice w wartościach Kolejnych stałych dysocjacji wynikają z 1
img009 PRZYKŁADY Uwaga 1.4 Ten drugi sposób wyznaczania stałych nazywamy metodą przesłaniania. Jest
img028 (44) Ćwiczenie nr. 9. Str.4a = Metody doświadczalne wyznaczania stałych równowag polegają na
img009 PRZYKŁADY Uwaga 1.4 Ten drugi sposób wyznaczania stałych nazywamy metodą przesłaniania. Jest
scan0020 6 ORAZ WYZNACZANIE STAŁEJ DYSOCJACJI SŁABEGO KWASU 1. Pomiary pH roztworów wodnych metodą
kompleksowe, stałe trwałości, metody wyznaczania stałych trwałości kompleksów (metoda
wyznaczanie stalej dysocjacji (2) ITabela 4. Wartości granicznych przewodnictw jonowych wybranych jo
wyznaczanie stalej dysocjacji (4) Z Kti^buire&O: -5 w-v.gi.urv CL- * "X - lnł (ó • /O^ 0^3*
więcej podobnych podstron