5299812994
2) Oznaczanie Cu2+
Jony Cu2+ w roztworach wodnych związane są z czterema ligandami - cząsteczkami wody tworząc jon [Cu(H20)4]2+ o barwie niebieskiej. Po dodaniu amoniaku do roztworu zawierającego jony miedzi (II) powstaje kompleks [Cu(NH3)4]2+ o intensywnym niebiesko-granatowym zabarwieniu. Intensywność zabarwienia jest wprost proporcjonalna do stężenia jonów Cu2+ w roztworze. Z krzywej absorpcji (Rysunek 3) wyznaczamy długość fali A,max dla badanego kompleksu miedzi czyli długość fali, przy której analizowana próbka wykazuje największą absorbancję.
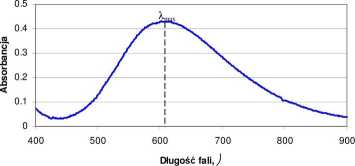
Rysunek 3. Widmo absorpcji kompleksu jonów Cu2+ z amoniakiem.
Przygotowanie krzywej wzorcowej dla oznaczania Cu2+:
• Roztwór wzorcowy roboczy: Do kolbki o pojemności 100 cm3, prowadzący ćwiczenie wydaje roztwór zawierający 100 mg Cu2+. Kolbkę należy uzupełnić do kreski wodą destylowaną, wymieszać.
• Roztwory wzorcowe: Do pięciu kolbek miarowych o pojemności 25 cm3 odmierzyć kolejno 3, 6, 9, 12, 15 cm3 roztworu roboczego. Do każdej kolbki dodaje się 3 cm3 3 M roztworu NH4OH. Całość uzupełnić wodą destylowaną do kreski, wymieszać. Zmierzyć absorbancję przy A,max = 608 nm dla poszczególnych roztworów, a następnie na papierze milimetrowym wykreślić zależność A =f{c).
Oznaczenie Cu2+ w analizowanej próbce:
Otrzymaną w kolbie miarowej o pojemności 100 cm3 próbę o nieznanej zawartości Cu2+ uzupełnić do kreski wodą destylowaną. Z tego roztworu pobrać do 3 kolbek o pojemności 25 cm3 po 10 cm3, dodać podobnie jak przy sporządzaniu roztworów do krzywej wzorcowej, 3 cm3 3 M roztworu NH4OH. Roztwory uzupełnić wodą destylowaną do kreski, wymieszać. Zmierzyć absorbancję przy A,max. Obliczyć średnią z trzech pomiarów absorbancji. Odczytać stężenie miedzi z krzywej wzorcowej i obliczyć zawartość Cu2+ w badanej próbce. Jako wynik oznaczenia należy podać masę Cu2+ (w mg) w kolbce o pojemności 100 cm3.
Wskazówka:
Zastanów się:
1) jaka jest masa Cu2+ w kolbce o pojemności 25 cm3, znając stężenie Cu2+ z krzywej wzorcowej w 1 cm3 roztworu ?
2) jak jest masa analitu w całej próbce wiedząc, że do kolbki o pojemności 25 cm3 pobrano 10 cm3 z kolbki (100 cm3) zawierającej analizę ?
7
Wyszukiwarka
Podobne podstrony:
3) Równowagi 1z2 I. Dysoejacja jonowa. 1. Jakie jony znajdują się w wodnych roztwo
Rak pyt2 13
80792 Tytanowce (3) w roztworach wodnych nie istnieją - są utleniane przez wodę Związki z tlenem (IV
s02 (18) GENERALNYKONSTRUKTOR Samoloty transportowe oznaczone symbolem An związane są nierozerwalnie
DSCN4196 Oznaczanie cynku Jony cynkowe miareczkuje się roztworem EDTA w środowisku buforu amonowego
38828 skanuj0068 (15) 432 5. Równowagi jonom* w ro/cicńczonych roztworach wodnych co oznacza, że rel
więcej podobnych podstron