38828 skanuj0068 (15)

432 5. Równowagi jonom* w ro/cicńczonych roztworach wodnych
co oznacza, że relacja (3.8) zoslola prawidłowo przyjęta. Po podstawieniu wyników liczbowych do równania bilansu ładunków otrzymuje się:
lewa strona bilansu L-c . +c,Irt. = l,0310“3 + 9,71-10"12 -1.03-10"3
NII4 lljO
prawa strona bilansu P=c„_ = 1,03-10"\
Utl
a więc L=P, co potwierdza, że w obliczeniach można było pominąć stężenie jonów oksoniowych.
Odpowiedź
Skład równowagowy wodnego roztworu amoniaku o stężeniu c = 6,0-10"2 moi/dm3 jest następujący:
cHj0 - 55,34 mol/dm3, cNllj =5,90*10“2 mol/dm3, c^. = 1,03*10-5 mol/dm5, c . - 1,03-10'3 mol/dm3, c„ = 9,71-10"12 mol/dm3.
MI4 H)U
Ponieważ amoniak w roztworze wodnym ulega reakcji protolizy w niewielkim stopniu (Ki, ■ 1,8- KT5), a jego stężenie formalne w roztworze jest dość duże c - 0,06 mol/dm3, można założyć, że stężenie formy niezdysocjowanej amoniaku Jest znacznie większe od zdysocjowanej.
UPROSZCZONY MODEL MATEMATYCZNY II Uproszczenie modelu
Zakładając, że
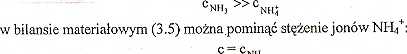
NH» __
W ten sposób otrzymuje się uproszczony model matematyczny II, który stanowi
(3.18)
(3.19)
układ równań (3.3), (3.4), (3.9), (3.19). Po podstawieniu zależności (3.9) oraz
(3.19) do równania (3.3) otrzymuje się:
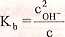
(3.20)
Stąd stężenie jonów wodorotlenkowych wynosi:
Drugi pierwiastek równania odrzuca się (cQH- < 0). Dalszy tok obliczeń jest taki sam jak w modelu I.
Obliczenia
Po podstawieniu danych liczbowych otrzymuje się:
c = ->/l ,8 ■ 10_s 0,06 = 1,04'10° H!2ł
dm
Natomiast stężenia pozostałych składników roztworu obliczone z zależności (3.16), (3.14), (3.17) wynoszą:
mol
dm5
mol
dm*
mol
dm3
0lffll-5.90-10-1
owu. -1,00-10-*
WERYFIKACJA ZAŁOŻENIA UPRASZCZAJĄCEGO Wysoka wartość stosunku:
Cmh, _ 5,90-10~ł
55
oznacza słuszność przyjętego uproszczenia (3.18). Po podstawieniu uzyskanych wyników do wyjściowego równania bilansu ładunków (3.6) otrzymuje się: lewa strona bilansu L"9,61I(T,2+ 1,00-iOT1 - 1,00-10"3, prawa strona bilansu P ■ 1,04-10-3.
Względny błąd obliczeń:
_^_-4,ooio;3__
Uproszczenie (3.18) motna stosować w przypadkach, gdy stężenie formy zdysocjowanej nie przekracza 5% stężenia formalnego elektrolitu.
Przykład 4
Obliczyć stopień protolizy kwasu azotowego(IU) (HNOj) w roztworze o stężeniu: a) c “ 0,5 mol/dm3.
Wyszukiwarka
Podobne podstrony:
skanuj0072 (15) 140 5. Równowagi Jonowe ro/ctcrtczonych roztworach wodnych Bilans ładunków. Zgodni
50054 skanuj0082 (12) 160 5. Równowagi Jonowo yy rozcieńczonych roztworach wodnych Odpowiedź . Skład
66962 skanuj0071 (15) 138 5. Równowagi jonowe w rozcieńczonych rortworath wpfrffŁ UPROSZCZONY MODEL
12293 skanuj0075 (15) 146 5. Równowagi Jonowe w roitclcricsonych roztworach wodnych 146 5. Równowagi
skanuj0081 158 • S. Równowagi Jonowe w roy,doliczonych roztworach wodnych Stężenie jonów wodorotlenk
skanuj0084 2 164 5. Równowagi Jonowe w ruzckrtc/onych roztworach wodnych -(0,175 +1,74 • 10“5) + ^(0
skanuj0101 2 198 5. Równowagi jonowe vr rozcieńczonych roztworach wodnych pH - 8. Stężenie formalne
71441 skanuj0070 (15) 136 • 5. K6wn(m«nł Jonowe w rozcieńcz
więcej podobnych podstron