9728252627
Strukturalnie NADP różni się od NAD jedynie obecnością ortofosforanu przy drugim atomie węgla (C2) rybozy nukleotydu adeninowego.
Formy zredukowane tych koenzymów uczestniczą w reakcjach redukcji związków karbonylowych do alkoholi. Zredukowane formy koenzymu NADPH + H+ uczestniczą m.in. w procesie syntezy kwasów tłuszczowych w cytoplazmie komórki. Głównym dostarczycielem tych zredukowanych dinukleotydów w komórce jest cykl fosfopentozowy.
Wszystkie koenzymy nikotynamidoadeninowe w swej strukturze zawierają witaminę PP, mianowicie niacynę, czyli kwas nikotynowy, dlatego witamina ta potrzebna jest do ich syntezy. Brak witaminy PP wywołuje chorobę zwaną pelagrą.
Formy zredukowane dinukleotydów nikotynamidoadeninowych wykazują dodatkowe maksimum absorpcji przy 340 nm, poza absorpcją światła przy 260 nm, która jest charakterystyczna dla obu form, zredukowanej i utlenionej. Fakt ten wykorzystuje się do śledzenia procesu redukcji dinukleotydów nikotynamidoadeninowych metodami optycznymi.
Nukleotydy flawinowe biorą udział w wielu biologicznych reakcjach utlenienia i redukcji. W ich strukturze występuje witamina B2, czyli ryboflawina (nu-kleozyd), związek o barwie żółtej.
Fosforyboflawina (FMN) jest mononukleotydem, składającym się z zasady azotowej zwanej izoalloksazyną (policykliczny heterocykl) i z rybitolu, zestryfi-kowanego ortofosforanem. FMN jest grupą prostetyczną niektórych oksydoreduk-taz, uczestniczących w reakcjach utlenienia biologicznego. Formy zredukowane nukleotydów flawinowych zawierają dwa protony i dwa elektrony, które przyłączone są do dwóch atomów azotu (NI i N10) heterocyklicznych pierścieni izoal-loksazyny. W wyniku redukcji stają się bezbarwne. Fakt zmiany barwy żółtej na bezbarwną może być wykorzystany do śledzenia redukcji flawin metodami optycznymi, szczególnie przy długości fali 450 nm, przy której zanika absorpcja światła przez zredukowane flawiny.
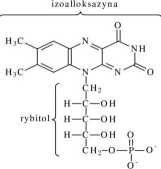
ortofosforan FMN (forma utleniona)
320
Wyszukiwarka
Podobne podstrony:
DSC02528 (Kopiowanie) Zadanie 12. 0-j Komórka roślinna różni się od zwierzęcej obecnością specyficzn
skanowanie0052 (17) strona doosiowa wierzchołka kwiatowego różni się od odosiowej obecnością produkt
Frywolitki Klasyczen Wzory (30) Numer 22. Koronka z narożnikami Ta koronka różni się od wzoru nr 21
10 (217) takiego obszaru obserwowana metodami metalograficznymi nie różni się od struktury materiału
220 Traktat drugi niż ona ma nad jego. Władca męża tak bardzo różni się od tej, . i • którą posiada
Metoda schodkowa różni się od metody limitów jedynie sposobem przeprowadzania oceny. W serii wstępuj
10 (217) takiego obszaru obserwowana metodami metalograficznymi nie różni się od struktury materiału
220 Traktat drugi niż ona ma nad jego. Władca męża tak bardzo różni się od tej, > • którą posiad
10 (217) takiego obszaru obserwowana metodami metalograficznymi nie różni się od struktury materiału
13 Jezvk prawniczy- tzn. język środowisk prawniczych, różni się od języka potocznego. Jest nadbudowa
skanowanie0052 (17) strona doosiowa wierzchołka kwiatowego różni się od odosiowej obecnością produkt
46 Joanna Stryjek Struktura australijskiego eksportu do UE znacznie różni się od struktury importu.
farma zwierzeta Twoje imię:_ Pokoloruj obrazek,, któiy różni sie od innych.
File0055 Znajdź w każdym rzędzie jeden element, który różni się od pozostałych.
Image102 Bramka z otwartym obwodem kolektora Bramka z otwartym obwodem kolektora różni się od typowy
Zdjęcia 0123 Zadanie: Czym koncepcja testu przesiewowego rożni się od koncepcji badania diagnostyczn
więcej podobnych podstron