3071579536
IZOTERMA SORPCJI
Ilość poszczególnej substancji zasorbowanej przez fazę stacjonarną zależy od stężenia w fazie ruchomej. Stosunek pomiędzy ilościązasorbowanąa stężeniem w fazie ruchomej, przy stałej temperaturze, nazywany jest izotermą sorpcji.
Sorpcja jest ogólnym pojęciem obejmującym kilka mechanizmów, takich jak, proces adsorpcji (np. oddziaływanie pomiędzy cząsteczkami substancji rozpuszczonej a powierzchnią ciała stałego), podział (rozcieńczenie cząsteczek substancji rozpuszczonej w cieczy), wymianę jonową (wymiana jonów substancji rozpuszczonej z jonami w fazie stacjonarnej) i wykluczanie (ograniczenie dyfuzji cząsteczek substancji rozpuszczonej poprzez porowatą fazę stacjonarną).
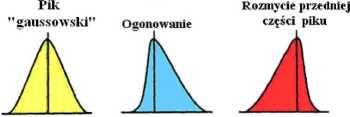
Izoterma sorpcji i kształt piku
Poniższe rysunki przedstawiają przebieg izotermy gdy stosunek pomiędzy stężeniem badanej substancji w fazie stacjonarnej (Cs) i stężeniem substancji rozpuszczonej w fazie ruchomej (Cm) jest liniowy. Stosunek Cs / Cm określa nachylenie krzywej.
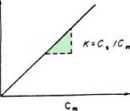
Izoterma sorpcji
Stężenie w kolumnie
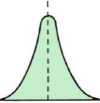
Dystans wzdłuż kolumny
Rozdział składników w kolumnie chromatograficznej
5
Wyszukiwarka
Podobne podstrony:
Organizacja społeczna - wniesienie przez nią odwołania zależy od 2 przesłanek: ♦
Chemia rep13 Gęstość substancji stałych i ciekłych, praktycznie nie zależy od ciśnienia, lecz zmieni
Ryt 15.7. Szybkość wyrównywania się stężeń danej substancji po oł>u stronach błony zależy od
Strumień Strumień jest to ilość substancji przepływająca przez pewien przekrój w jednostce czasu.
img181 (2) 376Słownik pojęć Trajektorie rozwojowe poszczególne ścieżki prowadzące przez życie, który
img082 82 kolumny (tzw. objętość aartwa kolumny). Składnik gazu edsorbowany przez fazę stełg przemie
pons212 Gdy chcemy luyrazić pewną nieokreśloną ilość jakiejś substancji, np. produktu spożywczego, w
PrepOrg cz I 7 - 97 Dopuszczalne obciążenie kolumny jest to maksymalna ilość destylowanej substancji
ptaki III (34) Ptaki śpiewające cechuje doskonale rozwinięty aparat gębowy. Poszczególne rodzaje wyd
Slajd29 (11) Właściwości elektryczne dowolnej substancji uwarunkowane przez: Konduktywność substancj
Rozpuszczalność <sl Iloczyn rozpuszczalności (L) Ilość gram substancji znajdująca się w 100 cm3
więcej podobnych podstron