
PODSTAWY ROBOTYKI
JW 21.1
Nowoczesne źródła zasilania

Spis treści
2. PODSTAWOWE POJĘCIA I TEORIA
2.3.1 Potencjał standardowy ogniwa
3.1.2. Akumulatory - omówione na przykładzie akumulatora NiMH
..............................................................
3.2.1. Baterie węglowe i litowe
2

1. Wstęp
Czy zastanawialiście się kiedyś, na jakiej zasadzie działa bateria lub akumulator? W
jaki sposób "magazynujemy" prąd? Jest to bardzo ciekawe zagadnienie. Wiadomo, że w
dzisiejszych czasach bez baterii i akumulatorów nie dałoby się żyć. Nie byłoby telefonów
komórkowych i zegarków elektronicznych. Samochody zapalane byłyby na korbę. Ogólnie
nasze życie byłoby mocno utrudnione i bardziej kosztowne. Dlaczego takie nie jest?
Generalnie wszystko opiera się o wykorzystaniu takiego źródła prądu, które energię
czerpie z zachodzących w nim reakcji chemicznych odwracalnych lub nie. Takie źródło prądu
nazywamy ogniwem. Zasadą działania najprostszego z nich, ogniwa galwanicznego, jest fakt,
że na granicy między metalem a elektrolitem tworzy się spadek potencjału, podtrzymywany
ciągle podczas przepływu prądu kosztem energii chemicznej.
Obecnie różnorodność występujących ogniw jest ogromna. Powstawały one w
różnych czasach i opierały się na różnych zasadach. Ogniwa wykorzystywane są praktycznie
wszędzie. W telefonach komórkowych, w samochodach, w kalkulatorach, w bateriach i
akumulatorach. Ułatwiają nam codzienne życie i dają dostęp do wielu udogodnień. Dla
niektórych z nas wręcz je umożliwiają
Ochrona środowiska to bardzo ważny obecnie temat. Różne formy wykorzystania
ogniw są dla niej poważnym problemem. Produkcja i składowanie zużytych ogniw, co robimy
z nimi, gdy już nie są nam potrzebne - a co powinniśmy robić?
3

2. Podstawowe pojęcia i teoria
2.1. Anoda
W ogniwie galwanicznym elektroda pobierająca elektrony z obszaru
międzyelektrodowego, zachodzi na niej reakcja utleniania, jest elektrodą ujemną. W
przyrządzie elektronicznym (np. lampie elektronowej, tranzystorze) lub elektrycznym (np.
elektrolizerze) elektroda odprowadzająca ujemne nośniki prądu z obszaru
międzyelektrodowego, połączona z dodatnim biegunem zewnętrznego źródła prądu jest
elektrodą dodatnią
2.2. Katoda
W ogniwie galwanicznym elektroda oddająca elektrony do obszaru
międzyelektrodowego, zachodzi na niej proces redukcji, jest elektrodą dodatnią. W
przyrządzie elektronicznym (np. lampie elektronowej, tranzystorze) lub elektrycznym (np.
elektrolizerze) elektroda doprowadzająca ujemne nośniki prądu do obszaru
międzyelektrodowego, połączona z ujemnym biegunem zewnętrznego źródła prądu - jest
elektrodą ujemną.
2.3. Siła Elektromotoryczna ogniwa - SEM
Siła elektromotoryczna ogniwa, SEM jest to różnica potencjałów dwóch półogniw
otwartego ogniwa elektrochemicznego (przez ogniwo nie płynie prąd, znajduje się ono w
stanie równowagi). Źródłem SEM są reakcje przebiegające w półogniwach (ich suma nosi
nazwę reakcji ogniwa). SEM zależy od aktywności jonowej składników półogniw,
temperatury i ciśnienia. Może być wyliczona z równania Nernsta:
⋅
⋅
⋅
−
=
b
B
a
A
m
M
L
a
a
a
a
F
n
T
R
E
E
1
0
ln
gdzie:
•
E
0
- standardowa SEM ogniwa równa różnicy potencjałów standardowych półogniwa
prawego i lewego,
•
R - stała gazowa,
•
T - temperatura bezwzględna,
•
n - liczba elektronów wymienianych podczas jednego stechiometrycznego przebiegu
reakcji ogniwa,
•
F - stała Faradaya (elektroliza),
•
a
L
, a
M
- aktywności produktów,
•
a
A
, a
B
aktywności substratów,
•
l, m, a, b - wykładniki potęgowe równe współczynnikom stechiometrycznym w
równaniu reakcji ogniwa.
Znak SEM jest dodatni, gdy zapis reakcji ogniwa (a więc i schematu ogniwa) odpowiada jej
samorzutnemu przebiegowi
2.3.1 Potencjał standardowy ogniwa
Potencjał standardowy ogniwa jest to siła elektromotoryczna ogniwa zestawionego z
danego półogniwa, zawierającego jony o jednostkowej aktywności, oraz standardowej
elektrody wodorowej. Stabelaryzowane potencjały standardowe (tabl. 1) umożliwiają
4

obliczenie siły elektromotorycznej dowolnego ogniwa elektrochemicznego oraz
powinowactwa chemicznego reakcji, która w nim zachodzi.
Tabl. 1. Szereg elektrochemiczny
Nazwa pierwiastka Symbol pierwiastka
Potencjał
Reakcja przebiegająca na
elektrodzie
Lit
Li
-3,00V
Li → Li
+
+ e
Rubid
Rb
-2,97V
Rb → Rb
+
+ e
Potas
K
-2,92V
K → K
+
+ e
Rad
Ra
-2,92V
Ra → Ra
2+
+ 2e
Bar
Ba
-2,90V
Ba → Ba
2+
+ 2e
Stront
Sr
-2,89V
Sr → Sr
2+
+ 2e
Wapń
Ca
-2,84V
Ca → Ca
2+
+ 2e
Sód
Na
-2,71V
Na → Na
+
+ e
Lantan
La
-2,52V
La → La
3+
+ 3e
Magnez
Mg
-2,38V
Mg → Mg
2+
+ 2e
Itr
Y
-2,37V
Y → Y
3+
+ 3e
Beryl
Be
-1,70V
Be → Be
2+
+ 2e
Glin
Al
-1,66V
Al → Al
3+
+ 3e
Niob
Nb
-1,1V
Nb → Nb
3+
+ 3e
Mangan
Mn
-1,05V
Mn → Mn
2+
+ 2e
Cynk
Zn
-0,76V
Zn → Zn
2+
+ 2e
Chrom
Cr
-0,71V
Cr → Cr
3+
+ 3e
Gal
Ga
-0,56V
Ga → Ga
3+
+ 3e
Żelazo
Fe
-0,44V
Fe → Fe
2+
+ 2e
Kadm
Cd
-0,40V
Cd → Cd
2+
+ 2e
Tal
Tl
-0,33V
Tl → Tl
+
+ e
Ind
In
-0,33V
In → In
3+
+ 3e
Kobalt
Co
-0,28V
Co → Co
2+
+ 2e
Nikiel
Ni
-0,24V
Ni → Ni
2+
+ 2e
Molibden
Mo
-0,20V
Mo → Mo
3+
+ 3e
Cyna
Sn
-0,14V
Sn → Sn
2+
+ 2e
Ołów
Pb
-0,13V
Pb → Pb
2+
+ 2e
Wodór
H
0V
H
2
→
2H
+
+ 2e
Antymon
Sb
+0,2V
Sb → Sb
3+
+ 3e
Bizmut
Bi
+0,23V
Bi → Bi
3+
+ 3e
Miedź
Cu
+0,37V
Cu → Cu
2+
+ 2e
Ruten
Ru
+0,45V
Ru → Ru
2+
+ 2e
Srebro
Ag
+0,8V
Ag → Ag
+
+ e
Osm
Os
+0,85V
Os → Os
2+
+ 2e
Rtęć
Hg
+0,85V
Hg → Hg
2+
+ 2e
Pallad
Pd
+0,85V
Pd → Pd
2+
+ 2e
Iryd
Ir
+1,15V
Ir → Ir
3+
+ 3e
Platyna
Pt
+1,2V
Pt → Pt
2+
+ 2e
Złoto
Au
+1,42V
Au → Au
3+
+ 3e
5

2.4. Bateria
Bateria, zespół identycznych lub podobnych elementów technicznych:
urządzeń, przyrządów, źródeł energii itp., połączonych w jeden układ i
pracujących jako całość. Dzięki zsumowania efektów działania swych
części składowych pozwala zwiększyć moc, temperaturę, wydajność,
wartość napięcia elektrycznego (np. bateria grzewcza, bateria
koksownicza, bateria akumulatorowa) lub uzyskać inne efekty niemożliwe albo trudne do
osiągnięcia w urządzeniach izolowanych.
2.5. Akumulator
Akumulator, urządzenie
do magazynowania energii. W
fazie
ładowania
jest
przetwornicą energii (np.
prądnicą) gromadzi energię,
którą następnie oddaje, w fazie
rozładowywania, odbiornikowi
(np. latarce). W zależności od
rodzaju magazynowanej energii
rozróżniamy m.in. akumulatory:
bezwładnościowe,
cieplne,
hydrauliczne, pneumatyczne i
najczęściej
stosowane
akumulatory
elektryczne.
Akumulatory łączy się
szeregowo w baterie, by
uzyskać wyższe napięcie
znamionowe. W najczęstszym
użyciu są akumulatory kwasowe
(ołowiowe) i zasadowe
(niklowo-żelazowe, srebrowo-
cynkowe, niklowo-kadmowe). Stosuje się je m. in. do zasilania przenośnej aparatury różnego
typu (np. pomiarowej), silników napędzających wózki elektryczne oraz urządzeń
elektrycznych i elektronicznych w pojazdach.
6
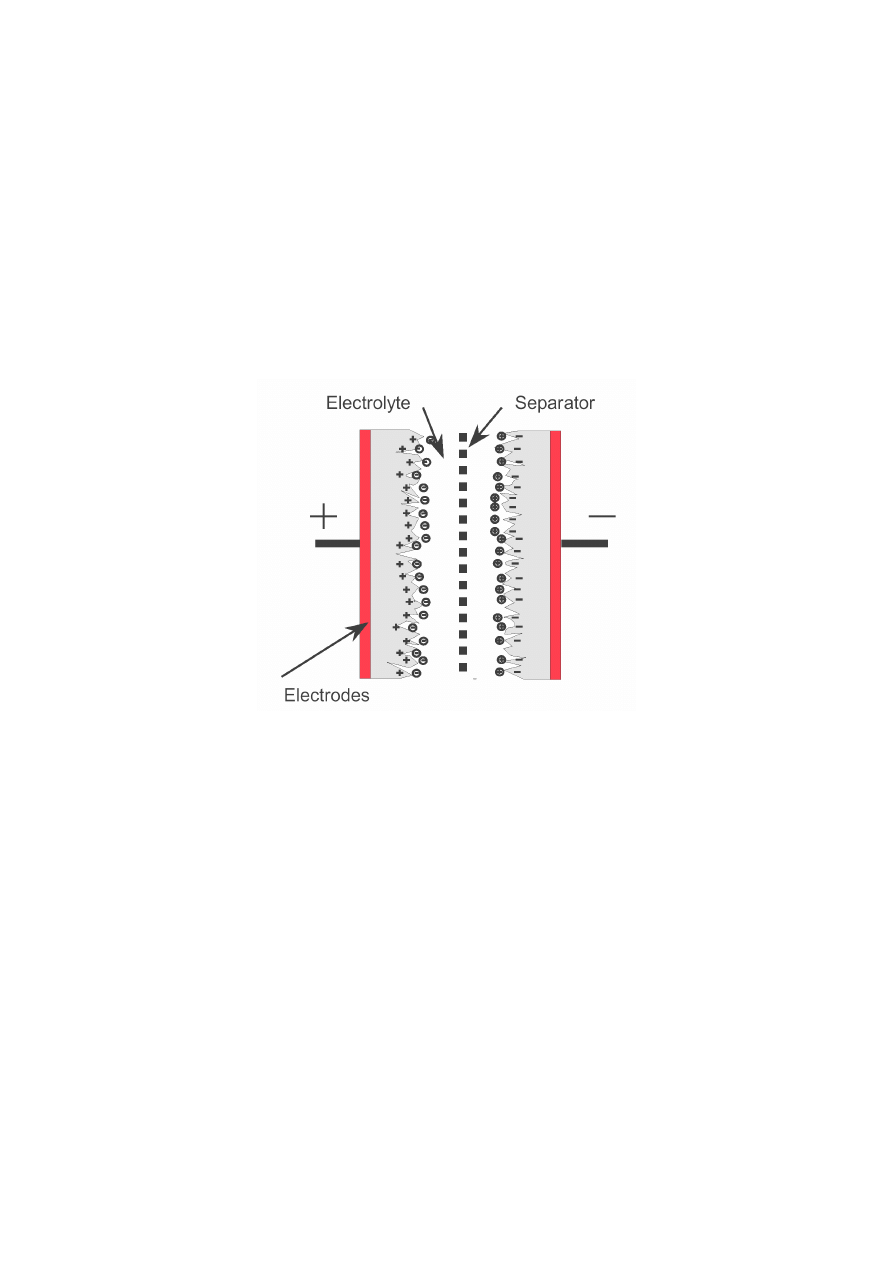
3. Podstawowe rodzaje ogniw
3.1. Ogniwa regenerowane
3.1.1. Superkondensatory
Superkondensator jest kondensatorem elektrolitycznym o pojemności tysięcy faradów.
Oznacza to, że jest w środku wypełniony elektrolitem, pośrodku kondensatora jest
umieszczona specjalna błona odseparowująca obydwie elektrody.
Swoją olbrzymią pojemność zawdzięcza chropowatej budowie ścianki, przez co
zwiększyła się powierzchnia gromadząca ładunek. Schemat budowy superkondensatora
przedstawiono na rys. 1.
Rys. 1. Schemat budowy superkondensatora
Zalety
•
duża pojemność
•
krótki czas ładowania
•
wysoka sprawność
•
duża liczba ładowań
•
prawie natychmiastowe dostarczenie dużej mocy
Wady
•
niskie napięcie
•
skomplikowane układy kontroli ładowania
•
krótki czas podtrzymania ładunku
•
niekorzystna charakterystyka napięciowa
W tabl. 2. umieszczono typowe dane dotyczące superkondensatorów i kondensatorów.
Jak widać nie dorównują one parametrami zwykłam kondensatorom. Jednak dzięki swojej
dużej pojemności superkondensatory znalazły zastosowanie w elektronice, w układach
zasilających napędy, układach podtrzymujących pamięć itp.
7
Tabl. 2. Porównanie superkondensatorów kondensatorów
Kondensatory
Superkondensatory
Gęstość energii
[Wh/kg]
0,1
3
Gęstość mocy
[W/kg]
10
7
3000
Czas ładowania [s]
10
-3
-10
-6
0,3-30
Czas rozładowania
[s]
10
-3
-10
-6
0,3-30
Liczba ładowań
10
10
10
6
Typowy czas
użytkowania [lata]
30
30
Sprawność [%]
>95
85-98
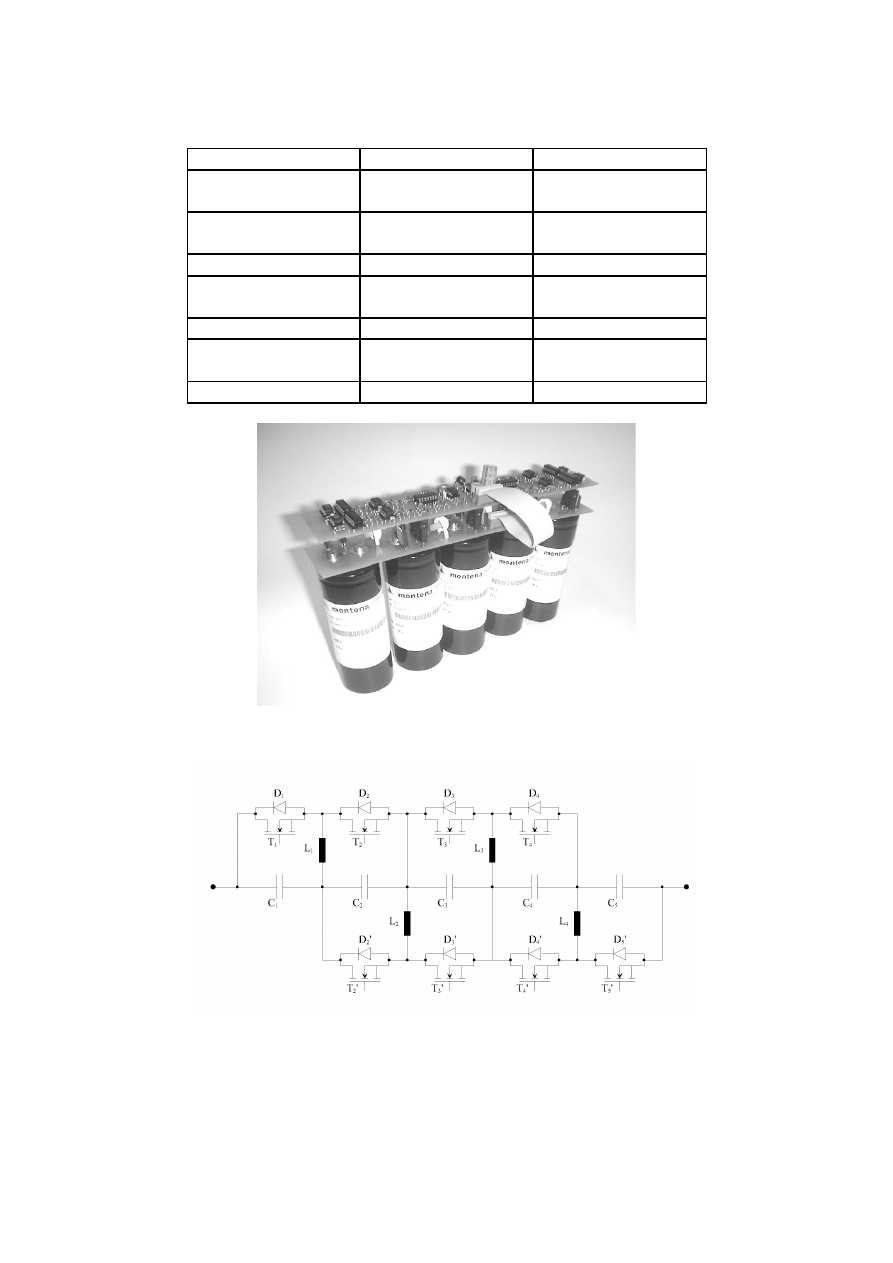
Rys. 2. Bateria superkondensatorów
(4 superkondensatory o pojemności 800 F i jeden 1000 F)
Rys. 3. Schemat baterii superkondensatorów wraz z układem ładowania z rys. 2.
Największą wadą superkondensatorów jest niskie napięcie na zaciskach, wynosi ono
około 2 do 2,5 [V]. Łączy się superkondensatury w szereg, aby uzyskać większe napięcie rys.
2 i 3. Jednak stwarza to problem poprawnego ładowania. Jak widać na rys. 3. każdy
superkondensator ma osobny obwód ładujący.
8

3.1.2. Akumulatory - omówione na przykładzie akumulatora NiMH
Akumulatory NiMH znane są od połowy lat 70. Prace nad ich rozwojem
zintensyfikowano ostatnio, ze względu na wymogi ochrony środowiska, szkodliwość
działania akumulatorów NiCd i możliwość ich zastąpienia przez akumulatory NiMH.
Faktycznie ten typ akumulatorów ma pewne zalety w stosunku do akumulatorów NiCd, ale
również liczne wady. W wielu dzisiejszych urządzeniach będzie można zastąpić szkodliwe
akumulatory NiCd, ale w wielu innych zastosowaniach (np. napędy elektryczne o dużym
chwilowym poborze prądu większym od 5A), gdzie wykorzystuje się charakterystyczne ich
własności, trzeba będzie jeszcze z tym poczekać. NiMH jest akumulatorem
charakteryzującym się najwyższą gęstością energii z ogniw znajdujących się na rynku. Jest to
największa zaleta akumulatora NiMH w porównaniu z NiCd. Zasada działania ogniwa opiera
się na magazynowaniu gazowego wodoru w stopie metalu. Płytka niklowa stanowi elektrodę
dodatnią, a elektrodą ujemną jest specjalny stop metali ziem rzadkich, niklu, magnezu,
manganu, aluminium i kobaltu. Skład procentowy jest pilnie strzeżony przez producentów.
Separator wykonuje się z poliamidu lub polietylenu. Elektrolit jest zasadowy, przy ładowaniu
i rozładowaniu wodór przemieszcza się pomiędzy elektrodami. Zdolność pochłaniania
wodoru przez stop decyduje o pojemności akumulatora.
Akumulatory NiMH posiadają wyższą pojemność w proporcji do objętości niż NiCd.
Oznacza to istnienie większej ilości aktywnej substancji w tej samej objętości. Substancje te
mają, więc mniejszą objętość do rozszerzania się w obudowie i spada szybkość reakcji
fizyko-chemicznych. Następstwem tego NiMH muszą być ładowane wolniej niż NiCd, a
proces ładowania wymaga dokładniejszej kontroli w celu uniknięcia przeładowania. Oba typy
akumulatorów mają napięcie ogniwa 1,2 V. Ładowanie normalne odbywa się w ten sam
sposób, tj. prądem ładowania o wartości ok. 0,1 A w czasie 14 - 16 godzin. Oznacza to, że
również współczynnik ładowania jest taki sam dla obu typów tj. 1,4. Także napięcie ogniwa
wzrasta podobnie i w końcowej fazie ładowania osiąga wynosi 1,45 - 1,5 V. Przy ładowaniu
prądem o wartości (0,2 A nie trzeba żadnej kontroli ładowania, poza pomiarem czasu.
Ładowanie szybkie minimalny czas ładowania akumulatorów NiMH wynosi ok. 1 godziny
(NiCd ok. 15 min.). Dużo szybciej wzrasta w akumulatorach NiMH temperatura, gdy ogniwo
jest bliskie naładowania. Występujące przy tym obniżenie napięcia, jest jednak znacznie
mniejsze, co wymaga dokładniejszego pomiaru przez układ kontrolny. Przy szybkim
ładowaniu NiMH zalecane jest stosowanie, co najmniej dwóch systemów zabezpieczeń. Czas
życia ogniw NiMH wyraźniej się skraca przy przegrzaniu niż NiCd. Zaletą NiMH jest brak
efektu pamięciowego. Ładowanie podtrzymujące niezalecane dla akumulatorów NiMH
cylindrycznych, ponieważ tak jak ładowanie ciągłe obniża żywotność. NiMH wykonane w
formie pastylkowej nie mają takich ograniczeń (podobnie jak NiCd).
Z powodów, jakie podano przy omawianiu ładowania, również maksymalny prąd
rozładowania jest niższy niż w ogniwach NiCd. Zwykle nie zaleca się prądów rozładowania
większych od 3 do 5 A. Natomiast końcowe napięcie dla obu typów jest identyczne i wynosi
ok. 1,0 V. Prąd samorozładowania jest dla NiMH wyższy, ok. 1,5% dziennie, w stosunku do
1,0% dla NiCd. Wynika stąd krótszy czas przechowywania w pełni naładowanego
akumulatora NiMH niż NiCd.
Według danych dostarczonych przez producentów sprzedających swe akumulatory
(NiMH) w Szwecji, czas życia nie powinien być krótszy niż dla NiCd, tzn. ok. 1 000 cykli.
Należy zwrócić uwagę, że liczba ta dotyczy idealnych warunków, np. ładowania z 0,1 A w
czasie 14 godzin i temp. pokojowej przy każdym ładowaniu. Nie wzięto pod uwagę
ewentualnego przeładowania, które może nastąpić i skrócić czas życia. Realna liczba cykli w
normalnych warunkach eksploatacji wynosi prawdopodobnie ok. 500-800.
9

Podsumowując NiMH jest jedynym typem akumulatora, który nie zawiera metali ciężkich,
zanieczyszczających otoczenie i dlatego jest znacznie korzystniejszy dla środowiska niż inne
typy. Stosunek ciężaru do pojemności jest jego kolejną zaletą. Jest to również ogniwo o
największej gęstości energii. Czas życia jest dobry przy pracy pełnymi cyklami ładowania i
rozładowania, ale nie wypada korzystnie przy ładowaniu podtrzymującym. Nie dotyczy to
jednak ogniw pastylkowych, które mają własności takie same, jak ich odpowiedniki NiCd.
Ładowanie wymaga bardziej precyzyjnej kontroli niż dla innych typów akumulatorów.
Podobnie jak w akumulatorach NiCd, parametry ogniwa NiMH zależą od temperatury,
dlatego powinna być bezwzględnie przestrzegana znamionowa temperatura pracy.
3.1.3. Ogniwa paliwowe
Korzeni tej technologii należy się doszukiwać jeszcze w XIX wieku, ale dopiero dziś
zaczyna ona przynosić owoce. Sir William Grove, brytyjski sędzia i uczony skonstruował już
w 1839 roku pierwsze ogniwo paliwowe.
W pierwszym ogniwie paliwowym, jego wynalazca wykorzystywał reakcję łączenia
wodoru z tlenem do bezpośredniego wytwarzania prądu elektrycznego. Ogniwo takie nie ma
części ruchomych, działa bezszumowo, a jego jedyną substancją odpadową jest woda. Wiele
lat potem naukowcy z NASA wykorzystali tę genialnie prostą ideę i rozwinęli technologię do
poziomu umożliwiającego wykorzystanie jej w pojazdach kosmicznych Apollo, Gemini,
Skylab i innych, aby produkować energię elektryczną i wodę pitną. Jeszcze pod koniec lat 80-
tych ogniwa paliwowe lekceważono - z powodu ich wysokiej ceny. Koszt takich urządzeń
był, niestety, astronomiczny i sięgał 100 000 dolarów za kilowat. Teraz sytuacja zmienia się
w szybkim tempie, zwłaszcza dzięki istotnym zaletom ekologicznym. Specjaliści oceniają, że
zastąpienie tradycyjnych metod wytwarzania energii elektrycznej z węgla przez ogniwa
paliwowe powinno zmniejszyć emisję dwutlenku węgla o 40% - 60%, zaś emisję tlenków
azotu o 50% - 90%. Coraz częściej spotyka się informacje o komercyjnych zastosowaniach
ogniw paliwowych, nawet w celach energetycznych. Firma Southern California Gas Co.
opracowała instalacje o mocy 200 kW dla jednego z hoteli, trzech szpitali i paru innych
instytucji publicznych. Ambitne plany przewidują budowę elektrowni o mocy 2 MW.
Największe zainteresowanie przejawia jednak przemysł motoryzacyjny (rys. 4.), a jest
to spowodowane dwoma czynnikami: dążeniem do zwiększania sprawności napędu oraz
wymuszanym przez ekologię ograniczaniem emisji zanieczyszczeń do środowiska
naturalnego, w którym żyjemy. Specjaliści renomowanego amerykańskiego Instytutu
Energetyki EPRI (Electric Power Research Institute) twierdzą, że nie ma drugiej, równie
czystej technologii jak ogniwa paliwowe. W zasadzie jest to "czarna skrzynka", do której z
jednej strony doprowadza się paliwo, a z drugiej uzyskuje prąd elektryczny - przy wysokim
współczynniku sprawności wykorzystania paliwa i nikłej emisji zanieczyszczeń. Jako paliwo
najprościej byłoby wykorzystywać wodór, ale lepiej używać gazu ziemnego, którego
głównym składnikiem (około 90%) jest metan CH4, zaś najbezpieczniej - metanolu CH3OH.
10
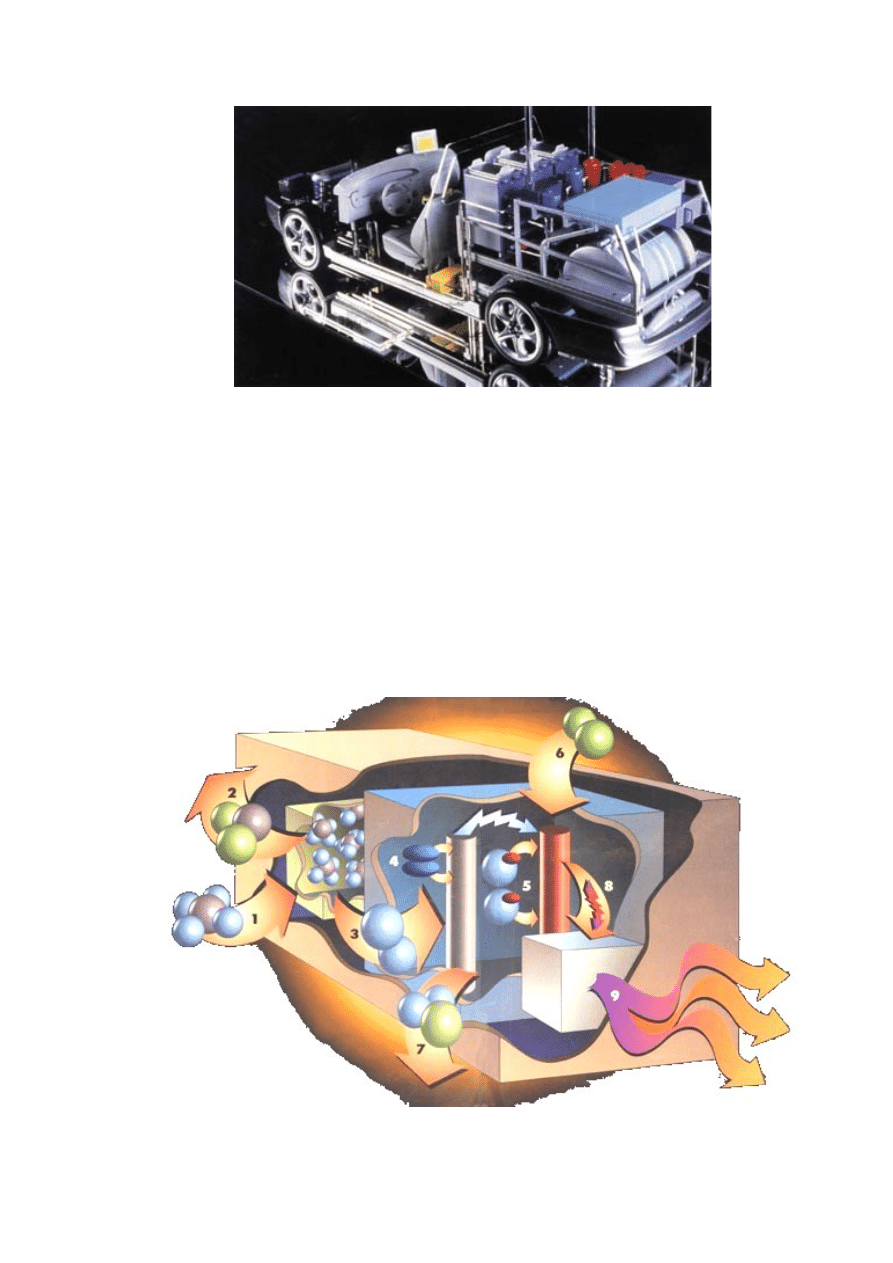
Rys. 4. Prototyp samochodu zasilany wodorowym ogniwem paliwowym
Zarówno zwykłe baterie elektryczne, jak i ogniwa paliwowe wytwarzają prąd
elektryczny dzięki reakcjom elektrochemicznym. W ogniwie paliwowym (rys. 5.), zasilanym
gazem ziemnym, cały proces zaczyna się od wydzielania czystego wodoru w urządzeniu
zwanym reformerem (1). Powstający przy tym dwutlenek węgla (2) jest usuwany na
zewnątrz. Podobnie jest w przypadku stosowania metanolu. Następnie wodór trafia do
właściwego ogniwa (3), wywołując kolejne reakcje chemiczne: platynowy katalizator na
anodzie "wyrywa" z gazu elektrony (4), a dodatnio naładowane jony (protony) "rozpuszczają
się" w elektrolicie (5). Obojętny elektrycznie tlen, doprowadzany do katody (6) przechwytuje
swobodne elektrony powodując powstanie prądu stałego (8). Ujemnie naładowane jony tlenu
reagują w elektrolicie z protonami również znajdującymi się w elektrolicie, wytwarzając
wodę (7). Powstający stały prąd elektryczny zostaje w przetwornicy przekształcony na prąd
zmienny (9), z którego łatwiej można korzystać. Jak długo do właściwego ogniwa
paliwowego dopływa wodór i tlen, tak długo wytwarza ono prąd elektryczny, ciepło i wodę.
Rys. 5. Zasada działania ogniwa paliwowego
11
Siła elektromotoryczna pojedynczego ogniwa wynosi około 1 wolta, lub mniej, a
natężenie prądu elektrycznego w obwodzie zależy od powierzchni elektrod. Napięcie można
zwiększać łącząc ze sobą szeregowo wiele takich ogniw - jak plastry wafli przekładanych
nieprzepuszczalnymi dla elektrolitu, lecz przewodzącymi prąd elektryczny, membranami -
zwiększając w ten sposób ich wydajność. Stos kilku niewielkich ogniw może dostarczyć moc
paru watów, zaś wiele ogniw o powierzchni metra kwadratowego jest w stanie generować
setki kilowatów. Istnieje wiele typów ogniw paliwowych, różniących się między sobą
konstrukcją, materiałem elektrod, rodzajem elektrolitu i katalizatorów. Przykładowe
porównanie zamieszczono w tabl. 3.
Tabl. 3. Porównanie różnych typów ogniw paliwowych
Elektrolit
stałe tlenki
membrama
PEM
kwas
Fosforowy
ciekły węglan
MCFC
Temp. pracy
800°C -1000°C 80 °C
200 °C
650 °C
Nośnik ładunku
jon tlenu
jon wodoru
jon wodoru
jon wodoru
Reformer
wewnętrzny
wewnętrzny
wewnętrzny
wewnętrzny
Podstawowe
składniki ogniwa
materiały
ceramiczne
na bazie węgla na bazie węgla na bazie węgla
Katalizator
perowskit
platyna
platyna
nikiel
Sprawność
ponad 60%
40-50 %
40-50%
ponad 60%
Stan opracowania do 100kW
50kW
11MW
2MW
W ogniwach wytwarzających energię elektryczną i wodę, przeznaczonych dla promów
kosmicznych, NASA stosuje np. wodorotlenek potasu. Ale najbardziej uniwersalnymi i
niezawodnymi urządzeniami, mającymi za sobą dorobek długotrwałych prac badawczo-
rozwojowych, są ogniwa wykorzystujące kwas fosforowy oraz ogniwa z membranami
polimerowymi.
Wizja sprawnych, praktycznych aut z napędem elektrycznym kusiła producentów
samochodów od dziesięcioleci. Trwa wyścig technologów, opracowujących akumulatory
elektryczne o możliwie dużym stosunku zapasu energii do masy. Dużym sukcesem jest
opracowanie baterii litowo-jonowych, mających pojemność trzykrotnie większą od
akumulatorów klasycznych przy tej samej masie - wynoszącą 120 Wh/kg. Jednakże bardziej
atrakcyjne od takich akumulatorów są ogniwa paliwowe, których nie trzeba długo
doładowywać, a wystarczy tylko uzupełniać zapas paliwa, co trwa znacznie krócej. Ponieważ
bezpośrednie operowanie wodorem jest bardzo niebezpieczne konstruktorzy zdecydowali się
jako źródło wodoru wykorzystać metanol. Reakcja w ogniwie paliwowym zachodzi w
temperaturze 80 - 90 stopni Celsjusza przy ciśnieniu 3,0 bar. Ogniwo paliwowe wspomagane
jest baterią akumulatorową, składającą się z 44 ogniw NiMH połączonych szeregowo. Realnie
patrząc możemy się spodziewać, że pierwsze modele pojazdów z tym nowoczesnym źródłem
energii wejdą do produkcji w latach 2002 - 2005, ponieważ wiele zagadnień technicznych i
technologicznych wymaga jeszcze dopracowania. Ale warto, ponieważ - poza oczywistymi
zaletami, jeśli chodzi o ochronę środowiska - ogniwa paliwowe umożliwią zmniejszenie
zapotrzebowania na ropę naftową. Poza tym ogólna sprawność samochodów z ogniwami
12

paliwowymi oscyluje wokół 30%, podczas gdy w przypadku pojazdów z silnikami
spalinowymi sprawność ta nie przekracza kilkunastu procent (zwykle około 10%).
Technologowie myślą też o miniaturyzacji ogniw PFM. Firma H-Power z New Jersey
opracowuje 25-watowe baterie NoCad VidPack, mające zastąpić baterie niklowo-kadmowe
używane w wideo-kamerach. Źródłem paliwa ma być mały patron ze sprężonym wodorem,
wystarczający na 2 godziny pracy kamery. Firma pracuje również nad zasilaczem PEM dla
laptopów, nie większym od konwencjonalnej baterii i umożliwiającym 16 godzin pracy oraz
nad czujką dymu o żywotności 20 lat. W poszukiwaniu mocniejszych i trwalszych źródeł
energii elektrycznej naukowcy sięgają po mniej znane i mało opanowane rozwiązania ogniw
paliwowych ze stopionymi węglanami i zestalonymi tlenkami. Oba rodzaje mają przetwarzać
paliwo na prąd elektryczny ze sprawnością 50% - 60%. Ogniwa te charakteryzują się wysoką
temperaturą pracy: ogniwa ze stopionymi węglanami pracują w temperaturze 650 stopni
Celsjusza, a ogniwa tlenkowe w temperaturze zbliżonej do 1000 stopni Celsjusza. Oznacza to,
że powstająca jako produkt uboczny woda ma postać pary przegrzanej, którą można
wykorzystywać do napędzania konwencjonalnej turbiny parowej z dodatkowym generatorem
elektrycznym, albo do grzania wody. Wysoka temperatura pracy umożliwia też bezpośrednie
wykorzystywanie gazu ziemnego jako paliwa (zamiast czystego wodoru). Firma Energy
Research Corp. uruchomiła już zestaw o mocy 70 kW, składający się z 234 ogniw
paliwowych ze stopionym węglanem, i miała zbudować elektrownię o mocy 2 MW dla miasta
Santa Clara. Sukces tego przedsięwzięcia mógłby zaowocować zamówieniem na 50
podobnych bloków. Ogromne zainteresowanie wzbudzają ogniwa paliwowe z zestalonym
tlenkiem, których technologia jest najtrudniejsza, ale osiągi są niezwykle obiecujące.
Przewiduje się, że tego rodzaju ogniwa znajdą zastosowanie w dużych, przemysłowych
zakładach energetycznych, lub statkach transoceanicznych. Inny, prostszy pomysł na
tlenkowe ogniwa paliwowe ma mała, młoda firma ZTEC, z Massachussetts. Zamiast rur
ZTEC zaprasowuje elektrody z elektrolitem w postaci płaskiego, sztywnego dysku. Stos 16-tu
takich ogniw ma zaledwie jeden cal wysokości (2,54 cm). Setki takich ogniw upakowane
razem w sztywnej obudowie, mającej postać litery U, tworzy podstawowy blok o mocy 25
kW. Takie rozwiązanie konstrukcyjne umożliwia szybkie uruchamianie i skuteczne
odprowadzanie ciepła. Konstruktorzy przewidują, że elektrownia z ogniwami paliwowymi o
mocy 2,5 MW zmieści się na 18-kołowej przyczepie, którą będzie można łatwo przewieźć w
potrzebne miejsce. Do jej pracy wystarczy otaczające urządzenie powietrze i rurociąg
doprowadzający gaz ziemny, a powstająca para będzie napędzać turbogenerator. Pozostają
jednak problemy związane ze starzeniem się ogniw paliwowych. Zanieczyszczenia zawarte w
paliwie powodują stopniowe zatykanie porowatych elektrod, co nieuchronnie ogranicza
przepływ jonów wodoru i tlenu, zmniejszając wydajność prądową. Konstruktorzy starają się
stworzyć zestawy o żywotności nie mniejszej niż 40 000 godzin (co będzie oznaczało
konieczność wymiany całego bloku co 5 - 7 lat). Ważnym czynnikiem ograniczającym rozwój
tej nowoczesnej technologii jest nieubłagana ekonomia. Budowa konwencjonalnej elektrowni
jest znacznie tańsza od obiektu z ogniwami paliwowymi. A bez zamówień na ogniwa
paliwowe producenci nie mogą uruchomić ich masowej, a więc tańszej i zautomatyzowanej
produkcji. Zainteresowane firmy szacują, że uruchomienie produkcji ogniw o łącznej mocy
200 MW rocznie pozwoliłoby obniżyć ich cenę detaliczną o połowę. Warto sobie
uświadomić, jak ogromnych środków wymaga usuwanie tlenków siarki i azotu ze spalin w
elektrowniach konwencjonalnych. Ogniwa paliwowe takich zanieczyszczeń nie wytwarzają w
ogóle, a emisja tlenku węgla jest niższa od jego zawartości w powietrzu atmosferycznym.
Może, więc inwestorom bardziej opłacałoby się inwestować w dopracowanie technologii i
uruchomienie masowej produkcji ogniw paliwowych, aniżeli przeznaczać ogromne środki na
dopracowywanie starych i opracowywanie wciąż nowych metod oczyszczania spalin w
elektrowniach konwencjonalnych. Ogniwa paliwowe mają jeszcze jedną cechę, którą trudno
13

uwzględniać podczas chłodnych kalkulacji kosztów i korzyści: jest to praktyczne rozwiązanie
pobudzające naszą wyobraźnię. Wielu specjalistów widzi w nich jeszcze jedno ważne,
ekologicznie czyste źródło energii w XXI wieku.
3.1.4. Baterie słoneczne
Rys. 6. Przykładowa bateria słoneczna o mocy 120W
Ogniwa słoneczne przetwarzają światło na energię elektryczną. Ogniwo słoneczne
może być produkowane z wielu różnych pierwiastków, ale najczęściej używanym jest krzem.
Mówi się o ogniwach pojedynczych (monokrystalicznych), wielokrystalicznych
(polikrystalicznych) albo cienkowarstwowych (amorficznych). Różnica między ogniwem
mono- i polikrystalicznym nie jest zbyt duża, właściwie chodzi o różny sposób produkcji
materiału bazowego ogniwa. Dzięki jednolitemu materiałowi ogniwo monokrystaliczne ma
nieco wyższą sprawność, tzn, że wytwarza nieco więcej energii na jednostkę powierzchni, niż
ogniwo polikrystaliczne. Różnica jest jednak niewielka, 12-15% dla monokrystalicznego i 10-
14 % dla polikrystalicznego. Zwykłe ogniwo słoneczne z krystalicznego krzemu o wymiarach
ok. 10 x 10 cm ma nominalne napięcie ok. 0,5 V. Poprzez połączenie szeregowe ogniw
słonecznych, można otrzymać tzw. baterie słoneczne. Istnieją baterie z różną ilością ogniw, w
zależności od zastosowania, jak i od jakości ogniw. Bateria słoneczna, która będzie używana
do ładowania baterii ołowiowych na naszej długości i szerokości geograficznej, potrzebuje
conajmniej 30 ogniw, jeśli chodzi o monokrystaliczne, i 32 ogniwa, jeżeli chodzi o ogniwa
polikrystaliczne. Przy wzrastającej temperaturze napięcie ogniwa spada, co oznacza, że może
być potrzebna bateria z jeszcze większą ilością ogniw ( o ile jest bardzo gorąco w miejscu,
gdzie będzie ona zainstalowana). Zwykła bateria składająca się z 30-32 ogniw ma
maksymalną moc rzędu 40-45 W. Inne wielkości można otrzymać poprzez albo dołożenie
większej ilości ogniw, albo poprzez podział ogniwa na mniejsze części. Jest to jednak dość
drogie, ponieważ wymaga dodatkowych zabiegów w procesie produkcji. Technika
cienkowarstwowa oferuje bardzo wiele zalet z punktu widzenia możliwości produkcyjnych,
ponieważ można bardzo dokładnie określić charakterystykę poprzez ułożenie wzoru połączeń
w specjalny sposób. Bateria cienkowarstowa produkowana jest w ten sposób, że nakłada się
cienką warstwę aktywnego materiału na specjalnie przygotowaną szybę ze szkła. Następnie
można przy pomocy lasera wycinać ogniwa w pożądanych wielkościach i ilościach. Niestety
sprawność tego typu ogniw jest znacznie niższa niż ogniw krystalicznych, ale do prostych
zastosowań, np. do zasilania kalkulatorów, ten typ stał się bardzo powszechny. Standardowa
bateria cienkowarstwowa do ładowania akumulatorów ma zazwyczaj moc ok. 10 W. Baterii
słonecznych używa się normalnie do ładowania akumulatorów lub do bezpośredniego
14

zasilania jakiegoś rodzaju urządzeń np. pompy wodnej, wentylatora itp. Do ładowania
akumulatora buduje się system złożony z jednego lub wielu paneli słonecznych i regulatora
ładującego tak, aby akumulator mógł być maksymalnie ładowany, jak również zabezpieczony
od przeładowania i szkodliwego głębokiego rozładowania. Akumulatory mogą być różnych
typów. Zwykły typ akumulatora samochodowego nie jest odpowiedni, ze względu na to, że
jest skonstruowany tak, żeby oddawać dużo energii w ograniczonym czasie, a nie do tego, aby
dawać mniejsze ilości energii w dłuższym czasie, co ma zazwyczaj miejsce tam, gdzie mamy
do czynienia z urządzeniami słonecznymi. Do tego celu doskonale nadają się akumulatory
ogólnego przeznaczenia, np. takie jak stosowane w układach podtrzymywania zasilania.
Baterie słoneczne powinny być montowane w ten sposób, aby były maksymalnie
wyeksponowane do światła. Moc wyjściowa jest wprost proporcjonalna do ilości energii
odbieranej z baterii. Kierunek ustawienia powinno się wybierać pomiędzy południowym
wschodem i południowym zachodem, a miejsce powinno być nieocienione. Panele
krystaliczne są szczególnie wrażliwe na zaciemnienie i nawet jeżeli jedno ogniwo w baterii
jest zacienione traci się dużą część energii. Półcień nie jest tak niebezpieczny, jak całkowite
zacienienie. Kąt ustawienia w kierunku słońca ma również znaczenie. W czasie półrocza
zimowego jest ważne, aby panel był ustawiony pod kątem prostym do promieni słonecznych,
podczas gdy w letniej porze roku wystarczy kąt 30-45 stopni. Bateria słoneczna produkuje
energię również wówczas, gdy słońce jest za chmurami, lecz oczywiście energia, która jest
produkowana jest zależna od natężenia promieniowania świetlnego. W słoneczny, letni dzień
w Szwecji napromieniowanie wynosi aż do 1000 W/m2 i w tym czasie można ładować
akumulator maksymalnie prądem 3 A, o ile oczywiście jest on już w pełni naładowany. W
pochmurny, letni dzień napromieniowanie może wynieść tylko ok. 200 W/m2 i wówczas prąd
nie będzie większy niż ok. 0,5 A. Według badań amerykańskich energia fotoelektryczna jest
jeszcze 10 - krotnie droższa niż energia jądrowa. Należy jednak uwzględnić, że ogniwa
słoneczne tanieją a koszty pozyskiwania energii w elektrowniach jądrowych drożeje. Obecnie
koszt jednostki energii z układów fotowoltaicznych wynosi 0,6 ECU/kW*h(1992), a
przewiduje się spadek do 0,3 ECU/kW*h w 2000r. Koszt zainstalowania systemu
fotowoltaicznego wynosi 3 ECU/W (w szczycie przy napromieniowaniu 1000 W/m2 dla
modułów krzemowych monokrystalicznych przy sprawności 13% i trwałości 20 lat). Dla
ogniw cienkowarstwowych polikrystalicznych koszt zainstalowania wynosi 2,1 ECU/W (przy
sprawności 5%). Przewiduje się szybka obniżkę kosztów już do 2000 roku.
3.2. Ogniwa nieregenerowane
3.2.1. Baterie węglowe i litowe
Ogniwo Leclanchego
Opracowane zostało, w 1877 r. przez francuskiego chemika G. Leclanchego SEM
1,5[v] Budowa dodatnią elektrodę stanowi węgiel a ujemną – cynk, elektrolitem jest 20%
roztwór, NH
4
Cl. Depolaryzatorem jest MnO
2
, który otacza elektrodę węglową w postaci
sproszkowanej elektrolit zmieszany jest z trocinami i mąką tworząc ciasto wypełniające
ujemną elektrodę, którą jest cynkowy kubeczek. Ogniwo to jest ogniwem nieregenerowlanym
występuje w postaci suchej (najbardziej rozpowszechnionej) i mokrej jako depolaryzator
występuje dwutlenek manganu w formie warstw materiału utleniającego wodór
Zastosowanie suchego ogniwa jest bardzo powszechne. Ogniwo to spotykamy w
handlu jako popularne bateryjki do drobnego sprzętu elektronicznego: piloty do TV,
walkmany, zegarki, latarki itp.
Ogniwo litowe
15
Ilość energii, jaką można uzyskać z konkretnego ogniwa zależy od ilości
wprowadzonych do obudowy zewnętrznej materiałów elektrodowych, czyli substratów
reakcji. Wielkość tę nazywamy energią ogniwa, e, zaś energię, jaką możemy uzyskać z
jednostki masy materiałów elektrodowych, nazywamy energią właściwą ogniwa, ew,
wyrażaną w watogodzinach na kilogram sumy mas materiałów elektrodowych. Energię
właściwą rozpatrujemy w dwóch kategoriach: jako energię teoretyczną e
WT
jako energię
praktyczną, e
WP
Energia właściwa teoretyczna opisywana jest przez wzór e
WT
= DG
0
/(m
an
+
m
kat
) [Wh] gdzie m
an
i m
kat
są masami materiału anodowego i katodowego.
Przykładowo, energia właściwa klasycznego wodnego ogniwa Leclanchego,
Zn/MnO2, wynosi 393 Wh/kg i SEM=1,5V. Dla ogniw drugiej generacji, litowych, gdzie
materiałem anodowym jest lit metaliczny, przy wyborze reakcji: 2Li0 + CuS --> Cu0 + Li
2
S i
układzie elektrodowym Li/CuS, uzyskujemy energię właściwąeWT = 1090 Wh/kg Inne
przykładowe układy:Li/MnO
2
: e
WT
= 1260 Wh/kgLi/SOCl
2
: e
WT
= 1876 Wh/kg
Wartości energetyczne są wielokrotnie wyższe od ogniwa Leclanchego, stąd nazwa
wysokoenergetyczne ogniwa litowe
3.2.2. Baterie atomowe
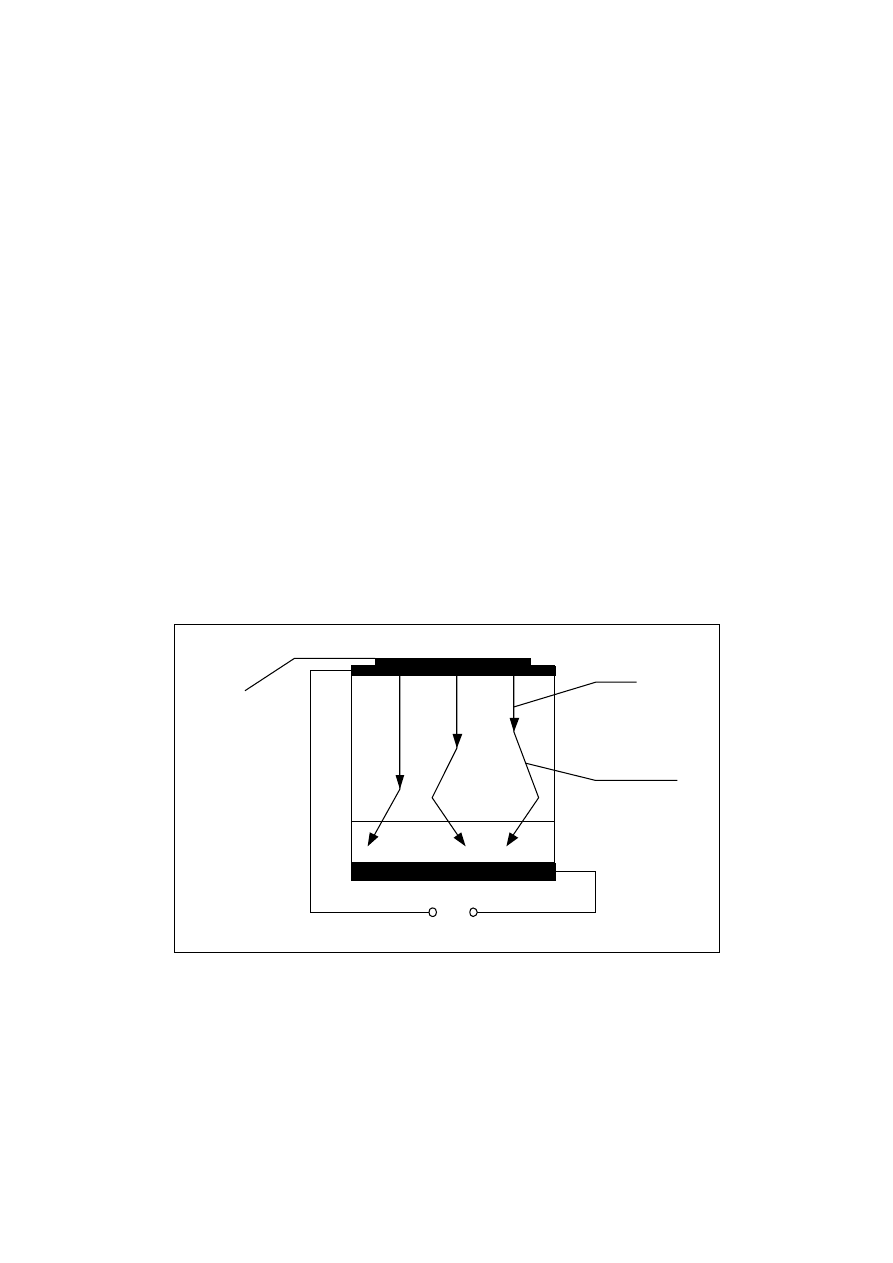
Na rys. 7.
pokazano schemat konstrukcyjny baterii atomowej, w której dokonuje się
zamiana energii promieniowania jądrowego na energię prądu elektrycznego. Zasada działania
baterii atomowej jest podobna do zasady działania fotoogniwa. Jeżeli germanowe lub
krzemowe złącze p-n jest poddane działania promieniowania jądrowego, to powstają w nim
pary elektronowo-dziurowe, które ulegają rozdzieleniu pod wpływem napięcia kontaktowego
i dyfundują, w wyniku czego złącze staje się źródłem prądu o natężeni rzędu 10
-8
A.
Q
S
(
3URP LHQLRZ DQLH
SLHUZ RW
QH
3URP LHQLRZ DQLH
UR] SURV] RQH
ħ UyGáR
SURP LHQLRZ DQLD
MąGURZ HJ R
QS
6U
Rys. 7. Schemat ideowy konstrukcji baterii atomowej
16

Bibliografia
http://www.oeiizk.edu.pl/chemia/ogniwa
http://www.solaris.polbox.pl/
http://www.avt.com.pl/
http://www.encyklopedia.pl
http://www.chemia.px.pl
http://physics.uwb.edu.pl/
http://www.kodron.com.pl
http://www.modelarstwo.kk.opole.pl
http://www.int.pan.wroc.pl
http://www.sggw.waw.pl/~kozlowska
http://www.uni.opole.pl
http://www.chem.uni.wroc.pl
http://www.chem.uw.edu.pl
http://friko6.onet.pl/wa/ingako
17
Document Outline
Wyszukiwarka
Podobne podstrony:
PR ETI W 21 1
PR ETI W 14 4 4
PR ETI W 14 6 1
PR ETI W 14 3 1
PR ETI W 3 4 3 5
PR ETI W 2
PR ETI W 1 4
PR ETI W 1 3
PR ETI W 14 8 1
PR ETI W 1 3
PR ETI W 25 6
PR ETI W 22 1
serwis pr, ETI SUM, sem 1
PR ETI W 3 1 3 3 3
PR ETI W 23 2 id 382135 Nieznany
PR ETI W 11 id 382128 Nieznany
PR ETI W 14 5 1
PR ETI W 9 id 382139 Nieznany
więcej podobnych podstron