
Podstawy biochemii
dla ratownictwa medycznego
z elementami patobiochemii
stanów nagłych
pod redakcją
Ewy Birkner i Sławomira Kasperczyka
ŚLĄSKI UNIWERSYTET MEDYCZNY W KATOWICACH


Podstawy biochemii dla ratownictwa medycznego
z elementami patobiochemii stanów nagłych


AUTORZY
Prof. dr hab. n. med. Ewa Birkner
Dr n. med. Iwona Błaszczyk
Dr n. med. Urszula Błaszczyk
Dr n. med. Aleksandra Kasperczyk
Dr hab. n. med. Sławomir Kasperczyk
Dr n. med. Alina Ostałowska
Dr n. med. Ewa Romuk
Dr n. med. Bronisława Skrzep-Poloczek
Dr n. med. Jolanta Zalejska-Fiolka


Podstawy biochemii
dla ratownictwa medycznego
z elementami patobiochemii
stanów nagłych
pod redakcją
Ewy Birkner i Sławomira Kasperczyka
ŚLĄSKI UNIWERSYTET MEDYCZNY W KATOWICACH


Recenzent
Prof. dr hab. n. med. Krzysztof SOBOLEWSKI
Redakcja
Teresa BIAŁEK
© Copyright by Śląski Uniwersytet Medyczny
Katowice 2011
Wszelkie prawa zastrzeżone
Dzieło może być wykorzystywane tylko na użytek własny,
do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja,
redystrybucja lub odsprzedaż
Wydanie I
ISBN 978-83-7509-162-5
Skład komputerowy i łamanie
Wydawnictwo Uczelni
ul. Medyków 12
40-752 Katowice


SPIS TREŚCI
PRZEDMOWA ...................................................................................................................................................... 9
SPIS SKRÓTÓW ................................................................................................................................................... 10
CZĘŚĆ I.
ZARYS PRZEMIAN BIOCHEMICZNYCH ................................................................................. 11
1. PODSTAWY PRZEMIAN METABOLICZNYCH USTROJU (Sławomir Kasperczyk, Ewa Birkner) ... 11
1.1. Przemiany kataboliczne ...................................................................................................................... 11
1.2. Łańcuch oddechowy.............................................................................................................................. 12
1.3. Cykl Krebsa .......................................................................................................................................... 15
1.4. Łączność cyklu Krebsa z innymi przemianami ................................................................................... 16
2. BIAŁKA (Ewa Birkner, Aleksandra Kasperczyk).............................................................................................. 18
2.1. Budowa aminokwasów i białek ........................................................................................................... 18
2.2. Rola aminokwasów i białek ................................................................................................................ 19
2.3. Trawienie białek i enzymy proteolityczne .......................................................................................... 20
2.4. Czynniki regulujące metabolizm białkowy ......................................................................................... 22
2.5. Metabolizm aminokwasów ................................................................................................................. 22
2.6. Przemiany aminokwasów .................................................................................................................... 25
3. CUKRY I ALKOHOLE (Sławomir Kasperczyk, Alina Ostałowska) ............................................................ 28
3.1. Budowa i rola cukrów ......................................................................................................................... 28
3.2. Trawienie, wchłanianie i transport cukrów ......................................................................................... 29
3.3. Przemiany cukrów ............................................................................................................................... 30
3.3.1. Glikoliza ................................................................................................................................... 30
3.3.2. Glukoneogeneza ....................................................................................................................... 32
3.3.3. Metabolizm glikogenu .............................................................................................................. 32
3.3.4. Szlak pentozofosforanowy ........................................................................................................ 32
3.3.5. Przemiany fruktozy i galaktozy ................................................................................................ 32
3.4. Homeostaza glukozy ........................................................................................................................... 33
3.5. Hipoglikemia ....................................................................................................................................... 33
3.6. Hiperglikemia i cukrzyca .................................................................................................................... 33
3.7. Metabolizm alkoholi (etanolu) ............................................................................................................ 34
4. TŁUSZCZE I CHOLESTEROL (Ewa Romuk, Bronisława Skrzep-Poloczek) ............................................. 36
4.1. Budowa i rola tłuszczów ..................................................................................................................... 36
4.2. Trawienie, wchłanianie i transport tłuszczów ..................................................................................... 37
4.3. Metabolizm tłuszczów ........................................................................................................................ 37
4.3.1. Przemiany tłuszczów ................................................................................................................ 37
4.3.2. Utlenianie kwasów tłuszczowych ............................................................................................. 37
4.3.3. Biosynteza kwasów tłuszczowych (lipogeneza) ....................................................................... 39
4.3.4. Ketogeneza ............................................................................................................................... 39
4.4. Budowa i rola lipoprotein .................................................................................................................... 40
4.4.1. Chylomikrony ........................................................................................................................... 41
4.4.2. Lipoproteiny o bardzo małej i pośredniej gęstości – VLDL oraz IDL ..................................... 41
4.4.3. Lipoproteiny o małej gęstości – LDL ....................................................................................... 41
4.4.3. Lipoproteiny o dużej gęstości – HDL ....................................................................................... 42
4.5. Biosynteza i przemiany cholesterolu ................................................................................................... 42
4.6. Zaburzenia gospodarki lipoprotein ...................................................................................................... 43
4.7. Zaburzenia biochemiczne w miażdżycy .............................................................................................. 43
5. KWASY NUKLEINOWE I BIOSYNTEZA BIAŁKA (Aleksandra Kasperczyk) ...................................... 44
5.1. Budowa kwasów nukleinowych .......................................................................................................... 44
5.2. Rodzaje DNA ...................................................................................................................................... 45
5.3. Rodzaje RNA ...................................................................................................................................... 45
5.4. Biosynteza i degradacja puryn i pirymidyn ......................................................................................... 46
5.4.1. Biosynteza pirymidyn ............................................................................................................... 46

Spis treści
6
5.4.2. Biosynteza puryn ...................................................................................................................... 46
5.4.3. Degradacja pirymidyn ............................................................................................................... 47
5.4.4. Degradacja puryn ...................................................................................................................... 47
5.5. Replikacja DNA .................................................................................................................................. 47
5.5.1. Inicjacja replikacji .................................................................................................................... 48
5.5.2. Elongacja replikacji .................................................................................................................. 48
5.5.3. Terminacja replikacji ................................................................................................................ 49
5.6. Transkrypcja ........................................................................................................................................ 49
5.6.1. Inicjacja .................................................................................................................................... 49
5.6.2. Elongacja transkrypcji .............................................................................................................. 49
5.6.3. Terminacja transkrypcji ............................................................................................................ 49
5.6.4. Dojrzewanie RNA u eukariota .................................................................................................. 50
5.7. Translacja – biosynteza białka ............................................................................................................ 50
5.8. Hamowanie biosyntezy białka ............................................................................................................ 50
5.9. Kod genetyczny ................................................................................................................................... 51
6. HEMOGLOBINA I BARWNIKI ŻÓŁCIOWE (Iwona Błaszczyk) ............................................................. 53
6.1. Erytrocyty ............................................................................................................................................ 53
6.2. Budowa hemoglobiny ......................................................................................................................... 53
6.3. Biosynteza hemu i globiny .................................................................................................................. 54
6.4. Rola hemoglobiny ............................................................................................................................... 54
6.5. Pochodne hemoglobiny ....................................................................................................................... 55
6.5.1. Karboksyhemoglobina .............................................................................................................. 55
6.5.2. Methemoglobina ....................................................................................................................... 55
6.5.3. Cyjanomethemoglobina ............................................................................................................ 55
6.5.4. Sulfohemoglobina ..................................................................................................................... 55
6.6. Hemoglobiny patologiczne ................................................................................................................. 55
6.7. Powstawanie barwników żółciowych ................................................................................................. 55
6.8. Żółtaczki ............................................................................................................................................. 56
6.8.1. Żółtaczka hemolityczna ............................................................................................................ 57
6.8.2. Żółtaczka zastoinowa ................................................................................................................ 57
6.8.3. Żółtaczka miąższowa ................................................................................................................ 57
CZĘŚĆ II. PODSTAWY REGULACJI METABOLICZNYCH ................................................................... 59
7. HORMONY (Alina Ostałowska, Ewa Birkner) ................................................................................................ 59
7.1. Funkcje i działanie hormonów ............................................................................................................ 59
7.2. Podział hormonów .............................................................................................................................. 60
7.2.1. Podział hormonów ze względu na rodzaj działania .................................................................. 60
7.2.2. Podział hormonów ze względu na budowę ............................................................................... 60
7.2.3. Podział hormonów ze względu na mechanizm działania .......................................................... 60
7.2.4. Podział hormonów ze względu na miejsce powstawania .......................................................... 61
7.2.5. Podział hormonów ze względu na częstotliwość wydzielania .................................................. 61
7.2.6. Podział hormonów ze względu na zasięg działania .................................................................. 61
7.3. Charakterystyka wybranych hormonów .............................................................................................. 62
7.3.1. Hormon antydiuretyczny (wazopresyna, ADH) ....................................................................... 62
7.3.2. Oksytocyna ............................................................................................................................... 62
7.3.3. Hormon wzrostu (GH) .............................................................................................................. 62
7.3.4. Prolaktyna (PRL, hormon laktogeniczny) ................................................................................ 62
7.3.5. Tyroksyna (T
4
) i trijodotyronina (T
3
) ........................................................................................ 62
7.3.6. Kalcytonina ............................................................................................................................... 63
7.3.7. Parathormon (PTH) .................................................................................................................. 63
7.3.8. Insulina ..................................................................................................................................... 63
7.3.9. Glukagon .................................................................................................................................. 63
7.3.10. Adrenalina (epinefryna) .......................................................................................................... 64
7.3.11. Glukokortykoidy (glukokortykosteroidy) ............................................................................... 64
7.3.12. Mineralokortykoidy (mineralokortykosteroidy) ..................................................................... 64
7.3.13. Androgeny .............................................................................................................................. 65
7.3.14. Estrogeny ................................................................................................................................ 65

Spis treści
7
7.3.15. Progesteron (luteina) ............................................................................................................... 65
8. WITAMINY (Bronisława Skrzep-Poloczek, Ewa Romuk) ............................................................................... 67
8.1. Witaminy rozpuszczalne w wodzie ..................................................................................................... 67
8.1.1. Witamina B
1
(tiamina) ............................................................................................................. 67
8.1.2. Witamina B
2
(ryboflawina) ...................................................................................................... 67
8.1.3. Witamina B
3
(niacyna, kwas nikotynowy, witamia PP) ........................................................... 68
8.1.4. Witamina B
5
(kwas pantotenowy) ............................................................................................ 68
8.1.5. Witamina B
6
.............................................................................................................................. 68
8.1.6. Witamina B
12
(kobalamina) ...................................................................................................... 68
8.1.7. Kwas foliowy (folacyna, foliany) ............................................................................................. 69
8.1.8. Witamina H (biotyna) ............................................................................................................... 69
8.1.9. Witamina C (kwas askorbinowy) ............................................................................................. 69
8.2. Witaminy rozpuszczalne w tłuszczach ................................................................................................ 70
8.2.1. Witamina A (retinol, retinal i kwas retinowy) .......................................................................... 70
8.2.2. Witamina D (ergokalcyferol, cholekalcyferol) ......................................................................... 70
8.2.3. Witamina E (tokoferole i tokotrienole) ..................................................................................... 70
8.2.4. Witamina K (filochinon) ........................................................................................................... 70
9. PODSTAWOWE REGULACJE METABOLIZMU (Ewa Birkner) ........................................................... 72
9.1. Metabolizm ......................................................................................................................................... 72
9.2. Regulacje metaboliczne ...................................................................................................................... 73
9.3. Regulacja metabolizmu poprzez enzymy ............................................................................................ 73
9.3.1. Regulacja allosteryczna ............................................................................................................ 74
9.3.2. Regulacja kowalencyjna ........................................................................................................... 74
9.3.3. Aktywacja proteolityczna ......................................................................................................... 75
9.3.4. Zawartość i aktywność enzymów w komórce .......................................................................... 75
9.4. Regulacja transportu metabolitów przez błony ................................................................................... 77
CZĘŚĆ III. PŁYNY BIOLOGICZNE I GOSPODARKA WODNO-ELEKTROLITOWA Z ELEMEN-
TAMI DIAGNOSTYKI LABORATORYJNEJ .......................................................................... 78
10. KREW (Iwona Błaszczyk, Ewa Romuk) .......................................................................................................... 78
10.1. Metabolizm erytrocytów ................................................................................................................. 78
10.2. Niedokrwistości .............................................................................................................................. 78
10.3. Białka osocza krwi .......................................................................................................................... 79
10.3.1. Zaburzenia ilościowe białek osocza .................................................................................... 79
10.3.2. Albumina ............................................................................................................................. 80
10.3.3. Białka ostrej fazy ................................................................................................................. 80
10.3.4. Immunoglobuliny ................................................................................................................ 82
10.3.5. Markery nowotworowe ....................................................................................................... 82
10.3.6. Metody rozdziału białek osocza krwi .................................................................................. 83
10.4. Hemostaza ....................................................................................................................................... 83
10.5. Krzepnięcie krwi ............................................................................................................................. 84
10.6. Fibrynoliza ...................................................................................................................................... 85
10.7. Inhibitory krzepnięcia i fibrynolizy ................................................................................................. 85
11. MOCZ (Alina Ostałowska) ............................................................................................................................... 86
11.1. Powstawanie moczu ........................................................................................................................ 86
11.2. Badanie ogólne moczu .................................................................................................................... 86
11.2.1. Własności fizyczne moczu .................................................................................................. 87
11.2.2. Własności chemiczne moczu ............................................................................................... 88
11.3. Składniki patologiczne moczu ........................................................................................................ 89
11.3.1. Białka .................................................................................................................................. 89
11.3.2. Cukry redukujące ................................................................................................................ 89
11.3.3. Ciała ketonowe .................................................................................................................... 89
11.3.4. Bilirubina ............................................................................................................................. 90
11.3.5. Urobilinogen ........................................................................................................................ 90
11.3.6. Hemoglobina ....................................................................................................................... 90
11.3.7. Lipidy .................................................................................................................................. 90

Spis treści
8
11.4. Osad moczu ..................................................................................................................................... 90
11.4.1. Krwinkomocz i krwiomocz ................................................................................................. 90
11.4.2. Leukocyturia ........................................................................................................................ 90
11.4.3. Wałeczkomocz .................................................................................................................... 91
12. GOSPODARKA WODNO-ELEKTROLITOWA (Urszula Błaszczyk, Jolanta Zalejska-Fiolka) ............ 92
12.1. Gospodarka wodna organizmu ........................................................................................................ 92
12.2. Gospodarka elektrolitowa ............................................................................................................... 92
12.2.1. Sód i potas ........................................................................................................................... 93
12.2.2. Wapń ................................................................................................................................... 93
12.2.3. Magnez ................................................................................................................................ 94
12.3. Równowaga kwasowo-zasadowa krwi ............................................................................................ 94
12.4. Zaburzenia gospodarki kwasowo-zasadowej .................................................................................. 94
12.4.1. Kwasice metaboliczne ......................................................................................................... 94
12.4.2. Zasadowice metaboliczne .................................................................................................... 95
12.4.3. Kwasice oddechowe ............................................................................................................ 95
12.4.4. Zasadowice oddechowe ....................................................................................................... 95
12.4.5. Wodorowęglany .................................................................................................................. 95
12.4.6. Chlorki ................................................................................................................................. 95
12.4.7. Fosforany ............................................................................................................................. 95
12.5. Pierwiastki występujące we krwi w ilościach mikrogramowych .................................................... 96
12.5.1. Żelazo .................................................................................................................................. 96
12.5.2. Miedź ................................................................................................................................... 96
12.6. Pierwiastki śladowe ......................................................................................................................... 96
13. ENZYMY (Jolanta Zalejska-Fiolka, Urszula Błaszczyk) ............................................................................... 98
13.1. Budowa i rola enzymów .................................................................................................................. 98
13.2. Podział enzymów ............................................................................................................................ 99
13.3. Wybrane zagadnienia z diagnostyki enzymatycznej ....................................................................... 100
13.3.1. Kinaza kreatynowa .............................................................................................................. 100
13.3.2. Dehydrogenaza mleczanowa ............................................................................................... 101
13.3.3. Aminotransferaza asparaginowa .......................................................................................... 101
13.3.4. Aminotransferaza alaninowa ............................................................................................... 101
13.3.5. γ-Glutamylotransferaza ....................................................................................................... 101
13.3.6. Fosfataza zasadowa ............................................................................................................. 101
13.3.7. Dehydrogenaza glutaminianowa ......................................................................................... 102
13.3.8. Cholinoesteraza ................................................................................................................... 102
13.3.9. Fosfataza kwaśna ................................................................................................................. 102
13.3.10. Amylaza ............................................................................................................................. 102
14. WYBRANE BADANIA LABORATORYJNE (Aleksandra Kasperczyk, Sławomir Kasperczyk) ............. 103
14.1. Płyn biologiczny jako materiał badawczy ....................................................................................... 104
14.2. Zasady zachowania się w pracowni biochemicznej ........................................................................ 104
14.3. Podstawowe umiejętności praktyczne niezbędne w laboratorium biochemicznym ........................ 104
14.3.1. Pipetowanie ......................................................................................................................... 104
14.3.2. Wirowanie ........................................................................................................................... 105
14.3.3. Kolorymetria ....................................................................................................................... 105
14.4. Oznaczanie wybranych wskaźników biochemicznych we krwi i moczu .......................................... 105
14.4.1. Wykrywanie składników patologicznych moczu za pomocą testów paskowych .................. 105
14.4.2. Wykrywanie składników patologicznych moczu .................................................................... 106
14.4.3. Rozdział pełnej krwi, przygotowywanie hemolizatu i zawiesiny krwinek .......................... 107
14.4.4. Oznaczanie glukozy w pełnej krwi za pomocą glukometru ................................................ 107
14.4.5. Oznaczanie stężenia białka w surowicy krwi metodą biuretową ......................................... 108
14.4.6. Wykrywanie katalazy w pełnej krwi ................................................................................... 108
14.4.7. Oznaczanie stężenia hemoglobiny we krwi ......................................................................... 108
14.4.8. Oznaczanie całkowitej zawartości cholesterolu w surowicy krwi ....................................... 109

PRZEDMOWA
Biochemia – jedna z podstawowych dziedzin nauki o człowieku – charakteryzuje podstawowe
makrocząsteczki i ich elementarne składniki w organizmach żywych. Opisuje ich budowę i funkcje
oraz przemiany chemiczne w komórkach.
W niniejszym podręczniku zawarto podstawy biochemii, dostosowując omawiany zakres tema-
tyczny do wymagań programowych kierunku ratownictwa medycznego. Zamiarem autorów było
przedstawienie w zarysie reakcji katabolicznych i anabolicznych zachodzących w ustroju człowieka.
Opracowanie składa się z trzech części. W pierwszej opisano podstawowe przemiany metabo-
liczne białek, aminokwasów, cukrów, alkoholi, tłuszczów, cholesterolu, hemoglobiny, kwasów nukle-
inowych oraz biosyntezę białka. Część drugą poświęcono głównym regulacjom metabolicznym
z uwzględnieniem roli witamin i hormonów. Tematyka części trzeciej dotyczy najistotniejszych pły-
nów biologicznych – krwi i moczu, a także najważniejszych oznaczeń biochemicznych stosowanych
w diagnostyce medycznej, wraz z opisem badań laboratoryjnych, które mogą być wykonywane przez
studentów ratownictwa medycznego w czasie zajęć praktycznych.
Ze względu na organiczną liczbę godzin dydaktycznych z biochemii na kierunku ratownictwo
medyczne wiele szlaków metabolicznych przedstawiono w sposób uproszczony (z pominięciem
enzymów katalizujących reakcje biochemiczne), skupiając się na zaburzeniach biochemicznych, z któ-
rymi ratownik medyczny może spotkać się w praktyce.
Mamy nadzieję, że opracowanie okaże się przydatne nie tylko dla studentów kierunku ratownic-
twa medycznego, ale także dietetyki, kosmetologii, pielęgniarstwa, fizjoterapii, zdrowia publicznego
i wielu innych.
Ewa Birkner
Sławomir Kasperczyk

SPIS SKRÓTÓW
[s]
– stężenie substratu
acetylo~CoA – acetylokoenzym A
ACP
– białko przenoszące grupy acylowe
ACTH –
hormon
adrenokortykotropowy
ADH –
hormon
antydiuretyczny, wazopresyna
ADP –
adenozynodifosforan
ALA
– kwas delta-aminolewulinowy (kwas
5-aminolewulinowy)
ALP –
fosfataza
zasadowa
ALT
– aminotransferaza alaninowa
AMP –
adenozynomonofosforan
AST
– aminotransferaza asparaginianowa
ATP –
adenozynotrifosforan
ADP –
adenozynodifosforan
C –
węgiel
Ca –
wapń
cAMP –
cykliczny
AMP
CCK –
cholecystokinina
CEP –
białko przenoszące estry cholesterolu
cGMP –
cykliczny
GMP
CH –
cholesterol
ChE
– cholinoesteraza
CK
– kinaza kreatynowa
CMP –
cytydynomonofosforan
CDP –
cytydynodifosforan
CTP –
cytydynotrifosforan
CO –
tlenek
węgla
CO
2
– ditlenek węgla (dwutlenek węgla)
CoA –
koenzym
A
CoQ –
koenzym
Q
CRP –
białko C-reaktywne
cyt c
– cytochrom c
cz. –
cząsteczka
Da
– Dalton – umowna względna jednostka
masy atomowej
dAMP –
deoksyadenozynomonofosforan
dCMP –
deoksycytydynomonofosforan
dGMP –
deoksyguanozynomonofosforan
DHEA –
dehydroepiandrosteron
DOC –
dezoksykortykosteron
DOPA –
dihydroksyfenyloalanina
DPG –
2,3-difosfoglicerynian
dTMP –
tymidynomonofosforan
E –
enzym
EPO –
erytropoetyna
ES –
kompleks
enzym-substrat
FAD
– dinukleotyd flawinoadeninowy –
forma utleniona
FADH
2
– dinukleotyd flawinoadeninowego –
forma zredukowana
FMN
– mononukleotyd flawinowy
FSH –
hormon
folikulotropowy
G-1-P –
glukozo-1-fosforan
G-6-P –
glukozo-6-fosforan
GH
– hormon wzrostu
GMP –
guanozynomonofosforan
GDP –
guanozynodifosforan
GTP –
guanozynotrifosforan
H –
wodór
H
+
–
proton
H
2
O –
woda
H
2
O
2
– nadtlenek wodoru
Hb –
hemoglobina
HbCO –
karboksyhemoglobina
HDL
– lipoproteina o dużej gęstości
HMG-CoA –
3-hydroksy-3-metyloglutarylo-
-koenzym A
HTGL –
lipaza
wątrobowa
IDL
– lipoproteina o pośredniej gęstości
IGF
– insulinopodobny czynnik wzrostu,
somatomedyna
IMP –
inozynomonofosforan
K –
potas
K
m
–
stała Michaelisa
LCAT
– acylotransferaza lecytyna:cholesterol
LDH –
dehydrogenaza
mleczanowa
LDL
– lipoproteina o małej gęstości
LH –
hormon
luteinizujący
LPL
– lipaza lipoproteinowa
MetHb –
methemoglobina
N –
azot
Na –
sód
NAD
+
– dinukleotyd nikotynamidoadeninowy –
forma utleniona
NADH
– dinukleotyd nikotynamidoadeninowy –
forma zredukowana
NADP
+
– fosforan dinukleotydu nikotynamidoa-
deninowego – forma utleniona
NADPH
– fosforan dinukleotydu nikotynamidoa-
deninowego – forma zredukowana
NH
3
–
amoniak
O –
tlen
PCT –
prokalcotynina
P
i
– grupa fosforanowa
PRL –
prolaktyna
PRPP –
5-fosforybozylo-1-pirofosforan
PTH –
parathormon
S –
substrat
SAA
– surowicze amyloidowe białko A
T
3
–
trijodotyronina
T
4
– tyroksyna, tetrajodotyronina
TG –
triacyloglicerole
TSH –
hormon
tyreotropowy
UDP –
urydynodifosforan
UMP –
urydynomonofosforan
UTP –
urydynotrifosforan
V –
szybkość reakcji
VIP
– wazoaktywny peptyd jelitowy
VLDL
– lipoproteina o bardzo małej gęstości
V
max
–
szybkość maksymalna reakcji
WKT
– wolne kwasy tłuszczowe
γ-GT –
γ-glutamylotransferaza

CZĘŚĆ I
ZARYS PRZEMIAN BIOCHEMICZNYCH
1. PODSTAWY PRZEMIAN METABOLICZNYCH USTROJU
Sławomir Kasperczyk, Ewa Birkner
1.1. Przemiany kataboliczne
Organizm człowieka wykorzystuje do procesów życiowych energię chemiczną uzyskiwaną
w złożonym procesie utleniania. Jej źródłem są składniki zawarte w pożywieniu – cukry (glukoza,
fruktoza, galaktoza, skrobia, glikogen), tłuszcze (kwasy tłuszczowe, glicerol, ciała ketonowe) i białka
(szkielety węglowe aminokwasów). Źródłem energii dla organizmu człowieka może być również alko-
hol etylowy (etanol).
Przetwarzanie energii i materii w organizmie określa się pojęciem metabolizm. W jego skład
wchodzą katabolizm i anabolizm. Katabolizm jest procesem prowadzącym do przekształcenia skład-
ników złożonych w prostsze. Towarzyszy mu najczęściej wytworzenie energii, którą wykorzystuje ko-
mórka. Produktami katabolizmu wydalanymi z organizmu są woda, ditlenek węgla, mocznik, kwas
moczowy i kreatynina. Anabolizm to proces syntezy składników złożonych ze składników prostych
z wykorzystaniem energii uzyskanej w procesach katabolicznych. Proces syntezy zachodzący w orga-
nizmie nazywamy biosyntezą.
Atomy wodoru (H) i węgla (C) pochodzące ze związków energetycznych (cukry, tłuszcze, ami-
nokwasy, etanol) ulegają spalaniu z udziałem tlenu (O). W wyniku tych procesów wytwarzają się wo-
da i ditlenek węgla. Źródłem energii jest wieloetapowy proces utleniania wodoru w komórce. Powsta-
jąca energia jest magazynowana w postaci energii chemicznej bądź rozpraszana w postaci ciepła.
Głównym nośnikiem energii chemicznej (i jej akumulacji) jest związek wysokoenergetyczny –
adenozynotrifosforan (ATP), zbudowany z adeniny, rybozy i trzech reszt kwasu fosforowego (ade-
nina–ryboza–fosforan~fosforan~fosforan). Cząsteczka ATP ma dwa wiązania wysokoenergetyczne
(bogatoenergetyczne, makroergiczne) oznaczane najczęściej symbolem ~. Energia zawarta w poży-
wieniu zamieniana jest na energię chemiczną w postaci wiązań wysokoenergetycznych w ATP. Przy
rozpadzie cząsteczki ATP komórka uzyskuje energię do procesów anabolicznych, wytwarzania energii
mechanicznej (skurcz mięśni), energii elektrycznej (przewodzenie impulsów nerwowych) oraz aktyw-
nego transportu substancji przez błony komórkowe.
Po odłączeniu grupy fosforanowej (P
i
) z ATP powstaje adenozynodifosforan (ADP), zaś po od-
łączeniu kolejnej, drugiej grupy fosforanowej powstaje adenozynomonofosforan (AMP).
ATP
ADP + P
i
ADP
AMP + P
i
Na poziomie komórkowym do biosyntezy ATP z ADP prowadzą dwa procesy: fosforylacji
oksydacyjnej i substratowej. Najważniejsza i dostarczająca największej ilości ATP jest fosforylacja
oksydacyjna zachodząca w mitochondrium z wykorzystaniem tlenu cząsteczkowego (reakcje zacho-
dzą w mitochondrialnym łańcuchu oddechowym). Drugi rodzaj fosforylacji – substratowa – wykorzy-
stuje energię zawartą w związkach ulegających przemianom w procesie glikolizy (z glukozy do kwasu
mlekowego, tj. z bifosfoglicerynianu czy fosfoenolopirogronianu) oraz w cyklu kwasu cytrynowego
(z sukcynylo-CoA), która jest ostatecznie przenoszona na cząsteczkę ADP i powstaje ATP.
Część I. Zarys przemian biochemicznych
12
białka
cukry złożone
tłuszcze
aminokwasy
glukoza
kwasy
tłuszczowe
glicerol
Ł
ań
cuch oddechow
y
pirogronian
acetylo~CoA
CYKL KREBSA
ATP
etanol
równoważniki redukujące (H
+
)
Ryc. 1. Ogólny schemat katabolizmu
Ogólny schemat przemian katabolicznych ilustruje rycina 1. Do ustroju człowieka dostarczane
są białka, cukry oraz tłuszcze. W wyniku procesów trawienia z białek powstają aminokwasy, z cukrów
złożonych cukry proste (głównie glukoza), a z tłuszczów glicerol i kwasy tłuszczowe. Wymienione
składniki są wchłaniane w jelicie cienkim i dostarczane do komórek organizmu, gdzie zachodzą na-
stępne procesy. Z glukozy, części aminokwasów i glicerolu powstaje pirogronian, który następnie
ulega przekształceniu w aktywny octan, czyli acetylo~CoA (tzw. oksydacyjna dekarboksylacja piro-
gronianu). Z niektórych aminokwasów, kwasów tłuszczowych oraz bezpośrednio z etanolu, z pomi-
nięciem pirogronianu, powstaje acetylo~CoA, wchodzący następnie do cyklu kwasu cytrynowego
(cykl Krebsa). Jest to ciąg reakcji, w których reszty acetylowe acetylo~CoA ulegają utlenieniu.
Wynikiem wymienionych przemian jest redukcja odpowiednich koenzymów równoważnikami
redukującymi (wodory lub elektrony), które następnie są utleniane w łańcuchu oddechowym, czemu
towarzyszy synteza ATP. Proces ten zachodzi w mitochondrium.
Równoważniki redukujące są przenoszone na dwa rodzaje koenzymów – dinukleotyd nikoty-
namidoadeninowy (NAD
+
) oraz dinukleotyd flawinoadeninowy (FAD). W wyniku tych reakcji po-
wstają formy zredukowane:
NAD
+
+ 2H
NADH + H
+
FAD + 2H
FADH
2
Zredukowane koenzymy przenoszą atomy wodoru (w zasadzie jako proton i elektron) na kolej-
ne przenośniki i ostatecznie łączą się z atomem tlenu tworząc wodę. Ten system przenośników ato-
mów wodoru nazywa się łańcuchem oddechowym i zlokalizowany jest w mitochondrium. Powstają-
ca energia podczas tego transportu zamieniana jest na energię chemiczną w postaci ATP bądź rozpra-
szana w postaci ciepła.
1.2. Łańcuch oddechowy
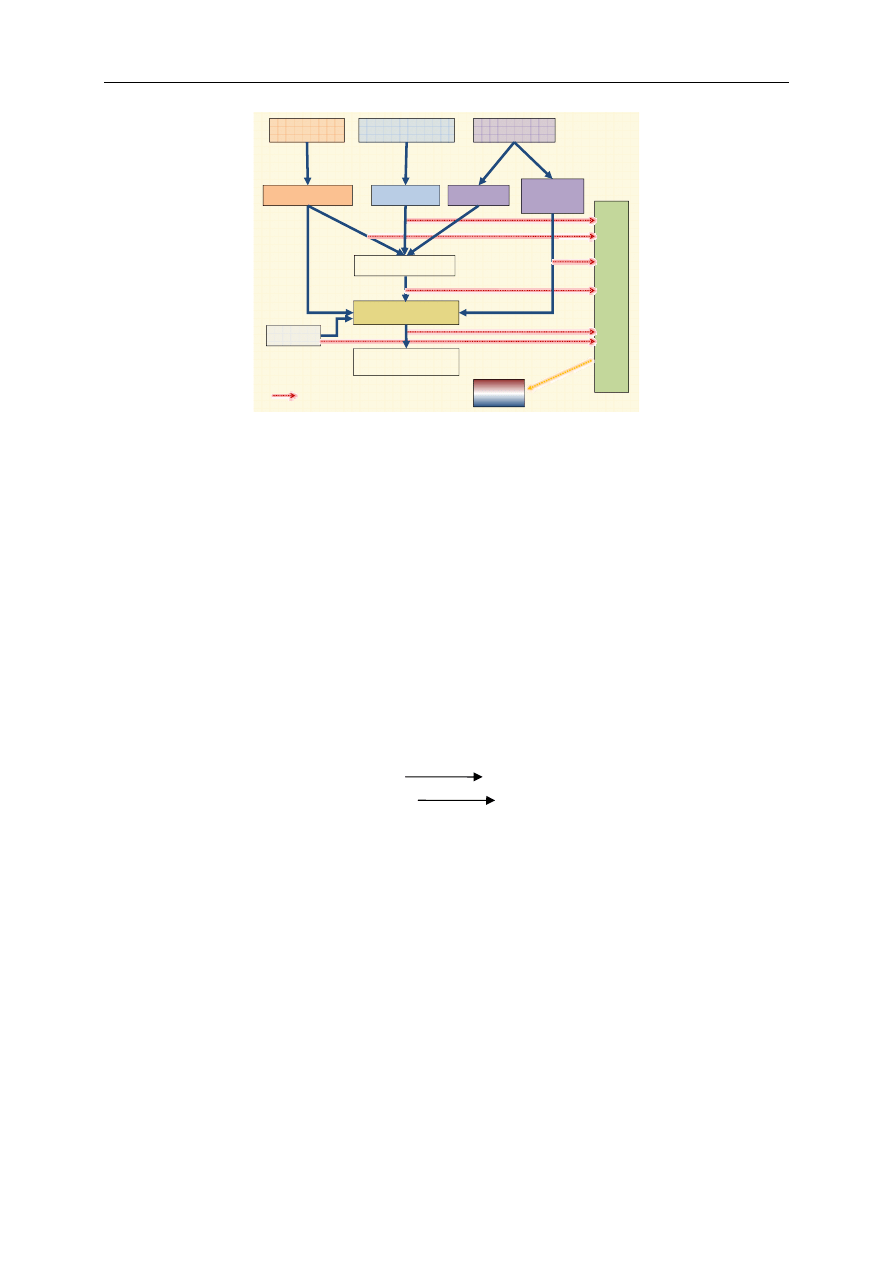
Łańcuch oddechowy zlokalizowany jest w wewnętrznej błonie mitochondrialnej. Transport pro-
tonów, elektronów oraz synteza ATP (fosforylacja oksydacyjna) zachodzą nieustannie we wszystkich
komórkach ciała zawierających mitochondrium. Mitochondrium zbudowane jest z:
− błony zewnętrznej, zawierającej pory, które czynią ją przepuszczalną dla wielu jonów i małych czą-
steczek,
− błony wewnętrznej, nieprzepuszczalnej dla wielu związków i jonów, zwłaszcza dla protonów (H
+
),
− macierzy mitochondrialnej, zawierającej: mitochondrialne DNA, RNA, rybosomy, enzymy odpo-
wiedzialne za utlenianie aminokwasów, pirogronianu i kwasów tłuszczowych (
β-oksydacja) oraz
enzymy cyklu Krebsa, NADH, FADH
2
,
ADP.
1. Podstawy przemian metabolicznych ustroju
13
W łańcuchu oddechowym zachodzi utlenianie zredukowanych w procesach katabolicznych ko-
enzymów NADH i FADH
2
. Wewnętrzna błona mitochondrialna podzielona jest na 5 kompleksów
enzymatycznych – od I do V. Kompleksy I–IV uczestniczą w transporcie elektronów, kompleks V ka-
talizuje syntezę ATP. Oprócz kompleksów istnieją również ruchliwe przenośniki, tj. koenzym Q
(CoQ) i cytochrom c (cyt c), które stanowią połączenie między niektórymi kompleksami (ryc. 2, 3).
Przepływ elektronów i protonów (pochodzących z NADH i FADH
2
) na łańcuchu oddechowym zacho-
dzi początkowo wspólnie. Po dojściu do koenzymu Q następuje rozdzielenie: elektrony przekazywane
są kolejno na cytochrom b, cytochrom c, cytochrom a + a
3
i łączą się z tlenem, protony zaś przekazy-
wane są z koenzymu Q na tlen, wytwarzając cząsteczkę wody.
NADH + H
+
Kompleks
I
Koen
zy
m
Q
Kompleks
III
Cy
to
chr
o
m c
Kompleks
IV
Kompleks
V
B
łon
a
m
ito
ch
on
dri
al
n
a
we
wn
ętr
zn
a
Macierz mitochondrialna
Przestrzeń między błoną wewnętrzną a zewnętrzną mitochondrium
NAD
+
FMN
Dehydrogenaza
NADH
Fe-S
Cytochrom
b
Oksydaza
cytochromowa
Reduktaza
cytochromowa
Cytochrom
a + a
3
½ O
2
H
2
O
2 H
+
Ryc. 2. Utlenienie zredukowanego dinukleotydu nikotynamidoadeninowego
(NADH) na łańcuchu oddechowym
bursztynian
Kompleks
II
Ko
e
n
zy
m
Q
Kompleks
III
Cy
toc
h
rom
c
Kompleks
IV
Kompleks
V
B
łon
a
m
ito
ch
on
dri
a
ln
a
we
wn
ętrz
n
a
Macierz mitochondrialna
Przestrzeń między błoną wewnętrzną a zewnętrzną mitochondrium
fumaran
FAD(H
2
)
Dehydrogenaza
bursztynianowa
Fe-S
Cytochrom
b
Oksydaza
cytochromowa
Reduktaza
cytochromowa
Cytochrom
a + a
3
½ O
2
H
2
O
2 H
+
Ryc. 3. Utlenienie zredukowanego dinukleotydu flawinoadeninowego (FADH
2
) na łań-
cuchu oddechowym
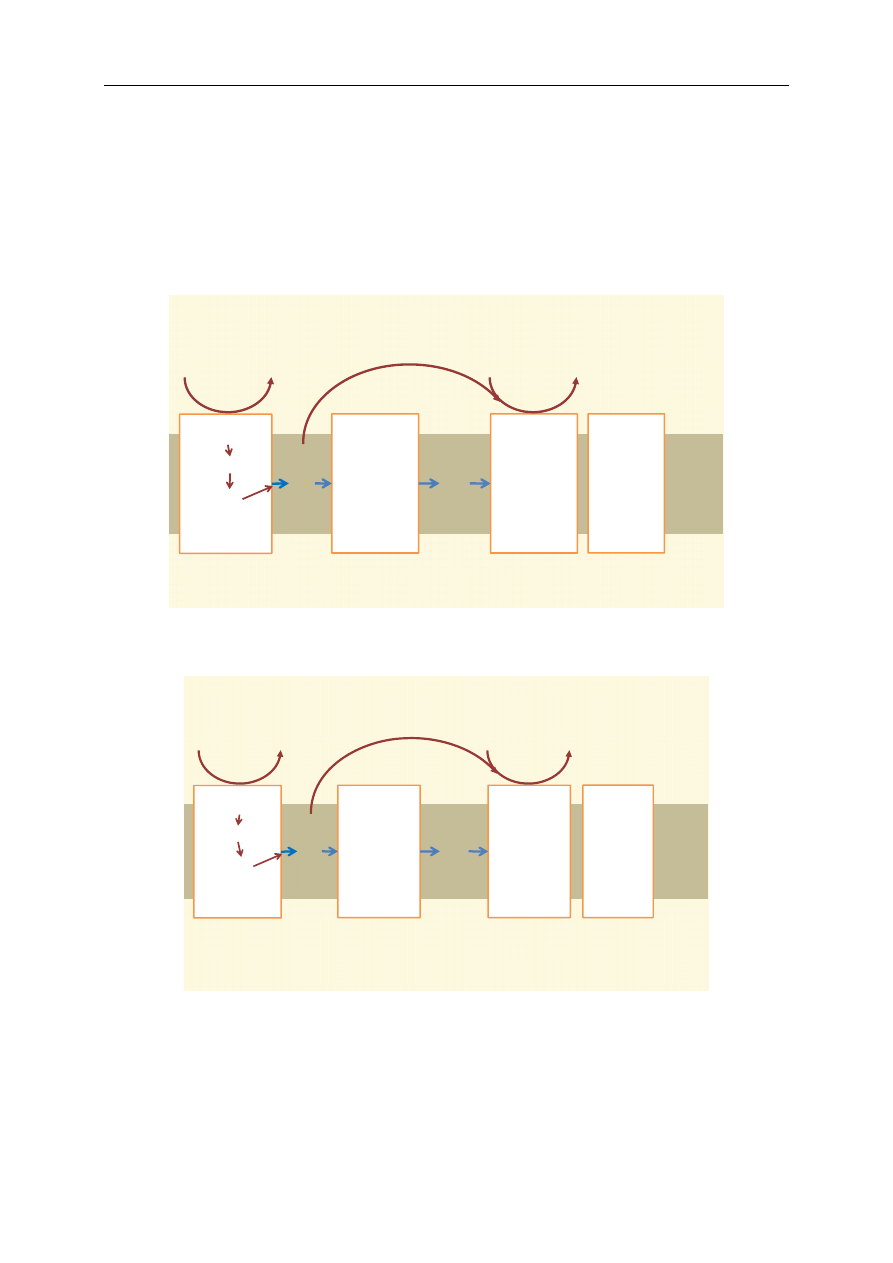
Podczas utleniania NADH dochodzi do przekazywania elektronów w łańcuchu oddechowym
przez kompleks I, koenzym Q, kompleks III, cytochrom c i kompleks IV. Po połączeniu elektronów
z tlenem i protonami powstaje cząsteczka wody (ryc. 2). Utlenianie FADH
2
przebiega podobnie. Elek-
trony są przekazywane na łańcuch oddechowy poprzez kompleks II, koenzym Q, kompleks III, cyto-
chrom c i kompleks IV. Następnie również wytwarza się cząsteczka wody (ryc. 3).
Część I. Zarys przemian biochemicznych
14
Kompleks I przenosi elektrony i protony na FMN tworząc FMNH
2
, który przekazuje je dalej
poprzez białka żelazowo-siarkowe (Fe-S) na CoQ (ryc. 2). Kompleks II przenosi z substratu (bursz-
tynianu) równoważniki redukujące na FAD, a powstały FADH
2
oddaje je dalej na CoQ (ryc. 3). Na-
stępnie elektrony z CoQ są przekazywane na kompleks III zawierający cytochrom b, z którego prze-
chodzą na ruchliwy przenośnik cytochrom c i dalej na kompleks IV. W jego skład wchodzi cyto-
chrom a + a
3
zawierający oksydazę cytochromową, która katalizuje przyłączenie się elektronów z O
2
i dwoma protonami, w wyniku czego powstaje woda (H
2
O).
W wyniku stopniowego przekazywania równoważników redukujących przez kompleksy I, II,
III i IV między sobą i do ruchliwych przenośników, tj. CoQ i cytochromu c, dochodzi do wytworzenia
w poprzek wewnętrznej błony mitochondrialnej gradientu elektrycznego i pH na skutek wypompowa-
nia protonów z macierzy mitochondrialnej do przestrzeni międzybłonowej. Powstaje tzw. gradient
protonowy (ryc. 4 i 5), który stopniowo zanika wskutek powrotu protonów do macierzy mitochon-
drialnej przez przepuszczenie ich przez kompleks V (kanał syntetazy ATP). Powstająca w wyniku
tego procesu energia jest zużywana do syntezy ATP.
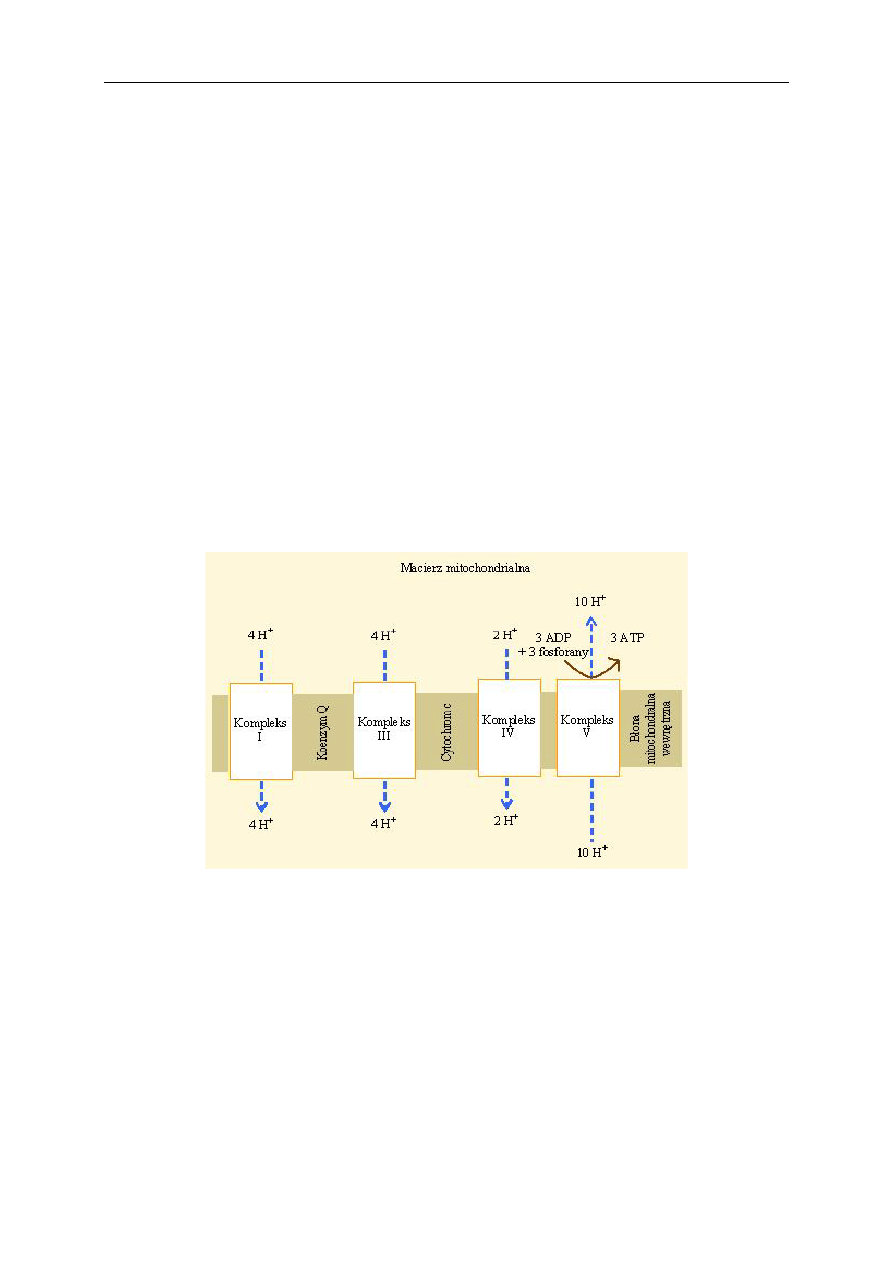
Podczas utleniania cząsteczki NADH w łańcuchu oddechowym powstają trzy cząsteczki ATP
(ryc. 4). Gradient protonowy powstaje przy przechodzeniu równoważników redukujących przez kom-
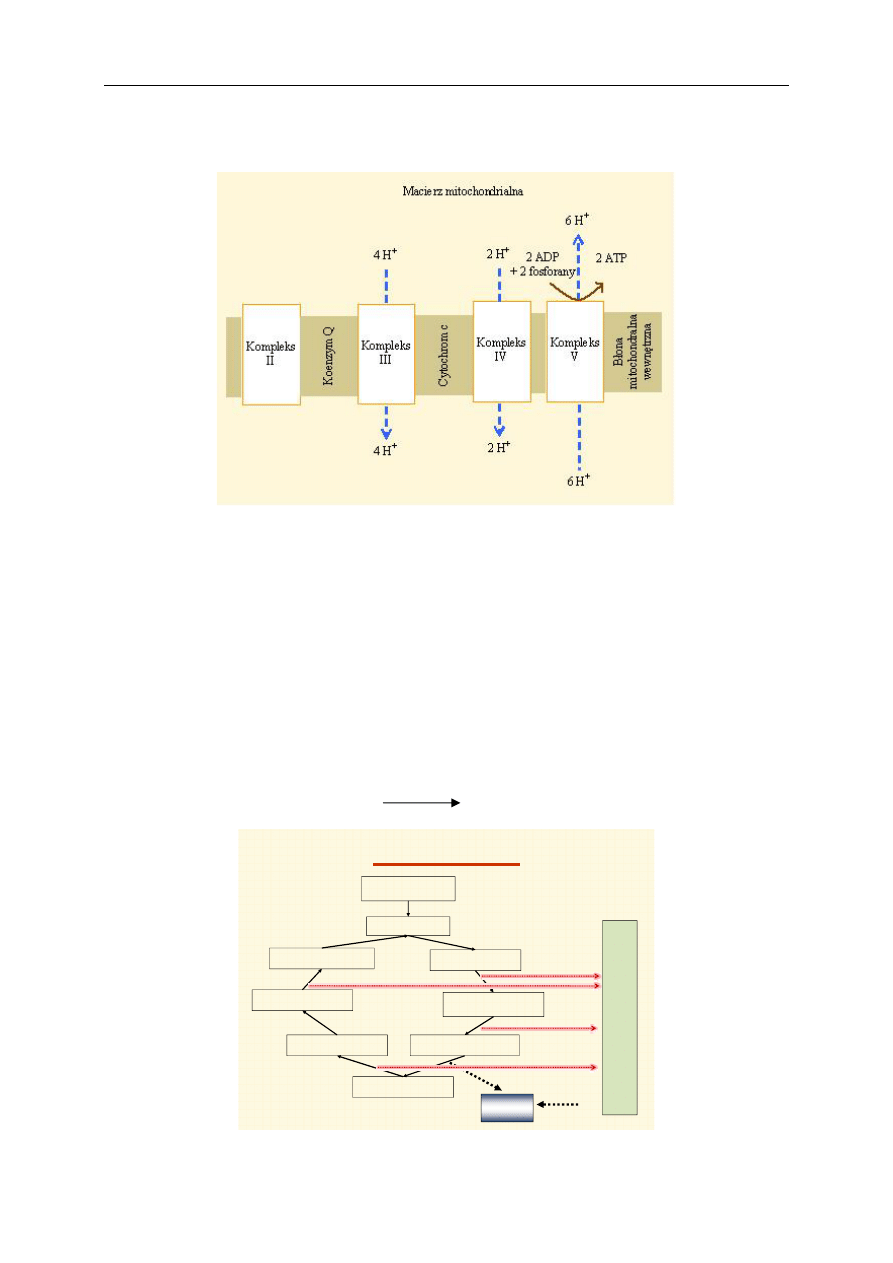
pleksy I, III i IV. Natomiast podczas utleniania cząsteczki FADH
2
gradient protonowy powstaje tylko
w przypadku przechodzenia przez kompleksy III i IV, co w efekcie na kompleksie V umożliwia po-
wstanie dwóch cząsteczek ATP (ryc. 5).
Proces syntezy ATP na łańcuchu oddechowym w mitochondrium przy udziale tlenu nazywa się
fosforylacją oksydacyjną. Łańcuch oddechowy dostarcza większość energii wytwarzanej podczas ka-
tabolizmu.
Ryc. 4. Wytwarzanie ATP podczas utlenienia zredukowanego dinukleotydu
nikotynamidoadeninowego (NADH) w łańcuchu oddechowym
Fosforylacja oksydacyjna może być zahamowana poprzez działanie związków chemicznych, co
stanowi stan zagrożenia życia. Do związków hamujących oddychanie komórkowe zalicza się inhibi-
tory łańcucha oddechowego, np. barbiturany (leki nasenne), które hamują kompleks I, toksyczne
gazy: tlenek węgla (CO), siarkowodór, cyjanek, hamujące kompleks IV. Następna grupa związków to
inhibitory oksydacyjnej fosforylacji hamujące wytwarzanie ATP na kompleksie V, np. oligomycyna
(antybiotyk) oraz czynniki rozprzęgające. Te ostatnie powodują odłączenie procesu utleniania w łań-
cuchu oddechowym od fosforylacji (np. 2,4-dinitrofenol) poprzez wzrost przepuszczalności wewnętrz-
nej błony mitochondrialnej dla jonów wodorowych i rozprzęgnięcie transportu równoważników redu-
kujących i elektronów.
W przypadku zatrucia CO bardzo istotne jest podanie tlenu, który wypiera trujący gaz z kom-
pleksów CO z białkami łańcucha oddechowego oraz z karboksyhemoglobiny (hemoglobiny połączo-
1. Podstawy przemian metabolicznych ustroju
15
nej z CO), przywracając prawidłową funkcję tych związków. Efektywność tego procesu wzrasta
w przypadku wykorzystania tlenu pod wyższym ciśnieniem niż atmosferyczne (w tzw. komorach hi-
perbarycznych).
Ryc. 5. Wytwarzanie ATP podczas utlenienia dinukleotydu flawinoadeninowego
(FADH
2
) w łańcuchu oddechowym
1.3. Cykl Krebsa
Cykl Krebsa (cykl kwasu cytrynowego, cykl kwasów trikarboksylowych) jest przemianą pozwa-
lającą na doprowadzenie procesu utleniania związków organicznych do CO
2
. Stanowi wspólny końco-
wy szlak utleniania cukrów, tłuszczów i białek. Etapem przygotowawczym do tej przemiany, skupia-
jącej kataboliczne drogi wszystkich rodzajów związków organicznych, jest wytworzenie uniwersalnej
jednostki, która uległaby spaleniu do produktów końcowych. Jednostką tą jest acetylo~CoA. Głów-
nym jej źródłem w komórce są kwasy tłuszczowe oraz pirogronian powstający głównie z glukozy
(szlak glikolizy). Z kwasów tłuszczowych bezpośrednio powstaje acetylo~CoA, a proces rozkładu na-
zywa się β-oksydacją. W glikolizie z glukozy powstaje pirogronian, który zostaje przeniesiony do mi-
tochondrium, gdzie ulega oksydacyjnej dekarboksylacji i następnie powstaje acetylo~CoA według
reakcji:
pirogronian + NAD
+
+ CoA
acetylo~CoA + NADH + H
+
+ CO
2
acetylo~CoA
cytrynian
Ł
a
ń
cuc
h
odde
chowy
izocytrynian
ATP
α-ketoglutaran
sukcynylo-CoA
bursztynian
fumaran
jabłczan
szczawiooctan
Cykl Krebsa
Ryc. 6. Schemat cyklu Krebsa

Część I. Zarys przemian biochemicznych
16
W cyklu Krebsa (ryc. 6) w wyniku utlenienia 1 cząsteczki acetylo~CoA dochodzi do wytworze-
nia równoważników redukujących (3 cząsteczki NADH oraz 1 cząsteczka FADH
2
), wytworzenia jed-
nej cząsteczki GTP (guanozynotrifosforanu) oraz 2 cząsteczek ditlenku węgla (CO
2
). Reakcja suma-
ryczna cyklu Krebsa:
acetylo~CoA + 3NAD
+
+ FAD + GDP + fosforan + 2H
2
O
2CO
2
+ 3NADH + FADH
2
+ GTP + 2H
+
+ CoA
W cyklu Krebsa zachodzi synteza wysokoenergetycznego wiązania fosforanowego z sukcyny-
lo~CoA (tzw. fosforylacja substratowa). Wiązanie tioestrowe (~) w sukcynylo~CoA jest wysokoenerge-
tyczne. Jego rozerwanie jest sprzężone z fosforylacją GDP (guanozynodifosforan) do GTP. Następnie
fosforan z GTP jest łatwo przenoszony na ADP, tworząc ATP:
GTP + ADP
GDP + ATP
Jest to jedyna reakcja cyklu Krebsa bezpośrednio dostarczająca bogatego energetycznie wiąza-
nia fosforanowego.
W wyniku utlenienia 1 cząsteczki acetylo~CoA powstaje 12 cząsteczek ATP. Bilans energe-
tyczny przedstawia się następująco:
utlenienie 3 cząsteczek NADH
3
× 3 ATP = 9
utlenienie 1 cząsteczki FADH
2
1
× 2 ATP = 2
1 fosforylacja substratowa (tworzenie GTP)
1
× 1 ATP = 1
SUMA
ATP 12
Cykl może funkcjonować tylko w warunkach tlenowych, choć tlen nie bierze bezpośredniego
udziału w procesach utleniania cyklu Krebsa. Jest on niezbędny do utleniania koenzymów NADH
i FADH
2
w łańcuchu oddechowym i odtwarzania form utlenionych tych związków: NAD
+
i FAD.
Cykl Krebsa w połączeniu z łańcuchem oddechowym jest głównym źródłem energii potrzebnej
do funkcjonowania większości komórek organizmu.
1.4. Łączność cyklu Krebsa z innymi przemianami
Amfiboliczna, czyli podwójna rola cyklu Krebsa polega na tym, iż z jednej strony następuje
w nim całkowite spalanie dwuwęglowego acetylo~CoA (powstałego z katabolizmu cukrów, tłuszczów
i białek) w wyniku dwóch dekarboksylacji (odłączenie CO
2
), z drugiej natomiast poszczególne jego
metabolity biorą udział w licznych biosyntezach.
Poprzez cytrynian zostaje przeniesiony acetylo~CoA (powstały w wyniku oksydacyjnej dekar-
boksylacji pirogronianu) z mitochondrium do cytosolu, gdzie bierze udział w biosyntezie kwasów
tłuszczowych. Jest to najważniejsza łączność przemian cukrowych z tłuszczowymi i w ten sposób nad-
miar cukrów w pożywieniu (dających w glikolizie pirogronian), przechodzi w organizmie w tłuszcze
odkładane w tkance tłuszczowej. Ponadto z acetylo~CoA powstaje cholesterol, a z niego hormony ste-
roidowe.
W cyklu Krebsa powstają dwa ketokwasy, które są prekursorami aminokwasów endogennych –
kwasu
α-ketoglutarowego oraz szczawiooctowego.
Kwas α-ketoglutarowy (α-ketoglutaran) w reakcji transaminacji daje kwas glutaminowy,
z którego powstają prolina i hydroksyprolina. Kwas glutaminowy może wiązać amoniak dając gluta-
minę, co ma szczególne znaczenie w detoksykacji amoniaku w mózgu. Glutamina jest najważniejszym
związkiem amidującym w organizmie i bierze udział w biosyntezie puryn, pirymidyn i aminocukrów.
Kwas szczawiooctowy (szczawiooctan) poprzez jabłczan zostaje przeniesiony do cytosolu,
gdzie pod wpływem karboksykinazy fosfoenolopirogronianowej przechodzi w fosfoenolopirogronian.
Jest to najważniejsza reakcja glukoneogenezy, w której aminokwasy glukogenne dają glukozę, i naj-
ważniejsza łączność przemian białkowych z cukrowymi. Kwas szczawiooctowy drogą transaminacji

1. Podstawy przemian metabolicznych ustroju
17
daje kwas asparaginowy, który bierze udział w biosyntezie puryn i pirymidyn. Ponadto grupa amino-
wa asparaginianu uczestniczy w budowie mocznika CO(NH
2
)
2
powstałego w cyklu mocznikowym.
Wspólnym metabolitem obydwu cykli jest fumaran, ale najważniejszą ich łącznością jest zależność
energetyczna, bowiem cykl mocznikowy zużywa 4 ATP, które powstają w cyklu Krebsa.
Sukcynylo~CoA w cyklu glicynowo-bursztynianowym tworzy porfirynę wchodzącą w skład
hemu, cytochromów i niektórych enzymów.
Rola anaboliczna cyklu Krebsa to udział w glukoneogenezie, lipogenezie, steroidogenezie, tak-
że w biosyntezie puryn, pirymidyn, aminokwasów oraz hemu.
P i ś m i e n n i c t w o
1. Bańkowski E. Biochemia. Podręcznik dla studentów uczelni medycznych. Wydawnictwo Medyczne
Urban & Partner, Wrocław 2004, s. 91–114, 145–153.
2. Biochemia Harpera ilustrowana. Red. R.K. Murray, D.K. Granner, V.W. Rodwell. Wydawnictwo
Lekarskie PZWL, Warszawa 2008, wyd. 6, s. 111–138, 178–184.

2. BIAŁKA
Ewa Birkner, Aleksandra Kasperczyk
2.1. Budowa aminokwasów i białek
Białka (proteiny) to wielkocząsteczkowe polipeptydy. Podstawowymi jednostkami struktural-
nymi białek są aminokwasy. Połączenie dwóch aminokwasów daje dipeptyd, trzech – tripeptyd itd.
Połączenia od dwóch do dziesięciu aminokwasów określa się mianem oligopeptydu. Polipeptydy za-
wierają kilkadziesiąt, zaś białka ponad sto aminokwasów i mają masę cząsteczkową powyżej 10 kDa.
Aminokwas jest zbudowany z grupy karboksylowej, aminowej, atomu wodoru i charaktery-
stycznej grupy R, zwanej łańcuchem bocznym aminokwasu (ryc. 7).
C
H
COO
-
+
H
3
N
R
grupa
aminowa
grupa
karboksylowa
łańcuch
boczny
C
H
COO
-
+
H
3
N
R
1
C
H
COO
-
+
H
3
N
R
2
C
H
CO
+
H
3
N
R
1
C
H
COO
-
HN
R
2
A. Schemat budowy aminokwasu
+
B. Powstawanie wiązania peptydowego
Ryc. 7. Schemat budowy aminokwasu (A) i powstawania wiązania peptydowego
z dwóch aminokwasów (B)
U wszystkich gatunków (od bakterii po człowieka) białka są zbudowane z tego samego zestawu
20 aminokwasów, połączonych wiązaniem peptydowym, powstałym z połączenia grupy karboksylo-
wej jednego aminokwasu z grupą aminową drugiego. Powstaje dipeptyd, co wiąże się z uwolnieniem
cząsteczki wody (ryc. 7).
Struktura pierwszorzędowa (I-rzędowa) to zakodowana genetycznie kolejność ułożenia (se-
kwencja) poszczególnych aminokwasów w łańcuchu polipeptydowym.
Struktura drugorzędowa (II-rzędowa) opisuje wzajemne przestrzenne ułożenie reszt amino-
kwasowych. Przykładami struktury II-rzędowej są α-helisa i struktura β.

2. Białka
19
α-helisa jest swoistą formą spirali prawo- bądź lewoskrętnej. W białkach jest ona zawsze pra-
woskrętna. Na zewnątrz cylindra wystają łańcuchy boczne aminokwasów, a ciasno skręcony łańcuch
główny tworzy wewnętrzną część cylindra. Zawartość struktury α w białkach jest bardzo różna: α-ke-
ratyna jest niemal całkowicie objęta strukturą α-helisy, hemoglobina w 80%, lizozym jedynie w 25%,
zaś kolagen i elastyna w ogóle nie wytwarzają α-helisy.
W strukturze β (tzw. pofałdowana kartka) łańcuch białkowy jest prawie całkowicie rozciągnię-
ty w kierunku osiowym. Strukturę taką mają fibroina jedwabiu lub β-keratyna.
Struktura trzeciorzędowa (III-rzędowa) określa najbardziej korzystne energetycznie uporząd-
kowanie przestrzenne poszczególnych części cząsteczki białka. Zależy od oddziaływań między łańcu-
chami bocznymi jednej lub większej liczby makrocząsteczek. Struktura III-rzędowa stabilizowana jest
wiązaniami kowalencyjnymi, takimi jak: mostki di-siarczkowe oraz licznymi, lecz słabymi wiązania-
mi wodorowymi, hydrofobowymi, elektrostatycznymi.
Struktura czwartorzędowa (IV-rzędowa) określa sposób przestrzennego powiązania kilku
cząsteczek w jedną złożoną strukturę białka. Strukturę IV-rzędową posiadają białka złożone z więk-
szej liczby łańcuchów polipeptydowych.
Zniszczenie struktur przestrzennych białka (II-, III- i IV-rzędowej) z zachowaniem struktury I-
-rzędowej nazywa się denaturacją. Istotą tego procesu jest rozpad wiązań o niskiej energii, które stabi-
lizują strukturę białka. Czynnikami denaturującymi są: podwyższona temperatura, rozpuszczalniki
organiczne, kwasy, zasady, jony metali ciężkich (Hg, Pb) oraz stężone roztwory mocznika.
Białka można podzielić na podstawie stosunku osiowego (długości do szerokości) na fibrylarne
i globularne. Białka fibrylarne są nierozpuszczalne w wodzie i w roztworach soli. Występują u zwie-
rząt jako składniki tkanki łącznej, np. kolagenu, elastyny, keratyny. Mają małą wartość żywieniową.
Keratyna (zawiera dużo aminokwasu cysteiny) podstawowy składnik zrogowaciałych komórek skóry,
paznokci, włosów, rogów, kopyt, a także runa zwierząt, upierzenia ptaków i wydzielin niektórych
owadów. Elastyna (zawiera dużą ilość aminokwasów proliny i hydroksyproliny) to białko towarzyszą-
ce kolagenowi w budowie ścięgien, wiązadeł i ścian większych naczyń krwionośnych, jest nieroz-
puszczalne w wodzie. Białka globularne mają postać kłębków (globul) i bardziej niż białka fibrylarne
złożoną budowę. Wyróżniamy wśród nich m.in.: albuminy (roślinne, białko jaja kurzego, mleka, albu-
miny osocza krwi), globuliny (roślinne, globuliny osocza krwi), gluteiny (ziaren zbóż, gluten), prola-
miny (ziaren zbóż), histony (składowe chromatyny) oraz protaminy (składowe jąder komórkowych,
krwinek krwi czerwonych i białych).
2.2. Rola aminokwasów i białek
Białka są istotnym składnikiem komórek i tkanek oraz podłożem wielu procesów biologicz-
nych. Ich obecność we krwi, limfie oraz płynach pozakomórkowych odgrywa ważną rolę w regulacji
ciśnienia onkotycznego, krzepnięciu krwi oraz procesach odpornościowych. W postaci enzymów
i licznych hormonów białkowych uczestniczą w katalizowaniu i regulacji procesów metabolicznych
komórek. Następstwem wielkiej reaktywności biochemicznej białek jest ich ciągłe zużywanie się.
Procesom rozkładu muszą towarzyszyć procesy resyntezy. Oba te procesy pozostają w stanie równo-
wagi dynamicznej, ich zaburzenie prowadzi do stanów chorobowych, a nawet śmierci organizmów.
U zdrowego dorosłego człowieka obrót białek wynosi około 400 g/dobę, tzn. w ciągu doby około 400 g
białek ulega rozpadowi, ale tylko 100 g wskutek degradacji zostaje wydalone i musi być zastąpione
aminokwasami dostarczonymi z pożywienia, pozostałe 300 g ulega resyntezie.
Ustalono tzw. minimum białkowe, tzn. najmniejszą ilość białka pokarmowego gwarantującą
prawidłowe funkcjonowanie ustroju ludzkiego. Wynosi ono około 1 g białka/1 kg masy ciała/dobę.
Wartość ta dotyczy organizmu otrzymującego wystarczającą ilość kalorii, a więc dostateczną ilość
cukrów i tłuszczów. W czasie głodzenia minimum białkowe wzrasta ze względu na wykorzystanie
białek jako materiału energetycznego.
Ustrój ssaka nie ma zdolności magazynowania białek. Wszelkie nadwyżki kaloryczne są gro-
madzone w postaci tłuszczu (triacyloglicerole) lub cukrów (glikogen wątrobowy). Białka przekracza-
jące zapotrzebowanie ustroju ulegają degradacji, zaś azot aminokwasów zostaje wydalony z moczem,
głównie w postaci mocznika. Różnica między ilością azotu spożytego w dobowym pożywieniu a jego
ilością wydaloną w tym samym czasie w moczu i kale nosi nazwę bilansu azotowego. Ustrój dorosłe-

Część I. Zarys przemian biochemicznych
20
go, zdrowego i normalnie odżywianego człowieka wykazuje zerowy bilans azotowy, a więc ilość azo-
tu pobrana w pokarmie równa jest ilości azotu wydalonego.
Ujemny bilans azotowy wywołany jest głodem lub dietą bezbiałkową. Występuje w chorobach
nowotworowych oraz w chorobach wyniszczających, przebiegających z zaburzeniami wchłaniania
białek lub ich nadmierną utratą, a także u chorych po zabiegach operacyjnych w obrębie przewodu
pokarmowego. Ujemny bilans azotowy wywołują również zmiany związane z wiekiem starczym.
Dodatni bilans azotowy występuje u organizmów rosnących (niemowlęta i dzieci), rekonwa-
lescentów oraz kobiet w okresie ciąży i laktacji. Może również towarzyszyć niektórym zaburzeniom
hormonalnym, np. nadmiernemu wydzielaniu androgenów.
Aminokwasy występujące w białkach ze względu na budowę dzielimy na następujące grupy:
− zawierające alifatyczne łańcuchy boczne: glicynę, alaninę, walinę, leucynę i izoleucynę,
− zawierające grupę sulfhydrylową (-SH) w łańcuchu bocznym: metioninę, cysteinę i cystynę,
− zawierające grupę hydroksylową (-OH) w łańcuchu bocznym: serynę, treoninę i tyrozynę,
− zawierające pierścień aromatyczny: histydynę, tyrozynę, fenyloalaninę i tryptofan,
− kwaśne: asparaginian (kwas asparaginowy), glutaminian (kwas glutaminowy) i ich pochodne: aspa-
raginę, glutaminę,
− zasadowe: lizynę, argininę i histydynę,
− inne: glicynę – (jej grupę boczną stanowi tylko atom wodoru) i prolinę (aminokwas).
Organizm człowieka potrafi sam syntetyzować niektóre aminokwasy. Są to tzw. aminokwasy
endogenne. Warunkiem powstawania aminokwasów endogennych jest obecność odpowiednich α-ke-
tokwasów, powstałych w wyniku endogennych przemian i drogą transaminacji dających odpowiednie
aminokwasy. Kwas pirogronowy powstający w toku glikolizy daje drogą transaminacji alaninę, kwas
szczawiooctowy powstający przez karboksylację pirogronianu daje kwas asparaginowy, z kwasu α-ke-
toglutarowego będącego metabolitem cyklu Krebsa powstaje kwas glutaminowy, a z 3-fosfoglicery-
nianu (metabolit glikolizy) powstaje seryna. Niektóre z tych aminokwasów są z kolei źródłem dla wy-
twarzania innych, i tak: z seryny powstaje glicyna, z kwasu glutaminowego prolina i hydroksyprolina.
Niektóre aminokwasy wytwarzane endogennie, jak arginina powstająca w cyklu mocznikowym oraz
histydyna, są wystarczające dla dorosłego organizmu, ale nie dla rozwijającego się dziecka, w związku
z czym do 12 roku życia muszą być uzupełniane z pożywieniem. Ponadto część z aminokwasów endo-
gennych może powstawać z aminokwasów egzogennych, np. cysteina powstaje z metioniny, a tyrozyna
z fenyloalaniny.
Aminokwasy egzogenne (niezbędne) to aminokwasy, które muszą być dostarczone z pożywie-
niem. Zalicza się do nich wszystkie aminokwasy z łańcuchem rozgałęzionym, którego ustrój ssaka nie
potrafi syntetyzować (walina, leucyna oraz izoleucyna), aminokwasy z pierścieniem aromatycznym
(fenyloalanina, tryptofan) oraz treoninę, metioninę i lizynę.
Jeżeli całe minimum białkowe pokryjemy aminokwasami endogennymi, ustrój będzie cierpiał
na niedobór białek, dlatego minimum białkowe musi zawierać zarówno aminokwasy endogenne, jak
i egzogenne. Białka dzielą się na 3 grupy zależnie od zawartości aminokwasów:
1)
białka doborowe posiadające wystarczającą ilość wszystkich aminokwasów egzogennych, są to
przede wszystkim białka pokarmów pochodzenia zwierzęcego występujące w mięsie, jajach, mle-
ku, ponadto albumina surowicy krwi,
2)
białka częściowo niepełnowartościowe zawierające wprawdzie wszystkie aminokwasy niezbędne,
ale niektóre w ilościach niewystarczających; są to białka pochodzenia roślinnego, szczególnie ro-
śliny strączkowe i zbożowe (kasze, grysiki, mąka), np. białka owsa zawierają mało lizyny, grochu
– niedobór metioniny,
3)
białka niepełnowartościowe zawierające mało aminokwasów egzogennych lub niezawierające
jednego lub kilku z nich, należą do nich żelatyna oraz białka ścięgien pozbawione tryptofanu, a bo-
gate w lizynę, białka kukurydzy nie zawierają tryptofanu.
2.3. Trawienie białek i enzymy proteolityczne
Białko zawarte w pożywieniu może być przyswojone przez ustrój dopiero po rozłożeniu na ami-
nokwasy pod wpływem działania enzymów proteolitycznych. Organizm nie toleruje obecności obcych

2. Białka
21
białek w krwiobiegu, gdyż działają one antygenowo i prowadzą do powstania przeciwciał. Jedynie
oseski dzięki większej porowatości śluzówki jelitowej mogą korzystać z białek nierozłożonych, co ma
szczególne znaczenie w przyswajaniu ciał odpornościowych dostarczanych z mlekiem matki. Zwięk-
szona przepuszczalność ściany jelitowej ma jednak i stronę ujemną, jest bowiem przyczyną dość czę-
stych u małych dzieci alergii pokarmowych po spożyciu mleka, mięsa lub jaj.
Istnieje zasadnicza różnica w szybkości trawienia między białkami egzogennymi dostarczanymi
z pokarmem a endogennymi wytwarzanymi przez ustrój. Białka egzogenne dostają się do przewodu
pokarmowego w postaci zdenaturowanej w wyniku zabiegów kulinarnych, takich jak pieczenie czy
gotowanie. W wyniku denaturacji zniszczeniu ulegają II-, III- i IV-rzędowe struktury białek, powodu-
jąc odsłonięcie wiązań peptydowych łatwo dostępnych dla enzymów proteolitycznych. W rezultacie
egzogenne białko pokarmowe zostaje niemal całkowicie zhydrolizowane i wchłonięte w 90–100%,
w przeciwieństwie do białek endogennych (w 40%). Do tych ostatnich zalicza się glikoproteiny wy-
dzielane przez przewód pokarmowy i otoczone warstwą śluzu chroniącą przed hydrolizą enzymatycz-
ną.
Enzymy proteolityczne zaliczamy do hydrolaz rozkładających wiązania C-N, ponieważ katalizu-
ją reakcję rozszczepienia wiązania peptydowego. Zależnie od lokalizacji i funkcji biologicznej można
wyróżnić następujące grupy proteaz:
− trawienne znajdujące się w przewodzie pokarmowym,
− występujące pozakomórkowo we krwi i innych płynach pozakomórkowych, pełniące rolę np.
w procesie krzepnięcia krwi, fibrynolizie lub aktywacji składników dopełniacza,
− wewnątrzkomórkowe znajdujące się przeważnie w lizosomach i biorące m.in. udział w przekształ-
caniu prekursorów hormonów peptydowych w hormony peptydowe.
Enzymy proteolityczne można również podzielić na endopeptydazy – działające wewnątrz łańcu-
cha polipeptydowego i egzopeptydazy – odszczepiające jedynie aminokwasy skrajne. Do egzopepty-
daz należą: aminoegzopeptydazy, uwalniające skrajne aminokwasy z wolną grupą aminową, oraz kar-
boksyegzopeptydazy uwalniające aminokwasy z wolną grupą karboksylową. Istnieją również dipepty-
dazy działające tylko na dipeptydy. Do endopeptydaz należą pepsyna zawarta w soku żołądkowym
oraz trypsyna, chymotrypsyna i elastaza zawarte w soku trzustkowym.
Białka zawarte w pokarmie ulegają trawieniu dopiero w żołądku, ponieważ w ślinie brak enzy-
mów proteolitycznych. Pod wpływem pokarmu wydziela się hormon polipeptydowy – gastryna – po-
budzający sekrecję kwasu solnego. pH treści żołądkowej spada wówczas poniżej 2, co jest konieczne
do przejścia pepsynogenu w aktywną pepsynę. Dopiero po przejściu masy pokarmowej do dwunastni-
cy wydzielanie gastryny i HCI zostaje zahamowane. Wydzielanie soku trzustkowego jest pobudzane
przez dwa inne hormony polipeptydowe: sekretynę, która wpływa na wzrost pH w dwunastnicy do
około 7,5, oraz pankreozyminę, która zwiększa wydzielanie proenzymów przez komórki trzustki.
Pierwszym enzymem trawiącym białka jest pepsyna, która hydrolizuje wszystkie białka oprócz włó-
kienkowych i niektórych glikoprotein oraz białek silnie zasadowych, jak histony czy protaminy. Pep-
syna jest wytwarzana przez komórki główne żołądka i hydrolizuje wiązania peptydowe wytworzone
przez aminokwasy aromatyczne lub diakarboksylowe. U niemowląt występuje enzym podpuszczka
(rennina), która w obecności wapnia przekształca kazeinę w parakazeinę, na którą działa pepsyna.
Zapobiega to szybkiemu przechodzeniu mleka z żołądka do jelit. Ostatecznym produktem działania
pepsyny są peptony – duże peptydy, przedostające się z żołądka do dwunastnicy. W dwunastnicy – pod
wpływem działania trypsyny, chymotrypsyny i elastazy – łańcuchy peptydowe zostają rozbite do
oligopeptydów i wolnych aminokwasów. Dalej pod wpływem działania karboksypeptydaz, amino-
peptydaz i dipeptydaz następuje całkowita hydroliza do aminokwasów, które zostają wchłonięte do
krwi.
Resorpcja aminokwasów ma miejsce przede wszystkim w jelicie cienkim i odbywa się poprzez
transport aktywny. Wchłonięte w jelicie cienkim aminokwasy przedostają się do krwi żyły wrotnej i są
częściowo gromadzone przez wątrobę. Krążąc we krwi wychwytywane są również przez inne narządy
i tkanki z różną szybkością, magazynują je zwłaszcza nerki. Dalsze wykorzystanie aminokwasów
polega głównie na wprowadzeniu ich w procesy syntezy białek strukturalnych, enzymatycznych i hor-
monalnych, które ulegają zużyciu w trakcie przebiegu procesów biologicznych.

Część I. Zarys przemian biochemicznych
22
Białka wewnątrzkomórkowe rozkładane są po połączeniu z ubikwityną. Istnieją dwa szlaki pro-
teolizy wewnątrzkomórkowej. Białka długożyjące są degradowane w lizosomach, pod wpływem ka-
tepsyn w procesach niezależnych od ATP. Białka nieprawidłowe, krótkożyjące, rozkładane są w szla-
ku pozalizosomalnym, występującym głównie w cytosolu, mitochondriach i jądrze komórkowym
w procesach ATP-zależnych. Ich rozkład zachodzi z udziałem kompleksu wieloenzymatycznego zwa-
nego proteasomem.
2.4. Czynniki regulujące metabolizm białkowy
Najważniejszym czynnikiem jest właściwe zaopatrzenie ustroju w białkowe składniki pokarmo-
we. Ważne jest również dostarczenie odpowiedniej ilości składników energetycznych, tj. cukrów i tłu-
szczów. Ich wzrost zawsze prowadzi do zatrzymania azotu w ustroju, niedobór zaś powoduje ujemny
bilans azotowy. Obok składników pokarmowych ważnym czynnikiem jest działanie hormonalne.
Głównym czynnikiem utrzymującym równowagę syntezy i rozpadu białek w mięśniach szcze-
gólnie szkieletowych jest insulina. Pobudza ona syntezę, a hamuje rozpad białek mięśni, zwiększając
jednocześnie napływ aminokwasów do mięśni. Szczególnie dotyczy to aminokwasów egzogennych,
zwłaszcza o łańcuchu rozgałęzionym. Insulina zmniejsza również syntezę mocznika i wydalanie azotu,
powodując dodatni bilans azotowy.
Na przemianę białek w mięśniach szkieletowych wpływa przede wszystkim tyroksyna. Działa-
nie tyroksyny jest zróżnicowane. W stężeniach fizjologicznych pobudza zarówno syntezę, jak i rozpad
białek. W dużych stężeniach (np. w chorobie Basedowa) przyspiesza oksydację aminokwasów, co pro-
wadzi do ujemnego bilansu azotowego.
Somatotropina (hormon wzrostu) powoduje zwiększenie zawartości białka, we wszystkich
tkankach ustroju. Pobudza syntezę białek szczególnie mięśni, obniżając zarazem zdolność odkładania
tłuszczów. Pod wpływem hormonu wzrostowego zmniejsza się wydalanie azotu z moczem oraz male-
je stężenie wolnych aminokwasów osocza. Wzrost zawartości białek, szczególnie mięśni, powoduje
również testosteron. Oba te hormony odgrywają rolę przede wszystkim w okresie wzrostu i rozwoju
organizmu. Glukagon i glikokortykosteroidy działają przeciwnie.
Glukokortykoidy (glikokortykosteroidy) działają katabolitycznie na mięśnie i anabolicznie na
wątrobę. W mięśniach hamują syntezę białek zmniejszając stężenie RNA i jednocześnie nasilają roz-
pad białek. W wątrobie zwiększają syntezę RNA pobudzając przez to syntezę białek. Glukagon, nie-
mający receptorów mięśniowych, działa wyłącznie na wątrobę, wpływając przede wszystkim na szyb-
kość rozpadu białek. Zwiększa również wychwyt wątrobowy aminokwasów, zwłaszcza alaniny, co
nasila proces glukoneogenezy i urogenezy. Zarówno glukagon, jak i glikokortykosteroidy zwiększają
wydalanie azotu i działają w kierunku ujemnego bilansu azotowego.
2.5. Metabolizm aminokwasów
Aminokwasy ulegają trzem typom przemian:
− deaminacji, podczas której tracą grupę aminową,
− transaminacji, polegającej na przeniesieniu grupy aminowej na odpowiedni ketokwas,
− dekarboksylacji, podczas której tracą grupę karboksylową.
Deaminacja oksydacyjna przebiega najintensywniej w wątrobie i nerkach. W tkankach tych wy-
stępują dwa enzymy deaminujące należące do oksydoreduktaz: oksydaza L-aminokwasowa z koenzy-
mem FMN, działająca tylko na aminokwasy szeregu konfiguracyjnego L, oraz oksydaza D-aminokwa-
sowa z koenzymem FAD, która działa jedynie na D-aminokwasy, powodując utlenienie D-aminokwa-
sów pochodzących z otoczek bakteryjnych oraz powstających w śladowych ilościach w trakcie biosyn-
tez aminokwasowych. Oksydaza D-aminokwasowa bierze również udział w utlenianiu glicyny do
kwasu glioksalowego.
Mechanizm działania obu oksydaz jest dwuetapowy. W pierwszym zachodzi utlenianie grupy
aminowej do iminowej, a atomy wodoru są przenoszone na nukleotydy flawinowe. Akceptorem wodo-
ru ze zredukowanego nukleotydu flawinowego jest tlen cząsteczkowy, w wyniku czego powstaje nad-
tlenek wodoru H
2
O
2
, natychmiast rozkładany przez katalazę. W etapie drugim powstały iminokwas
ulega spontanicznej hydrolizie do odpowiedniego α-ketokwasu i jonu amonowego.

2. Białka
23
Oksydazy należą do enzymów o małej aktywności molekularnej, jedynym enzymem deaminu-
jącym, który jest bardzo aktywny i ma największe znaczenie dla procesu usuwania grup α-aminowych
z aminokwasów, jest dehydrogenaza glutaminianowa. Występuje ona wewnątrzmitochondrialnie,
przede wszystkim w wątrobie. Dehydrogenaza glutaminianowa pochodząca z wątroby jest enzymem
allosterycznym, regulatorowym, hamowanym przez ATP, GTP i NADH, natomiast aktywowanym
przez ADP i GDP, dlatego też zmniejszenie stężenia związków wysokoenergetycznych przyspiesza
utlenianie aminokwasów. Aktywność enzymu w nerce wynosi 20%, a w mózgu 5% aktywności wą-
trobowej. Mechanizm działania enzymu jest podobny jak w przypadku oksydaz, z tym że akceptorem
wodoru jest NAD. Zredukowany NAD przekazuje wodory na łańcuch oddechowy, w wyniku czego
powstają 3 cząsteczki ATP. Reakcja katalizowana przez dehydrogenazę glutaminianową jest reakcją
odwracalną. W tym przypadku konieczna jest obecność NADPH (łączność z cyklem pentozofosfora-
nowym). Wysoka aktywność molekularna dehydrogenazy glutaminianowej, przy niskiej aktywności
oksydaz dowodzi, że większość aminokwasów przekazuje swoją grupę α-aminową w procesie transa-
minacji na α-ketoglutaran. Powstały glutaminian zostaje ponownie utleniony do α-ketoglutaranu pod
wpływem dehydrogenazy glutaminianowej. Proces ten nosi nazwę transdeaminacji i jest to główna
droga pozbywania się grup α-aminowych aminokwasów.
Zarówno w procesie deaminacji, jak i transdeaminacji powstaje szkodliwy dla ustroju amoniak.
Ustrój dysponuje trzema drogami jego wydalania: poprzez syntezę kwasu glutaminowego, biosyntezę
glutaminy i wytworzenie mocznika.
Synteza kwasu glutaminowego jest odwróceniem reakcji katalizowanej przez dehydrogenazę
glutaminianową. Biosyntezę glutaminy katalizuje syntetaza glutaminowa – enzym szeroko rozpo-
wszechniony, zwłaszcza w wątrobie, nerkach i mózgu. Biosynteza glutaminy jest szczególnie ważna
dla tkanki mózgowej, gdyż jest to główny mechanizm usuwania amoniaku. Szkodliwy amoniak uwal-
niany podczas deaminacji aminokwasów, np. przy intensywnej pracy umysłowej, jest tą drogą neutra-
lizowany do glutaminy. Innym zadaniem glutaminy w ustroju jest przekazanie azotu grupy amidowej
do wielu syntez, np. nukleotydów purynowych i pirymidynowych oraz aminocukrów. Glutamina sta-
nowi również pewną rezerwę azotową o znacznej ruchliwości metabolicznej. W przeciwieństwie do
kwasu glutaminowego glutamina posiada znacznie większą zdolność penetrowania błon komórko-
wych i łatwo przenika z krwi i płynu mózgowo-rdzeniowego do komórek, zwłaszcza mózgu. Stanowi
więc formę transportową kwasu glutaminowego w ustroju.
Uwolnienie azotu amidowego glutaminy w postaci amoniaku jest wynikiem hydrolitycznego
odszczepienia amoniaku katalizowanego przez glutaminazę. Glutaminaza występująca w dużych ilo-
ściach w komórkach nerkowych odgrywa ważną rolę w utrzymaniu równowagi kwasowo-zasadowej.
Hydroliza glutaminy ochrania również ustrój przed nadmierną utratą jonów sodowych. Analogiczne
reakcje katalizuje syntetaza asparaginowa i asparaginaza, jednakże znaczenie tych reakcji dla organi-
zmu jest o wiele mniejsze. Zarówno asparaginazę, jak i glutaminazę stosuje się jako czynniki przeciw-
nowotworowe, gdyż pewne nowotwory wykazują nieprawidłowo duże zapotrzebowanie na glutaminę
i asparaginę.
Wytworzenie mocznika (urogeneza) jest procesem detoksykacji amoniaku zachodzącym
w komórkach wątrobowych. Oprócz deaminacji aminokwasów duże ilości amoniaku powstają rów-
nież w wyniku deaminacji zasad purynowych (adeniny i guaniny) oraz zasad pirymidynowych (cyto-
zyny), a także hydrolizy amidów (glutaminy i asparaginy). Detoksykacja amoniaku w cyklu moczni-
kowym jest procesem bardzo ważnym, gdyż nawet znikome ilości amoniaku są toksyczne dla ośrod-
kowego układu nerwowego. Do objawów zatrucia amoniakiem należą drgawki, bełkotliwa mowa,
upośledzenie ostrości widzenia, a w ciężkich przypadkach śpiączka i zgon. Mocznik syntetyzowany
w cyklu mocznikowym w wątrobie, jako związek nietoksyczny, dobrze rozpuszczalny, wydzielany
jest do krwiobiegu, filtrowany przez nerki i wydalany z moczem. Cykl mocznikowy składa się z pię-
ciu reakcji enzymatycznych, z których dwie pierwsze – synteza karbamoilofosforanu i przeniesienie
go na ornitynę – zachodzą w mitochondrium, natomiast powstała cytrulina przechodzi do cytoplazmy,
gdzie zachodzą kolejne trzy reakcje. Niewielkie ilości mocznika powstają także poza wątrobą, np.
w mózgu lub w nerce. W narządach tych występuje enzym – arginaza – rozkładający argininę do
mocznika i ornityny. Proces ten nie ma znaczenia w detoksykacji amoniaku, lecz dostarcza ornitynę,
która może być wykorzystana w cyklu mocznikowym lub w biosyntezie poliamin. W kłębuszkach ner-

Część I. Zarys przemian biochemicznych
24
kowych mocznik ulega całkowitej filtracji do przesączu pierwotnego, a w kanalikach nerkowych oko-
ło 40% przesączonego mocznika ulega resorpcji na zasadzie biernej dyfuzji.
NH
3
+ CO
2
+ 2ATP
karbamoilofosforan
cytrulina
argininobursztynian
asparaginian
arginina
fumaran
ornityna
mocznik
Ryc. 8. Cykl mocznikowy
Stężenie mocznika we krwi jest ważnym wskaźnikiem wydolności nerek. Jego wzrost we krwi
i jednoczesny spadek w moczu mają miejsce w chorobach przebiegających z uszkodzeniem kłębusz-
ków nerkowych. W przypadku ostrej niewydolności nerek stężenie mocznika we krwi osiąga bardzo
szybko wysokie wartości 700–900 mg/dl, w schorzeniach przewlekłych wzrost jest stopniowy, sięga-
jąc 300–400 mg/dl. Obniżony poziom mocznika we krwi świadczy o niewydolności wątroby spowo-
dowanej różnymi czynnikami (np. zatruciem tetrachlorkiem węgla, pozapalnym uszkodzeniem wątro-
by). Do prawidłowej urogenezy wystarcza od 1/8 do 1/5 części zdrowego miąższu wątroby. Urogene-
za jest procesem niekorzystnym z punktu widzenia energetycznego, gdyż w efekcie wydalania tok-
sycznego amoniaku zostają zużyte 4 cząsteczki ATP. Grupy aminowe mocznika pochodzą: jedna
z asparaginianu, druga z procesów deaminacji zachodzących w wątrobie i nerce, z których jest dostar-
czana do miejsc syntezy mocznika jako grupa amidowa glutaminy.
Transaminacja jest najczęściej pierwszym etapem rozkładu aminokwasów. Polega ona na
przenoszeniu grup aminowych z aminokwasów na odpowiednie ketokwasy. Głównym akceptorem
grup aminowych jest α-ketoglutaran, a poza nim pirogronian i szczawiooctan. Reakcje transaminacji
poprzez te ketokwasy stanowią ważne powiązanie między przemianami białkową i cukrową, zwła-
szcza z końcowym etapem ich rozkładu w cyklu Krebsa. Reakcje transaminacji katalizują aminotrans-
ferazy, są one odwracalne, a więc biorą udział zarówno w katabolizmie, jak i biosyntezie aminokwa-
sów. Koenzymem aminotransferaz jest pochodna witaminy B
6
– fosforan pirydoksalu, który poprzez
swoją grupę aldehydową łączy się z grupą aminową aminokwasu, dając zasadę Schiffa. Aminotransfe-
razy są enzymami, które łatwo przechodzą z komórki do krwi w razie uszkodzenia danego narządu,
przez co znajdują zastosowanie w diagnostyce laboratoryjnej. Szczególnie dotyczy to aminotransferaz:
alaninowej (ALT) i asparaginowej (AST).
W wyniku dekarboksylacji aminokwasów powstają aminy biogenne. Wiele z nich przejawia
działanie farmakologiczne, niektóre są prekursorami hormonów, koenzymów lub innych biologicznie
ważnych związków. Po dekarboksylacji seryny powstaje etanolamina (kolamina), z niej zaś – po me-
tylacji – cholina. Są to składniki fosfolipidów: kefalin i lecytyn. Cysteina po dekarboksylacji daje cy-
staminę, która wchodzi w skład CoA i odgrywa w nim najważniejszą rolę, gdyż poprzez siarkę koen-
zym łączy się z rodnikami acylowymi. Kwas asparaginowy po dekarboksylacji daje β-alaninę –
składnik dipeptydów mięśni karnozyny i anseryny biorący udział w skurczu mięśnia, a ponadto wystę-
pujący w kwasie pantotenowym oraz koenzymie A. Kwas glutaminowy po dekarboksylacji przechodzi
w kwas γ-aminomasłowy (GABA), który w dużych ilościach występuje w mózgu, pełniąc rolę neuro-
mediatora.

2. Białka
25
Zarówno reakcje deaminacji, jak i dekarboksylacji, katalizowane głównie przez enzymy pocho-
dzenia bakteryjnego, są podstawą procesów gnilnych zachodzących w produktach białkowych, np.
w mięsie. Produktami tych procesów są amoniak pochodzący z deaminacji oraz aminy o nieprzyjem-
nym zapachu. Do najbardziej charakterystycznych produktów gnilnych należą związki powstałe po
dekarboksylacji aminokwasów zasadowych ornityny i lizyny – putrescyna i kadaweryna, mające
właściwości toksyczne dla zwierząt. Wchodzą one również w skład rybosomów, a putrescyna jest
pierwszym elementem podziałów komórkowych. Kondensacja putrescyny z produktem dekarboksyla-
cji S-adenozylometioniny prowadzi do powstania sperminy i spermidyny. Występują one w ryboso-
mach, płynie nasiennym oraz tkankach nowotworowych. Posiadają ładunki dodatnie, które wiążą się
z poliaminami, szczególnie z kwasami nukleinowymi, stabilizując drugorzędową strukturę DNA oraz
pętlowe odcinki RNA, pełniąc rolę inhibitorów degradacji mRNA, rRNA i tRNA. Aktywują biosynte-
zę zarówno DNA, jak i RNA oraz stymulują acetylację histonów, modyfikując jądrową chromatynę.
Histamina powstaje w wyniku dekarboksylacji histydyny i pełni w organizmie wiele ról. Jest
głównym mediatorem w procesach alergicznych, pobudza wydzielanie soku żołądkowego, a w ukła-
dzie nerwowym pełni rolę klasycznego neuroprzekaźnika. Jej wpływ na układ krążenia jest całkowicie
odmienny w przypadku działania ośrodkowego i obwodowego. Działając ośrodkowo histamina wy-
wołuje wzrost ciśnienia tętniczego krwi, a obwodowo powoduje rozszerzenie naczyń krwionośnych,
spadek ciśnienia tętniczego krwi oraz zwiększenie przepuszczalności naczyń włosowatych (powsta-
wanie obrzęków, bąbli i innych zmian skórnych, przechodzenie płynu i białek do przestrzeni
zewnątrzkomórkowej).
Największe znaczenie w metabolizmie mają aminy powstałe z aminokwasów aromatycznych.
Po dekarboksylacji tyrozyny powstaje tyramina, lecz ważniejsze są aminy powstałe po dekarboksyla-
cji utlenionej tyrozyny, czyli dihydroksyfenyloalanina (DOPA). Powstała dopamina ulega utlenieniu
do noradrenaliny, która po metylacji daje adrenalinę. Te trzy aminy nazywamy katecholowymi. Do-
pamina, szczególnie w dużych ilościach, występuje w mózgu, jej nadmiar stwierdza się w schizofrenii,
a niedobór w chorobie Parkinsona. Jest również mediatorem synaptycznym w obwodowych i ośrodko-
wych neuronach adrenergicznych. Rozszerza naczynia wieńcowe i nerkowe.
Noradrenalina powstaje w rdzeniu nadnerczy i w zakończeniach noradrenergicznych. Jest neuro-
przekaźnikiem w ośrodkowym układzie nerwowym. Wyzwala skurcz mięśni gładkich poprzez otwar-
cie kanałów wapniowych, co powoduje wzrost ciśnienia krwi, przyspieszenie akcji serca oraz posze-
rzenie światła oskrzeli.
Adrenalina powstaje przede wszystkim w rdzeniu nadnerczy i również jest neuroprzekaźnikiem
w ośrodkowym układzie nerwowym. Podobnie jak noradrenalina, zwęża naczynia obwodowe, podnosi
ciśnienie tętnicze, przyśpiesza czynność serca, rozluźnia mięśnie gładkie przewodu pokarmowego
i oskrzeli, ponadto rozszerza źrenice.
Bodźcem do uwalniania katecholamin z rdzenia nadnerczy są np. praca fizyczna, zimno, gorąco,
hipoglikemia, ból, niedobór tlenu, spadek ciśnienia krwi, stres. Ważnym zadaniem katecholamin w sy-
tuacji stresowej jest mobilizacja zgromadzonej energii (lipo- i glikogenolizy) oraz zwiększenie pobie-
rania glukozy przez komórki. Podczas reakcji alarmowej katecholaminy pobudzają w podwzgórzu
wydzielanie hormonów ACTH i przez to glukokortykoidów.
Z tryptofanu po dekarboksylacji powstaje tryptamina, lecz podobnie jak w przypadku tyrozyny
większe znaczenie w metabolizmie ma produkt dekarboksylacji utlenionego tryptofanu – serotonina.
Odgrywa ona rolę neuroprzekaźnika regulującego wiele funkcji życiowych, takich jak: sen, czuwanie,
ciśnienie krwi, percepcja bólu. Przypuszcza się również, że bierze udział w patogenezie depresji, lęku
oraz uzależnień, a ponadto migren i innych bólów głowy oraz astmy oskrzelowej.
2.6. Przemiany aminokwasów
Po odszczepieniu grupy aminowej i karboksylowej aminokwasy przekształcają się w szkielety
węglowodorowe, które bezpośrednio (kwas glutaminowy i asparaginowy) lub pośrednio włączają się
do cyklu Krebsa, gdzie następuje ich całkowita degradacja. Aminokwasy możemy podzielić na gluko-
genne, ketogenne i glukoketogenne. Aminokwasy glukogenne przekształcają się w szczawiooctan
i w procesie glukoneogenezy mogą odtworzyć glukozę. Aminokwasy ketogenne rozpadają się do ace-

Część I. Zarys przemian biochemicznych
26
tooctanu, który ulega redukcji do β-hydroksymaślanu lub dekarboksylacji do acetonu, a więc tworzą
ciała ketonowe.
Metabolizm aminokwasów aromatycznych (fenyloalaniny, tyrozyny i tryptofanu) prowadzi do
powstania bardzo ważnych dla ustroju związków. Jedyny prawidłowy metabolizm fenyloalaniny za-
chodzi poprzez tyrozynę, która posiada grupę hydroksylową. Wprowadzenie jej katalizuje enzym hy-
droksylaza fenyloalaninowa, której wrodzony brak jest przyczyną fenyloketonurii. Jest to najczęstsze
zaburzenie metaboliczne (1:10 000 urodzeń). Nadmiar fenyloalaniny przenika do ośrodkowego układu
nerwowego, zaburza transport dokomórkowy aminokwasów, cholesterolu i glukozy, hamuje biosynte-
zę neuromediatorów (dopaminy, noradrenaliny i serotoniny) oraz melanin. Fenyloalanina nie mogąc
przejść w tyrozynę przekształca się w fenylopirogronian, a następnie w fenylomleczan i fenylooctan.
Związki te wydalane są w dużych ilościach z moczem, nadając mu charakterystyczny mysi zapach,
przechodzą również do krwi, prowadząc do upośledzenia umysłowego.
Tyrozyna oprócz udziału w biosyntezie amin katecholowych uczestniczy również w syntezie hor-
monów tarczycy – tyroksyny i trijodotyroniny. W tarczycy występuje białko – tyreoglobulina – po-
siadające wiele reszt tyrozylowych ulegających łatwo jodowaniu. Utlenienie tyrozyny do dihydroksy-
fenyloalaniny (DOPA) może prowadzić do powstania indochinonu, który polimeryzuje tworząc mela-
ninę, barwnik skóry i włosów. Upośledzona synteza melanin prowadzi do albinizmu, którego obja-
wem są jasne włosy, blada skóra i pozbawione naturalnej barwy tęczówki.
W czasie katabolizmu tyrozyny powstaje kwas homogentyzynowy. W przypadku wrodzonego
niedoboru enzymu, który go przekształca, występuje alkaptonuria. Jest to najwcześniej opisane
(XVI w.) zaburzenie metaboliczne. Charakteryzuje się ono ciemnieniem moczu na powietrzu na sku-
tek polimeryzacji utlenionego homogentyzynianu. Reakcje te zachodzą również w tkankach powodu-
jąc ich ciemnienie (ochronoza), co jest szczególnie widoczne w tkance chrzęstnej. Tyrozyna jest ami-
nokwasem glukoketogennym, gdyż produktami katabolizmu są fumaran wchodzący do cyklu Krebsa
(glukogenny) i acetooctan będący prekursorem ciał ketonowych (ketogenny).
W wielu przemianach w komórce uczestniczy również tryptofan. Powstająca z niego serotoni-
na ulega acetylacji i metylacji, dając melatoninę. Jest to hormon szyszynki odpowiedzialny za rytm
dobowy dnia. W czasie katabolizmu tryptofanu uwalnia się grupa formylowa, uczestnicząca w biosyn-
tezie puryn i pirymidyn, a następnie alanina. Po pęknięciu pierścienia aromatycznego tor metaboliczny
tryptofanu ulega rozdwojeniu. Jedna droga prowadzi do powstania kwasu nikotynowego, którego
amid bierze udział w budowie NAD-u, druga daje końcowy produkt katabolizmu – acetooctan. Tryp-
tofan, jak wszystkie aminokwasy aromatyczne, jest glukoketogenny – poprzez alaninę glukogenną,
a acetooctan ketogenny. Oprócz tryptofanu dawcami grup jednowęglowych do biosyntezy puryn (C
2
i C
8
) i pirymidyn (grupa metylowa tyminy) są histydyna, treonina, seryna i glicyna.
Znaczącą rolę w metabolizmie poza aminokwasami aromatycznymi odgrywają również amino-
kwasy siarkowe. Metionina po reakcji z ATP przechodzi w S-adenozylometioninę, która jest najważ-
niejszym związkiem metylującym w organizmie. Labilna grupa metylowa (CH
3
) z łatwością przecho-
dzi na inny akceptor. Z udziałem „aktywnej metioniny” powstają tak ważne związki, jak: melatonina,
adrenalina, anseryna, karnityna, cholina, sarkozyna i betaina. Z metioniny powstaje cysteina uczestni-
cząca w budowie α-keratyn włosów, glutationu, koenzymu A i aktywnego siarczanu, tworzącego sul-
foglicerolipidy i estry siarczanowe steroidów. Utlenienie siarki w cysteinie prowadzi do powstania
kwasu cysteinosulfinowego, który po dekarboksylacji daje taurynę budującą kwasy żółciowe (tauro-
cholan, taurochenodeoksycholan). Cysteina pełni również rolę detoksykacyjną. Jest dawcą siarki
w procesie odtruwania cyjanków z wytworzeniem rodanków, może również wiązać się z ksenobioty-
kami (substancje obce), biorąc udział w ich metabolizmie.
Aminokwasem o najprostszej budowie, biorącym udział w wielu biosyntezach jest glicyna.
Wchodzi w skład wielu białek, głównie włókienkowych ze względu na małą cząsteczkę. W kolagenie
stanowi 33% ogółu aminokwasów. Wraz z cysteiną i kwasem glutaminowym buduje glutation stano-
wiący naturalny układ oksydoredukcyjny. Cała cząsteczka glicyny wchodzi w skład pierścienia pury-
nowego. Wiążąc się z kwasami żółciowymi tworzy kwasy glikocholowe i glikochenodeoksycholowe,
przyczyniając się do zwiększenia ich części hydrofilowej. W cyklu glicynowo-bursztynowym glicyna
łączy się z metabolitem cyklu Krebsa – sykcynylo-CoA, dając początek biosyntezie porfiryn (hemu).

2. Białka
27
Bierze również udział w procesie odtruwania, łącząc się z kwasami aromatycznymi, np. benzoesowym
(konserwant dodawany do żywności), tworząc kwas hipurowy łatwo wydalany z moczem.
Glicyna z argininą i metioniną wykorzystywane są do biosyntezy kreatyny. Proces ten zachodzi
w wątrobie i nerkach. Powstała kreatyna przechodzi do krwi i jest wychwytywana przez mięśnie,
gdzie ulega odwracalnej fosforylacji do fosfokreatyny w reakcji katalizowanej przez kinazę kreatyno-
wą (CK). Fosfokreatyna jest głównym zapasem energetycznym dla mięśni wykorzystywanym przy
niedoborze tlenu do szybkiej resyntezy ATP. Po odszczepieniu cząsteczki wody z fosfokreatyny po-
wstaje kreatynina. Proces ten zachodzi w mięśniach, kreatynina przechodzi do krwi, a następnie do
moczu. Kreatynina jest czułym wskaźnikiem uszkodzenia nerek. Przy niewydolności nerek jej stężenie
w osoczu krwi wzrasta wielokrotnie.
P i ś m i e n n i c t w o
1. Bańkowski E. Biochemia. Podręcznik dla studentów uczelni medycznych. Urban & Partner, Wro-
cław 2004, s. 1–42, 296–363.
2. Ćwiczenia praktyczne z biochemii. Skrypt dla studentów II roku Wydziału Lekarskiego z Oddziałem
Lekarsko-Dentystycznym. Red. E. Birkner, SUM, Katowice 2008, s. 162–163.
3. Biochemia Harpera ilustrowana. Red. R.K. Murray, D.K. Granner, V.W. Rodwell. Wydawnictwo
Lekarskie PZWL, Warszawa 2008, wyd. 6, s. 17–52, 295–336.

3. CUKRY I ALKOHOLE
Sławomir Kasperczyk, Alina Ostałowska
3.1. Budowa i rola cukrów
Cukry, inaczej węglowodany lub sacharydy, to związki organiczne (wielowodorotlenowe alde-
hydy lub ketony) złożone z węgla, wodoru i tlenu, w których stosunek wodoru do tlenu jest taki sam
jak w wodzie. Są bardzo rozpowszechnione w świecie roślinnym i zwierzęcym. Najważniejszym wę-
glowodanem jest glukoza, syntetyzowana w świecie roślinnym z ditlenku węgla i wody, należąca do
ważniejszych źródeł energii u zwierząt.
Cukry charakteryzują się znacznym zróżnicowaniem wielkości cząsteczek. Wyróżnia się wśród
nich monosacharydy, disacharydy, oligosacharydy i polisacharydy.
Monosacharydy (cukry proste) są najprostszymi cukrami o wzorze sumarycznym (CH
2
O)
n
. Za-
wierają grupę aldehydową (aldoza –CH=O) lub ketonową (ketoza =C=O), które redukują jony mie-
dziowe Cu
2+
do jonów miedziawych Cu
+
, stąd są to cukry redukujące (posiadają wolną grupą glikozy-
dową półacetalową). W zależności od liczby atomów w cząsteczce wyróżnia się: triozy (C3), tetrozy
(C4), pentozy (C5), heksozy (C6) oraz heptozy (C7). Jednocukry charakteryzują się słodkim smakiem,
dobrą rozpuszczalnością w wodzie i brakiem rozpuszczalności w rozpuszczalnikach lipidowych. Jako
łatwo przechodzące przez błony komórkowe u człowieka są transportowane przez krew, jednak ze
względu na rozpuszczalność w wodzie wpływają na ciśnienie osmotyczne komórek, dlatego nie nadają
się na substancje zapasowe. Do najważniejszych pentoz, składników kwasów nukleinowych, zalicza
się rybozę i deoksyrybozę (ketozy). Głównymi heksozami są: glukoza, galaktoza (aldozy) i fruktoza
(ketoza). Glukoza to zasadniczy materiał energetyczny, uczestniczący w budowie disacharydów, sta-
nowiący podstawę budowy większości wielocukrów (skrobia, glikogen). Galaktoza uczestniczy w bu-
dowie laktozy i rafinozy oraz galaktanu (polisacharyd). Fruktoza (cukier owocowy) występuje w nek-
tarze kwiatów i wielu owocach, uczestniczy też w budowie sacharozy.
Disacharydy (dwucukry) powstają z połączenia dwóch monosacharydów za pomocą wiązania
glikozydowego (
α lub β) przy anomerycznym atomie węgla (C
1
w aldozach i C
2
w ketozach). Zazwy-
czaj w wiązanie jest włączony anomeryczny węgiel jednego z dwóch monosacharydów, stąd druga
grupa aldehydowa lub ketonowa ma właściwości redukujące. Do najważniejszych disacharydów zali-
cza się sacharozę, laktozę i maltozę. Sacharoza (połączenie glukozy i fruktozy), inaczej cukier bura-
czany lub trzcinowy, występuje w wielu roślinach, gromadzi się w korzeniach buraka cukrowego
(20%) i źdźbłach trzciny cukrowej (13–20%). Jest cukrem nieredukującym – oba anomeryczne C two-
rzą wspólne wiązanie. Laktoza to połączenie galaktozy i glukozy, występuje jako cukier mlekowy
w mleku ssaków, stanowiąc około 5% jego składu. Maltoza (dwie połączone cząsteczki glukozy), ina-
czej cukier słodowy, występuje w nasionach i polisacharydach (w skrobi i glikogenie). Laktoza i mal-
toza są cukrami redukującymi.
Oligosacharydy to krótkie łańcuchy monosacharydów (3–6) wchodzące w skład glikoprotein
(połączeń cukrów i białek). Zaliczamy do nich np. maltotriozę (3 cząsteczki glukozy) i maltotetrozę
(4 cząsteczki glukozy).
Polisacharydy (wielocukry) są długimi łańcuchami monosacharydów. Mogą być liniowe i roz-
gałęzione. Nie mają właściwości redukujących i są nierozpuszczalne w wodzie. Ze względu na budo-
wę chemiczną dzielą się na homoglikany (wielocukrowce jednoskładnikowe) i heteroglikany (różno-

3. Cukry i alkohole
29
składnikowe). Do homoglikanów zalicza się glikogen, skrobię i celulozę. Glikogen jest gromadzony
w wątrobie i w mięśniach zwierząt, zawiera wyłącznie jednostki glukozowe połączone wiązaniem
α-1,4-glikozydowym, przy czym co około 10 jednostek następuje rozgałęzienie łańcucha poprzez wią-
zanie
α-1,6-glikozydowe. Skrobia to mieszanina dwóch postaci polisacharydów: amylozy (nierozga-
łęziony łańcuch) i amylopektyny (postać rozgałęziona połączona wiązaniem
α-1,4-glikozydowym, co
około 25–30 jednostek następuje rozgałęzienie łańcucha poprzez wiązanie
α-1,6-glikozydowe). Jest
materiałem zapasowym roślin, odkładanym w dużych ilościach w bulwach (ziemniaki) i nasionach
(zboża). Celuloza jest materiałem budulcowym u roślin, natomiast u zwierząt wchodzi w skład błon-
nika pokarmowego. Do heteroglikanów roślinnych należą pektyny i hemicelulozy (są składnikiem
błonnika pokarmowego), zaś do zwierzęcych glikozoaminoglikany (składnik tkanki łącznej).
3.2. Trawienie, wchłanianie i transport cukrów
Najważniejszymi cukrami spożywczymi są skrobia, sacharoza i laktoza. Monosacharydy i gliko-
gen w żywności występują w niewielkiej ilości. Z przewodu pokarmowego wchłaniają się tylko cukry
proste, stąd di-, oligo- i polisacharydy są rozkładane w procesie trawienia. Głównymi miejscami tra-
wienia są jama ustna, dwunastnica i jelito czcze. Do enzymów trawiących cukry zalicza się
α-amyla-
zę, oligosacharydazy i disacharydazy.
Trawienie skrobi i glikogenu rozpoczyna się w jamie ustnej z udziałem amylazy ślinowej. W żo-
łądku następuje wstrzymanie trawienia cukrów, po czym jest ono podejmowane w jelicie cienkim pod
wpływem soku trzustkowego i soku jelitowego. Sok trzustkowy zawiera
α-amylazę trzustkową, która
rozkłada skrobię i glikogen do maltozy, maltotriozy i rozgałęzionych
α-dekstryn (zawierają wiązania
α-1,6-glikozydowe), nierozgałęzionych oliogosacharydów i glukozy. Sok jelitowy (wydzielany przez
gruczoły dwunastnicze i jelitowe) zawiera swoiste oligosacharydazy oraz disacharydazy, do których
zalicza się maltazę i izomaltazę (rozszczepiające odpowiednio wiązania
α-1,4 i α-1,6-glikozydowe),
a także laktazę i sacharazę (rozkładające odpowiednio laktozę i sacharozę). Celuloza zawarta w poży-
wieniu nie ulega trawieniu w przewodzie pokarmowym człowieka ze względu na obecność w budowie
wiązań β-glikozydowych, których nie rozkłada α-amylaza. Najczęstszym zaburzeniem w trawieniu
węglowodanów jest niedobór laktazy, przejawiający się nietolerancją laktozy. Po spożyciu mleka nie-
strawiona laktoza przechodzi do jelita grubego, powodując wzrost ciśnienia osmotycznego treści jelita
grubego i następowe przemieszczenie wody do światła jelita, co objawia się biegunką.
Produkty trawienia cukrów pokarmowych, głównie skrobi, glikogenu i disacharydów, w posta-
ci monosacharydów (w największej ilości glukoza, w znacznie mniejszej galaktoza i fruktoza) są
wchłaniane z jelita przy udziale przenośnika białkowego jako wynik aktywnego transportu (glukoza
i galaktoza) lub ułatwionej dyfuzji (fruktoza). Poprzez krew żyły wrotnej wchłonięte cukry przechodzą
do wątroby, gdzie ma miejsce przemiana różnych cukrów prostych na glukozę, a także metabolizm
samej glukozy (ryc. 9).
W wątrobie glukoza jest fosforylowana przy udziale enzymu glukokinazy i ATP do glukozo-6-
-fosforanu (G-6-P), który może wchodzić w różne przemiany wątrobowe, jak glikogenogeneza –
synteza glikogenu, glikoliza – rozpad glukozy oraz cykl pentozofosforanowy. W komórce wątrobo-
wej G-6-P może powstawać z glikogenu (w procesie glikogenolizy) oraz wskutek glukoneogenezy
(biosyntezy z materiałów niecukrowych, takich jak pirogronian, mleczan, niektóre reszty aminokwa-
sowe, glicerol). Po spożyciu posiłku zawierającego węglowodany znaczna ich część jest wychwyty-
wana przez wątrobę, reszta przechodzi do krążenia ogólnego. Glukoza jest zużywana przez tkanki
obwodowe. W komórkach różnych narządów ulega fosforylacji do G-6-P przy udziale heksokinazy
i ATP. Szczególne znaczenie glukoza odgrywa w metabolizmie mózgu, jako jedyny substrat energe-
tyczny dla tkanki mózgowej (oprócz ciał ketonowych) i dla erytrocytów. W tkance tłuszczowej do-
starcza substratów do syntezy triacylogliceroli, odkładanych jako zapasy energii. W mięśniach szkiele-
towych służy do gromadzenia zapasów glikogenu oraz jako źródło energii zarówno w warunkach tle-
nowych (jest całkowicie spalana do ditlenku węgla i wody), jak i beztlenowych (powstaje wówczas
kwas mlekowy) (ryc. 9).
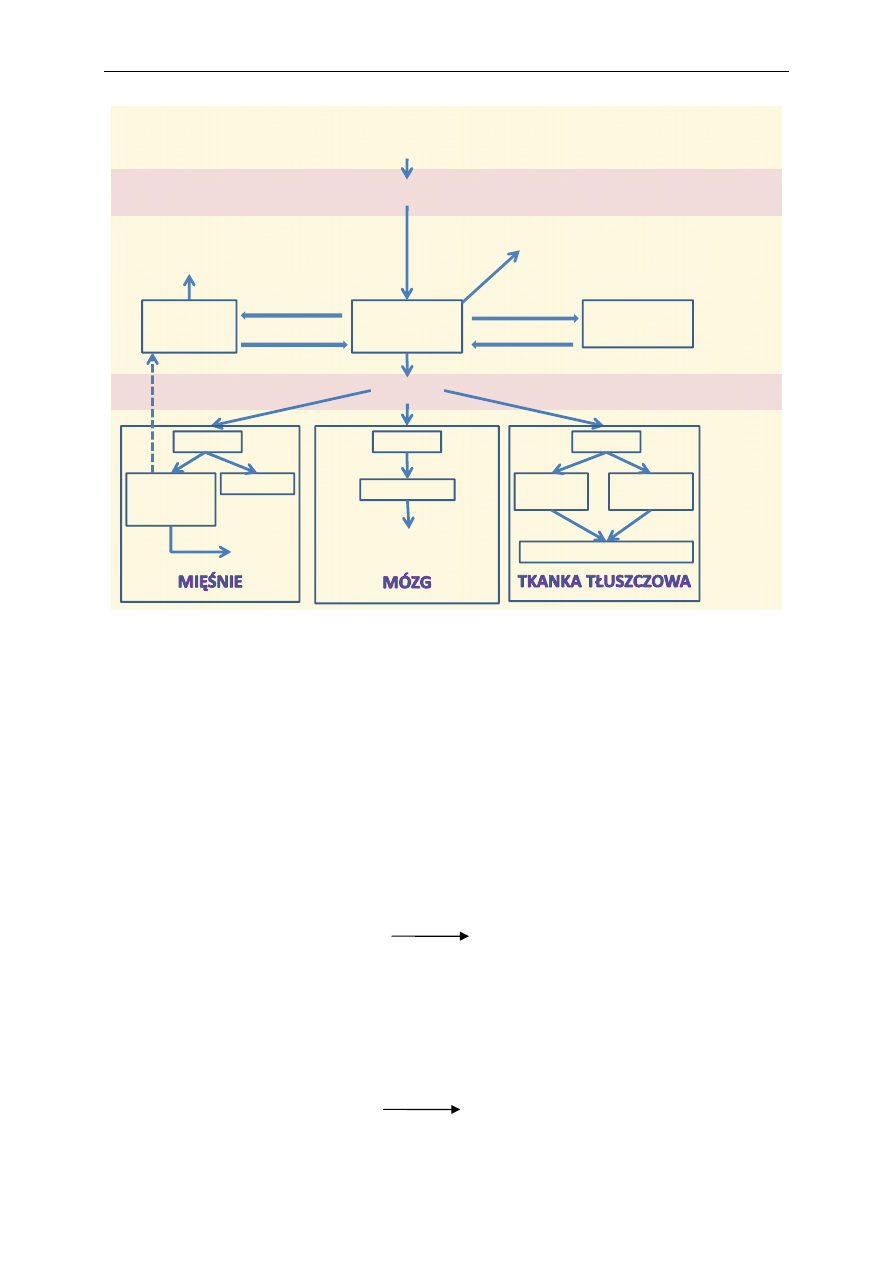
Część I. Zarys przemian biochemicznych
30
jelito
cienkie
w
ątr
ob
a
krew
tk
an
ki
po
za
w
ątr
obow
e
trawienie
skrobi
sacharozy laktozy
i innych cukrów
krew
żyła wrotna
glukoza
,
galaktoza, fruktoza
, inne monocukry
G‐6‐P
(glukozo‐6‐fosforan)
glukoza
glikogen
glikogenogeneza
glikogenoliza
glikoliza
glukoneogeneza
cykl
pentozofosforanowy
pirogronian
mleczan
cykl Krebsa + łańcuch
oddechowy – synteza ATP
G‐6‐P
G‐6‐P
G‐6‐P
pirogronian
cykl Krebsa + łańcuch oddechowy
– synteza ATP
glicerol
kwasy
tłuszczowe
triacyloglicerol (tłuszcz)
glikogen
pirogronian
mleczan
cykl Krebsa
+ łańcuch
oddechowy
– synteza
ATP
Ryc. 9. Przemiany glukozy i innych węglowodanów w organizmie człowieka (G-6-P – glukozo-6-fosforan)
Glukoza krążąc we krwi, przedostaje się przez filtr nerkowy do moczu pierwotnego, skąd jest
resorbowana przez komórki cewek nerkowych i zawracana do krwi. Fizjologiczny mocz nie zawiera
glukozy, pojawia się w nim dopiero po przekroczeniu progu nerkowego (160–180 mg/dl, 9–10 mmol/l).
3.3. Przemiany cukrów
3.3.1. Glikoliza
Glikoliza to katabolizm (degradacja) glukozy zachodzący w cytosolu wszystkich komórek.
W glikolizie jedna cząsteczka glukozy w szeregu przemian chemicznych jest przekształcana w 2 czą-
steczki pirogronianu (ryc. 10). Produkt wyjściowy glikolizy stanowi G-6-P powstający drogą fosfory-
lacji glukozy, dostarczanej z osocza, a w wątrobie i mięśniach także z glukozo-1-fosforanu produktu
rozpadu glikogenu. Glikoliza jest kontrolowana przez ponad dziesięć enzymów, wśród których istotną
rolę odgrywają enzymy odpowiedzialne za katalizowanie reakcji nieodwracalnych (glukokinaza, hek-
sokinaza, fosfofruktokinaza, kinaza progronianowa).
1 cz. glukozy
2 cz. pirogronianu
W procesie glikolizy dochodzi do przeniesienia energii na równoważnik NAD
+
, który ulega re-
dukcji do NADH + H
+
. W warunkach tlenowych utlenianie NADH następuje w łańcuchu oddecho-
wym w mitochondriach, dostarczając energii. Z utlenienia 1 cząsteczki NADH powstają 3 cząsteczki
ATP.
Produkt glikolizy, pirogronian, zostaje przeniesiony do mitochondrium, gdzie ulega tlenowej
dekarboksylacji, co prowadzi do powstania acetylo~CoA:
pirogronian + NAD
+
+ CoA
acetylo~CoA + NADH + H
+
+ CO
2
Acetylo~CoA jest następnie spalany w cyklu Krebsa.
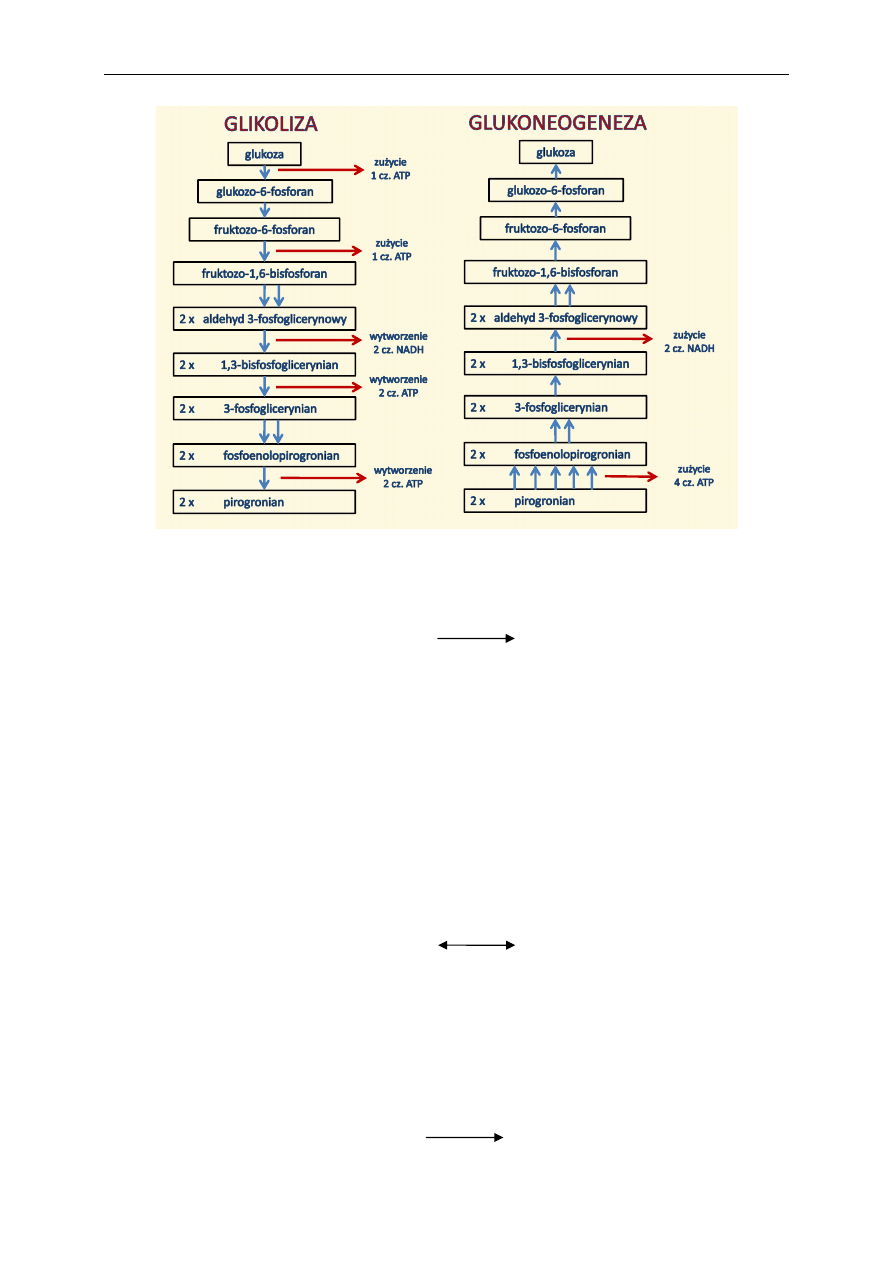
3. Cukry i alkohole
31
Ryc. 10. Schemat glikolizy i glukoneogenezy (niektóre etapy pominięto, cz. – cząsteczka)
Metabolizm glukozy zależy od dostępności tlenu – w jego obecności glukoza ulega całkowite-
mu utlenieniu do wody i ditlenku węgla, co sumarycznie daje reakcję (P
i
– ortofosforan):
C
6
H
12
O
6
+ 6O
2
+ 38ADP + 38 P
i
6CO
2
+ 6H
2
O + 38ATP
W warunkach tlenowych cząsteczka glukozy ulega następującym przemianom: glikoliza tleno-
wa, dekarboksylacja pirogronianu oraz utlenienie acetylo~CoA w cyklu Krebsa. Sumarycznie z 1 czą-
steczki glukozy powstaje 38 cząsteczek ATP przy wykorzystaniu łańcucha oddechowego:
− 8 cząsteczek ATP w glikolizie tlenowej (wytwarzane są bezpośrednio 4 cząsteczki ATP, pozostałe
6 cząsteczek ATP powstaje na łańcuchu oddechowym z utlenienia 2 cząsteczek NADH, natomiast
2 cząsteczki ATP zużywane są na rozpoczęcie glikolizy),
− 6 cząsteczek ATP w oksydacyjnej dekarboksylacji pirogronianu (podczas przemian z jednej czą-
steczki pirogronianu powstaje jedna cząsteczka NADH dająca w łańcuchu oddechowym 3 cząstecz-
ki ATP),
− 24 cząsteczek ATP w cyklu Krebsa przy wykorzystaniu łańcucha oddechowego (patrz rozdział 1.3).
W warunkach beztlenowych katabolizm glukozy przebiega inaczej – do procesu glikolizy po-
trzebny jest utleniony NAD
+
(niezbędny do reakcji z aldehydem 3-fosfoglicerynowym), więc powsta-
jący pirogronian jest przekształcany do mleczanu:
pirogronian + NADH + H
+
mleczan + NAD
+
Reakcję tę katalizuje dehydrogenaza mleczanowa (LDH), enzym powszechnie występujący
w komórkach. Mleczan (kwas mlekowy) podlega swoistemu cyklowi w organizmie człowieka, po
powstaniu w warunkach glikolizy beztlenowej nie gromadzi się w tkankach (np. mięśniach), lecz dy-
funduje do krwi, a następnie z krwią do wątroby, gdzie utlenia się pod wpływem LDH do pirogronia-
nu, który spala się w cyklu Krebsa lub zostaje wykorzystany do glukoneogenezy.
Sumarycznie z glukozy w warunkach beztlenowych powstają 2 cząsteczki kwasu mlekowego
i 2 cząsteczki ATP:
C
6
H
12
O
6
+ 2ADP + 2 P
i
2 C
3
H
6
O
3
+ 2ATP

Część I. Zarys przemian biochemicznych
32
Wytwarzanie energii w glikolizie beztlenowej (2 cząsteczki ATP na 1 cząsteczkę glukozy) jest
znacząco mniejsze niż w warunkach tlenowych (38 cząsteczek ATP na 1 cząsteczkę glukozy).
3.3.2. Glukoneogeneza
Glukoneogeneza jest anaboliczną drogą pozwalającą na tworzenie glukozy z mleczanu, pirogro-
nianu, glicerolu, a także z aminokwasów cukrotwórczych w warunkach deficytu glukozy w organi-
zmie, np. podczas głodówki. Proces ten jest odwróceniem glikolizy (ryc. 10). Glukoneogenezę kontro-
luje ponad dziesięć enzymów, w większości takich samych jak w glikolizie, tylko niektóre (karboksy-
laza pirogronianowa, karboksykinaza fosfoenolopirogronianowa, fruktozo-1,6-bis-fosfataza, glukozo-
-6-fosfataza) uczestniczą w obejściu bariery stworzonej przez kluczowe enzymy glikolizy.
2 pirogronian
glukoza
Wytworzona w tkance wątrobowej wolna glukoza jest wydzielana do krwi. Glukoneogeneza
jest energetycznie niekorzystna i zachodzi głównie w wątrobie.
Glikoliza i glukoneogeneza zachodzą w komórce wątrobowej, jednak nie mogą być równocze-
sne, gdyż wzajemnie się wykluczają: uaktywnienie kluczowych enzymów glikolizy połączone jest
z inaktywacją kluczowych enzymów glukoneogenezy i odwrotnie.
3.3.3. Metabolizm glikogenu
Glikogen jest węglowodanem stanowiącym materiał zapasowy dla wątroby i mięśni, gdzie mają
miejsce biosynteza glikogenu z glukozy (glikogenogeneza) i jej rozpad (glikogenoliza).
Biosynteza glikogenu rozpoczyna się od przekształcenia (izomeryzacji) G-6-P w glukozo-1-fo-
sforan (G-1-P), który jest aktywowany następnie do UDP-glukozy wbudowywanej w cząsteczkę gli-
kogenu. Do wbudowania 1 glukozy w cząsteczkę glikogenu potrzebne są 3 wiązania makroergiczne
(w przeliczeniu na ATP). Biosynteza glikogenu zachodzi głównie w wątrobie i mięśniach.
Rozkład glikogenu towarzyszy wzrostowi zapotrzebowania komórki na glukozę. G-1-P zostaje
odszczepiony i przekształcony w G-6-P, który może wejść w drogę glikolizy (w mięśniach) i dostar-
czyć energię, w wątrobie zaś – pod wpływem glukozo-6-fosfatazy – ulega hydrolizie do cząsteczki
glukozy, wydzielanej do krwi. W czasie głodu glikogenoliza uzupełnia cząsteczki glukozy z rezerw
glikogenu, utrzymując jej stałe stężenie we krwi.
Stężenie glukozy we krwi zwiększają noradrenalina, adrenalina, glukagon, glukokortykoidy,
ACTH oraz hormon wzrostu, natomiast insulina działa obniżająco.
3.3.4. Szlak pentozofosforanowy
Glukoza może spalać się także drogą tlenową w cyklu pentozofosforanowym – G-6-P dostarcza
zredukowanego NADPH, który służy do biosyntezy (np. kwasów tłuszczowych, cholesterolu) oraz
umożliwia tworzenie innych ufosforylowanych cukrów (pentoz, trioz, tetroz i heptoz). Metabolity
cyklu pentozowego w dalszym etapie włączają się w tor glikolizy. Około 40% glukozy metabolizuje
się w cyklu pentozofosforanowym w wątrobie, a około 10% w mięśniach.
3.3.5. Przemiany fruktozy i galaktozy
Fruktoza spożyta z pożywieniem (np. z sacharozy lub miodu) jest transportowana do wątroby,
wchodząc w szlak przemian fruktozo-1-fosforanu lub fruktozo-6-fosforanu. Głównie ulega ona fosfo-
rylacji przez ATP z wytworzeniem fruktozo-1-fosforanu, który po rozłożeniu przez enzym, aldolazę
B, wchodzi w odpowiedni etap glikolizy dostarczając energii. Brak tego enzymu powoduje nietoleran-
cję fruktozy.
Galaktoza pobrana z pokarmem (produkt hydrolizy laktozy) jest transportowana do wątroby
i ulega fosforylacji do galaktozo-1-fosforanu. Związek ten łączy się z urydynodifosforanem (UDP).
Następnie UDP-galaktoza przekształca się w UDP-glukozę (tzw. proces epimeryzacji). Ta ostatnia re-
akcja pozwala na odtworzenie UDP-galaktozy z UDP-glukozy w przypadku zwiększonego zapotrzebo-

3. Cukry i alkohole
33
wania na galaktozę. Zachodzi to podczas laktacji w gruczole mlecznym. Laktoza jest syntetyzowana
z UDP-galaktozy i glukozy:
UDP-galaktoza + glukoza
laktoza + UDP
3.4. Homeostaza glukozy
Głównymi źródłami glukozy we krwi są węglowodany zawarte w pożywieniu oraz rozpad gliko-
genu wątrobowego (glikogenoliza) lub wewnątrzkomórkowa synteza glukozy (glukoneogeneza). Glu-
koza jest metabolizowana w szlaku glikolitycznym oraz pentozofosforanowym lub może być magazy-
nowana w postaci glikogenu. Jej nadmiar jest przekształcany w lipidy. Z przewodu pokarmowego
wchłaniane są tylko monosacharydy: głównie glukoza oraz fruktoza, galaktoza i mannoza.
Stężenie glukozy we krwi zależy od jej ilości przedostającej się z przewodu pokarmowego i wą-
troby oraz pobieranej przez pozostałe tkanki (głównie mózg, mięśnie, tkanka tłuszczowa). Rozpad
glikogenu, biosynteza glukozy (glukoneogeneza) oraz pobieranie glukozy przez tkanki są kontrolowa-
ne hormonalnie. Wzrost stężenia glukozy we krwi powodują: glukagon, glukokortykoidy, ACTH, no-
radrenalina, adrenalina oraz hormon wzrostu (GH). Obniżająco działa insulina, zwiększając odkłada-
nie glikogenu wątrobowego i szybkość przenikania glukozy z płynu zewnątrzkomórkowego do wnę-
trza komórek (tkanka tłuszczowa i mięśniowa). Insulina zwiększa też biosyntezę białek i kwasów
tłuszczowych oraz hamuje wytwarzanie związków ketonowych (ketogenezę) i glukoneogenezę. Wy-
mienione czynniki utrzymują stężenie glukozy we krwi na stałym poziomie, na czczo wynosi ono 3,4–
–5,6 mmol/l (60–100 mg/dl). Ich zaburzenie doprowadza do hipoglikemii i hiperglikemii.
3.5. Hipoglikemia
Hipoglikemia to spadek stężenia glukozy w surowicy krwi poniżej 50 mg/dl (2,8 mmol/l). Stan taki
wynika z przewagi czynników obniżających stężenie glukozy, najczęściej wskutek przedawkowania
insuliny lub doustnych leków przeciwcukrzycowych. Objawy kliniczne są następstwem zaburzenia
funkcjonowania mózgu, dla którego glukoza jest podstawowym źródłem energii. Przebieg hipoglike-
mii może być bezobjawowy lub z objawami nieswoistymi – układowymi, wywołanymi pobudzeniem
współczulnego układu nerwowego (pocenie się, kołatanie serca, przyspieszenia akcji serca, bladość
powłok), neurologicznymi (podwójne widzenie, ból głowy, drgawki) lub psychiatrycznymi (zmiany
osobowości, zaburzenia pamięci). Nieleczona hipoglikemia prowadzi do śpiączki hipoglikemicznej.
Normalizację stężenia glukozy we krwi osiąga się podając ją doustnie lub dożylnie.
3.6. Hiperglikemia i cukrzyca
Cukrzyca to grupa chorób metabolicznych charakteryzujących się hiperglikemią, tj. podwyż-
szonym stężeniem glukozy na czczo
≥ 126 mg/dl (≥ 7 mmol/l), wynikającą z defektu wydzielania i/lub
działania insuliny. Podstawą zaburzeń metabolizmu węglowodanów, a także lipidów i białek jest nie-
dostateczne działanie insuliny na tkanki docelowe lub oporność tych tkanek na insulinę. Bezwzględny
niedobór insuliny prowadzi do znacznej hiperglikemii – przy stężeniu glukozy we krwi przekraczają-
cym wartość progu nerkowego następuje utrata glukozy z moczem. W cukrzycy dochodzi również do
zaburzenia gospodarki lipidowej (wzrostu stężenia kwasów tłuszczowych, lipoprotein oraz związków
ketonowych we krwi) i do kwasicy metabolicznej. Pojawiają się: wielomocz, wzmożone pragnienie
(od kilku do kilkunastu litrów w ciągu doby), gwałtowne chudnięcie, pogorszenie ostrości wzroku
(zmniejszenie napięcia gałek ocznych spowodowane odwodnieniem), zmęczenie, osłabienie, pogor-
szenie koncentracji, bóle brzucha, zaburzenia świadomości, włącznie ze śpiączką.
Wyróżnia się następujące typy cukrzycy:
− cukrzyca typu 1 spowodowana uszkodzeniem komórek β wysp trzustkowych, w następstwie czego
dochodzi do utraty zdolności do syntezy insuliny; chorzy są zazwyczaj szczupli, początek choroby
sięga zwykle dzieciństwa albo młodości, istnieje duża skłonność do powstawania związków keto-
nowych i kwasicy,
− cukrzyca typu 2, której przyczyną jest zmniejszone wydzielanie insuliny (defekt wysp β trzustko-
wych) albo zwiększona odporność na działanie insuliny w tkankach obwodowych (zmniejszony

Część I. Zarys przemian biochemicznych
34
wychwyt glukozy przez te tkanki lub zwiększona synteza glukozy przez wątrobę); chorzy są zwykle
otyli, dotyczy najczęściej osób po 30 roku życia,
− inne postacie, np. cukrzyca wtórna występująca w przebiegu chorób trzustki lub schorzeń endokry-
nologicznych oraz cukrzyca ciężarnych.
Powikłania cukrzycy to choroby naczyń krwionośnych – mikroangiopatie (retinopatia, nefropa-
tia) i makroangiopatie (miażdżyca tętnic pod postacią choroby wieńcowej, udaru mózgowego, miaż-
dżycy tętnic kończyn dolnych i zgorzeli stopy). Do powikłań zalicza się również neuropatię i zmiany
skórne.
3.7. Metabolizm alkoholi (etanolu)
Alkohol etylowy (etanol) powstaje z glukozy w procesie nazywanym fermentacją alkoholową.
Glukoza przekształca się do pirogronianu, który utlenia się do etanolu. Proces taki zachodzi u drożdży
i niektórych mikroorganizmów. Alkohole (etanol) są związkami łatwo ulegającymi absorpcji z prze-
wodu pokarmowego, osiągającymi maksymalne stężenie we krwi po jednorazowej dawce doustnej
w czasie od ½ do 2 godzin, zależnie od treści pokarmowej. W wątrobie etanol jest częściowo utleniany
do aldehydu octowego, który odpowiada za większość niekorzystnych następstw w ustroju, reszta jest
wydalana w formie niezmienionej z moczem i z powietrzem wydechowym (co jest wykorzystywane
do oceny oszacowania zawartości etanolu w krwi).
Ostre i śmiertelne zatrucia etanolem występują po przyjęciu dawki 150–500 g w czasie krót-
szym niż 1 godzina. Istnieją jednak duże różnice indywidualne tolerancji etanolu. Alkohol działa tok-
sycznie poprzez zmniejszenie aktywności ośrodkowego układu nerwowego. Zatrucia ostre występują
przy stężeniu etanolu w zakresie 3–5‰, przekroczenie 5‰ powoduje na ogół zatrucia śmiertelne.
Działanie toksyczne towarzyszące zatruciu jest wywołane przez sam alkohol oraz jego toksyczne me-
tabolity (głównie aldehyd octowy), których akumulacja prowadzi m.in. do kwasicy metabolicznej.
Etanol w ustroju człowieka jest metabolizowany przez dehydrogenazę alkoholową (w około
90%):
etanol + NAD
+
aldehyd octowy + NADH + H
+
Powstały aldehyd octowy jest przekształcany w octan przy udziale dehydrogenazy aldehydo-
wej. Octan ulega przekształceniu w acetylo~CoA, który jest spalany w cyklu Krebsa. Utlenianie eta-
nolu do wody i ditlenku węgla dostarcza relatywnie dużej ilości energii. Przy spaleniu 1 grama etanolu
wytwarzane jest około 7 kcal energii (dla porównania z 1 g węglowodanów lub białek otrzymuje się
około 4 kcal, a z 1 g tłuszczów około 9 kcal). Enzymy dehydrogenaza alkoholowa i aldehydowa wyka-
zują duże zróżnicowanie pod względem aktywności. U niektórych populacji (np. Azji i Ameryki Po-
łudniowej) ich aktywność jest niska, czego konsekwencją jest nietolerancja na etanol.
Wprowadzenie etanolu do organizmu wywołuje zaburzenia metaboliczne – najczęściej w zakre-
sie gospodarki węglowodanowej oraz lipidowej – spowodowane zarówno działaniem samego etanolu,
jak i zmianą stanu oksydacyjno-redukcyjnego w czasie jego utleniania w wątrobie. Alkohol etylowy
najczęściej powoduje hipoglikemię.
Spożycie etanolu, zależnie od zawartości glikogenu w wątrobie, może wywołać zarówno hipo-
glikemię, jak i hiperglikemię. Najczęściej jest to jednak hipoglikemia (szczególnie u osób wyniszczo-
nych, niedożywionych zwykle nadużywających alkoholu etylowego). Przewlekłe stosowanie etanolu
powoduje stłuszczenie wątroby (odkładanie lipidów), zapalenie i w konsekwencji marskość wątroby.
Ponadto może doprowadzić do zapalenia trzustki. Powoduje również zwiększenie stężenia kwasu mo-
czowego we krwi, co może objawić się ostrą dną moczanową. Regularne spożywanie małych ilości
etanolu (do około 20 g na dobę) wpływa jednak korzystnie na profil lipidowy (zwiększenie stężenia
cholesterolu we frakcji HDL i zmniejszenie we frakcji LDL w surowicy krwi), co może mieć ochron-
ne działanie na układ krążenia.
Dehydrogenaza alkoholowa metabolizuje również inne alkohole. Zatrucie metanolem (alkoho-
lem metylowym) lub glikolem powoduje powstanie innych metabolitów niż aldehyd octowy. Produk-
tami przemian metanolu są formaldehyd i kwas mrówkowy, odpowiedzialne za działanie toksyczne.
Gromadzące się kwasy organiczne i proton (H
+
) wywołują stan kwasicy metabolicznej. Obserwuje się
również hipoglikemię. Kwas mrówkowy ulega akumulacji w gałce ocznej, prowadząc do uszkodzenia

3. Cukry i alkohole
35
nerwu ocznego, co często jest przyczyną ślepoty. W wyniku przemian metabolicznych glikolu oprócz
kwasu mrówkowego (i jego następstw w organizmie) powstaje dodatkowo kwas szczawiowy, odpo-
wiedzialny za występowanie ostrej niewydolności nerek w 2–3 dobie po zatruciu.
P i ś m i e n n i c t w o
1. Bańkowski E. Biochemia. Podręcznik dla studentów uczelni medycznych. Wydawnictwo Medyczne
Urban & Partner, Wrocław 2004, s. 121–144, 154–212, 363–367.
2. Biochemia kliniczna. Red. S. Angielski, J. Rogulski. Wydawnictwo Lekarskie PZWL, Warszawa
1991, s. 981–986.
3. Biochemia Harpera ilustrowana. Red. R.K. Murray, D.K. Granner, V.W. Rodwell. Wydawnictwo
Lekarskie PZWL, Warszawa 2008, wyd. 6, s. 139–148, 185–228.
4. Red. E. Birkner. Ćwiczenia praktyczne z biochemii. Skrypt dla studentów II roku Wydziału Lekar-
skiego z Oddziałem Lekarsko-Dentystycznym. Wydawnictwo SUM, Katowice 2008, s. 78–82.

4. TŁUSZCZE I CHOLESTEROL
Ewa Romuk, Bronisława Skrzep-Poloczek
4.1. Budowa i rola tłuszczów
Tłuszcze (lipidy) występują w komórkach wszystkich organizmów żywych. Należą do związ-
ków o złożonej i różnorodnej budowie. Pełnią funkcje strukturalne i energetyczne, więc ich obecność
w pożywieniu jest niezbędna. Służą jako wydajne źródło energii zarówno bezpośrednio, jak i poten-
cjalnie, gdyż są odłożone w tkance tłuszczowej. Pełnią rolę izolatora termicznego – tłuszcz tkanki
podskórnej chroni przed nadmierną utratą ciepła i ułatwia adaptację organizmu w niskich temperatu-
rach. Pełnią także rolę izolatora elektrycznego, pozwalając na szybkie rozprzestrzenianie się fal depo-
laryzacyjnych wzdłuż mielinowych włókien nerwowych. Część tłuszczów jest budulcem błon komór-
kowych i białej masy mózgu oraz bierze udział w syntezie niektórych substancji biologicznie czyn-
nych. Tłuszcz umożliwia utrzymanie we właściwym położeniu narządów ciała.
Pochodne lipidów są hormonami i wtórnym cząsteczkami sygnalizacyjnymi. Są prekursorami
substancji czynnych biologicznie, np. eikozanoidów. Wchodzące w skład lipidów wolne kwasy tłusz-
czowe (WKT) składają się z łańcucha węglowodorowego zakończonego grupą karboksylową
(COOH). Węgiel karboksylowy jest pierwszym węglem w łańcuchu kwasu tłuszczowego, węgiel dru-
gi nosi nazwę węgla α, a węgiel trzeci węgla β. Większość naturalnie występujących kwasów tłusz-
czowych zawiera parzystą liczbę atomów węgla. Dzielą się na nasycone i nienasycone. Do nasyco-
nych WKT zalicza się kwas palmitynowy (C16:0) zawierający 16 atomów węgla i kwas stearynowy
(C18:0). W jednonienasyconych występuje jedno wiązanie podwójne, np. w kwasie oleinowym
(C18:1) jest 18 atomów C i jedno nienasycone wiązanie, a w wielonienasyconych WKT dwa lub wię-
cej wiązań podwójnych, np. w kwasach linolowym (C18:2), linolenowym (C18:3) i arachidonowym
(C20:4). Właściwości kwasów tłuszczowych zależą od długości łańcucha i liczby wiązań podwójnych.
Lipidy dzielimy na:
A. Lipidy proste – estry kwasów tłuszczowych i alkoholi. Należą tutaj:
– lipidy właściwe, czyli triacyloglicerole (TG) lub triglicerydy (estry kwasów tłuszczowych i gli-
cerolu),
– woski (estry wyższych kwasów tłuszczowych i alkoholi innych niż glicerol).
B. Lipidy złożone – substancje zawierające obok kwasów tłuszczowych i alkoholi również inne
składniki. Są to:
−
fosfolipidy – lipidy zawierające kwas ortofosforowy w postaci mono- lub diestru:
a) glicerolofosfolipidy – pochodne kwasu glicerolofosforowego, mające przynajmniej jedną
O-acylową lub O-alkilową grupę związaną z glicerolem,
b) sfingofosfolipidy – pochodne 1-fosfoceramidu,
c) sfingolipidy – zawierające zamiast glicerolu specyficzny amino alkohol – sfingozynę;
−
glikolipidy – związki zawierające przynajmniej jedną resztę cukrową połączoną wiązaniem gliko-
zydowym z częścią lipidową;
−
inne lipidy złożone – sulfolipidy, aminolipidy.

4. Tłuszcze i cholesterol
37
Triacyloglicerole składają się z trzech łańcuchów kwasów tłuszczowych połączonych wiązania-
mi estrowymi z glicerolem. Mogą zawierać trzy identyczne kwasy tłuszczowe bądź dwa lub trzy różne
kwasy. Są one głównym magazynem energii, gromadzą się w komórkach tkanki tłuszczowej – adipo-
cytach.
Do fosfolipidów zaliczamy: kwas fosfatydowy (prekursor fosfatydyloglicerolu, który w mito-
chondriach ulega przekształceniu w kardiolipinę) oraz fosfatydylocholiny (lecytyny), które są prze-
ważającymi ilościowo lipidami błon komórkowych i stanowią dużą część zasobów choliny w organi-
zmie. Cholina odgrywa dużą rolę w przewodnictwie nerwowym i jako zapas labilnych grup metylo-
wych. Dipalmitylolecytyna jest aktywnym związkiem powierzchniowo czynnym, istotnym składni-
kiem surfaktantu, zmniejszającym napięcie powierzchniowe i zapobiegającym sklejaniu się wewnętrz-
nych powierzchni płuc. Do fosfolipidów zaliczamy także fosfatydyloserynę – zamiast choliny zawie-
ra serynę, fosfatydyloetanoloaminę (kefalinę) – zamiast choliny zawiera etanoloaminę oraz plazma-
logeny – stanowią co najmniej 10% fosfolipidów mózgu i mięśni.
4.2. Trawienie, wchłanianie i transport tłuszczów
Trawienie tłuszczów rozpoczyna się w żołądku pod wpływem lipazy podjęzykowej i lipazy
z błony śluzowej trzonu żołądka. Trawią one głównie TG z mleka, z krótkimi kwasami tłuszczowymi.
Główny proces trawienia zachodzi w dwunastnicy pod wpływem lipazy trzustkowej, esterazy chole-
sterolowej i fosfolipazy A
2
. Trawienie tłuszczów ułatwiają kwasy żółciowe, które emulgują TG o dłu-
gich łańcuchach na drobne kuleczki, zwiększając powierzchnię zetknięcia enzymu z substratem.
Produktami trawienia tłuszczów są: glicerol, 2-monoacyloglicerole, wolne kwasy tłuszczowe
(WKT) i niewielkie ilości 1-monoacylogliceroli. Glicerol jest wchłaniany do krążenia wrotnego, na-
tomiast pozostałe związki opuszczają fazę olejową zawiesiny tłuszczowej i dyfundują do miceli mie-
szanych i liposomów złożonych z soli kwasów żółciowych, fosfatydylocholiny i cholesterolu (CH) po-
chodzenia żółciowego. Micele te przechodzą do wnętrza komórek jelitowych (enterocytów). W obrę-
bie ściany jelit 1-monoacyloglicerole ulegają dalszej hydrolizie do wolnego glicerolu i WKT. Wolny
glicerol ulega fosforylacji do glicerolo-3-fosforanu i służy do resyntezy TG.
4.3. Metabolizm tłuszczów
4.3.1. Przemiany tłuszczów
Tkanka tłuszczowa jest aktywna metabolicznie. Komórki tłuszczowe (adipocyty) są wyspecjali-
zowane w syntezie i magazynowaniu TG. Mogą też uczestniczyć w uruchamianiu lipidów w postaci
cząsteczek „paliwa” transportowanych za pośrednictwem krwiobiegu do innych tkanek. Tak więc TG
ulegają ciągłej lipolizie i reestryfikacji. W ustroju zwierząt zdrowych pewna część tłuszczu tkankowe-
go ulega stale rozkładowi. Rozkład ten stanowi główne źródło energii tylko wówczas, gdy organizm
ma niski poziom węglowodanów (cukrzyca, głodówka). Zawarte w tkankach organizmu TG muszą
ulec hydrolizie (pod wpływem lipazy, głównie w tkance tłuszczowej) do glicerolu i kwasów tłuszczo-
wych. Dopiero później może nastąpić ich dalszy katabolizm. Wolne kwasy tłuszczowe uwolnione
z TG przenikają do osocza, gdzie w postaci kompleksu z albuminą są transportowane do tkanek, mają-
cych zdolność utleniania kwasów tłuszczowych o długim łańcuchu węglowym. Zużytkowanie glicero-
lu zależy od tego, czy tkanka ma konieczny do tego aktywujący enzym – kinazę glicerolową (nie wy-
stępuje w tkance tłuszczowej).
4.3.2. Utlenianie kwasów tłuszczowych
Proces ten zachodzi w mitochondrium, dlatego kwasy tłuszczowe przeznaczone do utlenienia
muszą być przetransportowane do macierzy mitochondrialnej. Pierwszym etapem jest aktywacja kwa-
sów tłuszczowych przez przyłączenie CoA kosztem energii powstałej z rozpadu ATP do AMP i piro-
fosforanu. Kwasy tłuszczowe krótkołańcuchowe (do 10 atomów węgla) przenikają bezpośrednio do
wnętrza mitochondriów, natomiast kwasy o większej liczbie atomów węgla wymagają obecności spe-
cyficznego przenośnika w postaci karnityny, która współdziała z acylotransferazą karnitynową I i II
oraz translokazą karnitynową.
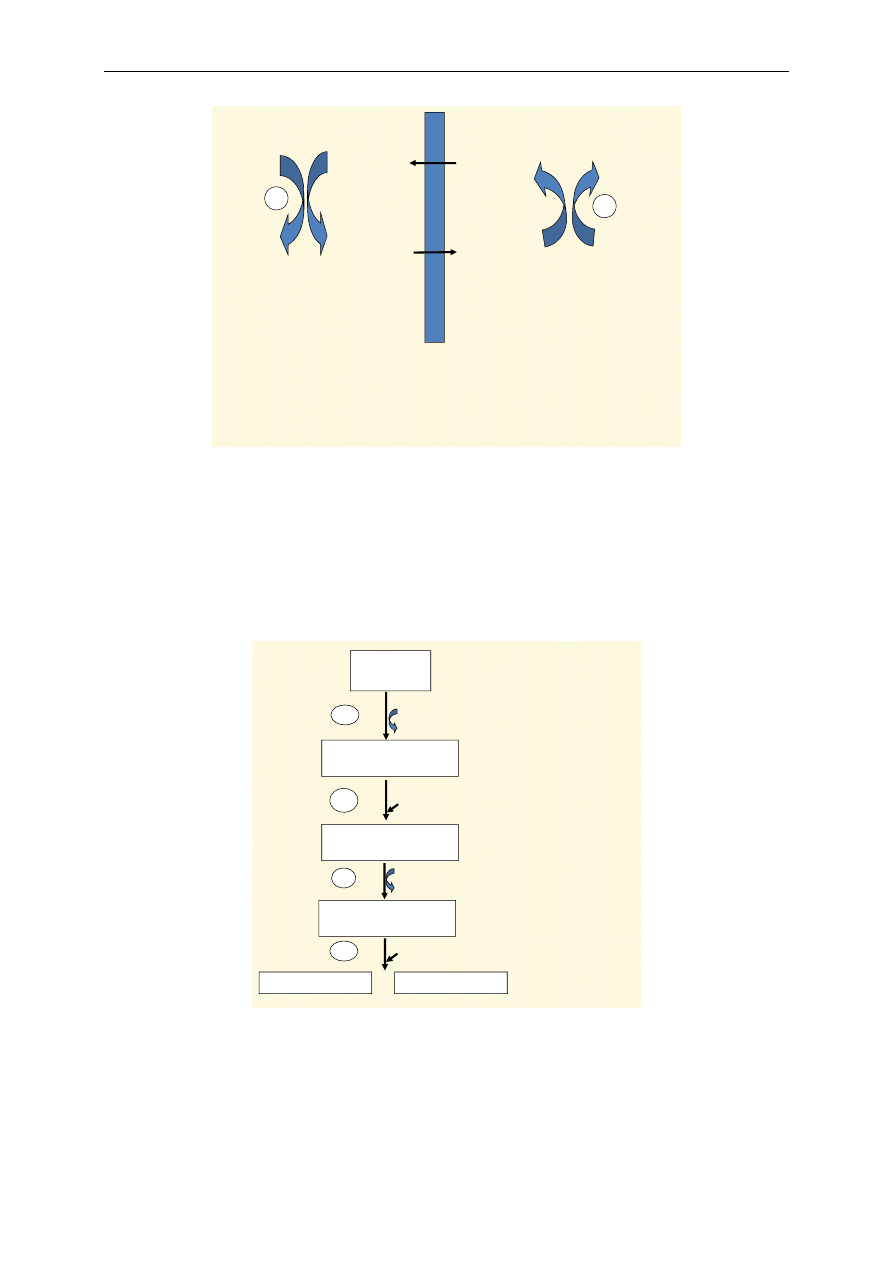
Część I. Zarys przemian biochemicznych
38
acylo-CoA
CoA
karnityna
acylokarnityna
karnityna
acylokarnityna
acylo-CoA
CoA
wewnętrzna błona
mitochondrialna
cytozol
macierz
mitochondrialna
1
2
1 – acylotransferaza karnitynowa I
2 – acylotransferaza karnitynowa II
Ryc. 11. Przenośnik karnitynowy
Utlenianie kwasów tłuszczowych polega na cyklicznie powtarzających się reakcjach doprowa-
dzających do rozpadu łańcucha węglowodorowego kwasu tłuszczowego przy węglu β do fragmentów
dwuwęglowych. Cyklicznie powtarzająca się sekwencja czterech reakcji: utleniania, uwodnienia, utle-
niania i tiolizy prowadzi do powstania cząsteczek acetylo~CoA, które są końcowym produktem
β-oksydacji. Przemiana, np. palmityno-CoA, wymaga 7 obrotów β-oksydacji i dostarcza 8 cząsteczek
(cz.) acetylo~CoA. Następnie powstałe cząsteczki acetylo~CoA są utleniane w cyklu Krebsa do CO
2
i H
2
O, dostarczając organizmowi energii w postaci ATP.
acylo-CoA
trans-enoilo-CoA
FAD
FADH
2
hydroksy-CoA
H
2
O
ketoacylo-CoA
NAD
+
NADH + H
+
acylo-CoA
acetylo~CoA
+
CoA
1
2
3
4
1 – utlenianie
2 – uwodnienie
3 – utlenienie
4 - tioliza
Ryc. 12. Schemat β-oksydacji
Przykładowo utlenienie kwasu palmitynowego (C16) dostarcza:
− 8 acetylo~CoA – z których jedna cząsteczka acetylo~CoA dostarcza 12 ATP w cyklu Krebsa i na
łańcuchu oddechowym, czyli łącznie 8 x 12 = 96 ATP
− 7 cząsteczek NADH, z których każda dostarcza na łańcuchu oddechowym 3 ATP, czyli łącznie
3 x 7 = 21 ATP

4. Tłuszcze i cholesterol
39
− 7 cząsteczek FADH
2
, z których każda dostarcza na łańcuchu oddechowym 2 ATP, czyli łącznie
2 x 7 = 14 ATP
Łącznie daje to 96 + 21 + 14 = 131 ATP, a po odjęciu 2 ATP na aktywację kwasu tłu-
szczowego ostatecznie 129 ATP.
β-oksydacja wszystkich kwasów tłuszczowych przebiega podobnie, istnieją jednak pewne róż-
nice między utlenianiem kwasów nasyconych i nienasyconych, parzysto- i nieparzystowęglowych, do-
tyczące przebiegu samego procesu i zysków energetycznych.
4.3.3. Biosynteza kwasów tłuszczowych (lipogeneza)
Lipogeneza zachodzi głównie w wątrobie, tkance tłuszczowej i nerce, a także w gruczole mleko-
wym w okresie laktacji. Synteza kwasów tłuszczowych polega na kondensacji jednostek dwuwęglo-
wych (acetylo~CoA) z wykorzystaniem NADPH jako związku redukującego i dawcy energii w posta-
ci ATP. Źródłem acetylo~CoA jest oksydacyjna dekarboksylacja pirogronianu, β-oksydacja kwasów
tłuszczowych, rozpad ciał ketonowych i szkieletów niektórych aminokwasów. Proces biosyntezy kwa-
sów tłuszczowych zachodzi w cytoplazmie, a jego produktem końcowym jest kwas palmitynowy.
Pierwszym etapem procesu jest karboksylacja acetylo~CoA do malonylo-CoA w obecności ATP i kar-
boksylazyacetylo~CoA zależnej od biotyny. Po aktywacji cały proces biosyntezy przebiega na wielo-
enzymatycznym kompleksie syntazy kwasów tłuszczowych. Kompleks ten jest dimerem o dwóch
identycznych monomerach polipeptydowych, z których każdy składa się z siedmiu aktywności enzy-
matycznych oraz białka przenoszącego grupy acylowe (ACP) połączonego z grupą acylową ACP-acyl.
Przy każdym obrocie cyklu elongacji wyróżniamy cztery etapy: 1) kondensacja acetylo-ACP
i malonylo-ACP do acetoacetylo-ACP, 2) redukcja acetoacetylo~CoA do 3-hydroksybutyrylo-ACP
z wykorzystaniem NADPH, 3) odwodnienie tego związku do krotonylo-ACP, 4) redukcja krotonylo-
-ACP przez kolejną cząsteczkę NADPH, prowadząca do powstania butyrylo-ACP. W kolejnych obro-
tach cyklu elongacji następuje przyłączanie dwóch atomów węgla do rosnącego łańcucha acylo-ACP
do momentu powstania palmityno-ACP, który zawiera 16 atomów węgla. Źródłem NADPH do lipo-
genezy jest cykl pentozofosforanowy. Powstawanie kwasów tłuszczowych dłuższych niż palmitynian
jest katalizowane przez enzymy zlokalizowane na powierzchni gładkiego retikulum endoplazmatycz-
nego.
Organizm człowieka nie potrafi syntetyzować kwasów tłuszczowych zawierających wiązania
podwójne w położeniu dalszym niż węgiel C-9, m.in. nie potrafi syntetyzować linolanu i linolenianu,
które są dla organizmu źródłem niezbędnych (egzogennych) nienasyconych kwasów tłuszczowych.
Oba te wielonienasycone kwasy ulegają przemianom prowadzącym do wytworzenia kwasów wielo-
nienasyconych 20-węglowych, które stanowią źródło wyjścia dla tworzenia ważnych związków o róż-
norodnym działaniu regulacyjnym – eikozanoidów, jak prostaglandyny, tromboksany i leukotrieny.
Prostaglandyny są naturalnymi mediatorami procesu zapalnego, wywołują lokalne objawy zapalenia
w postaci zaczerwienienia, obrzęku, temperatury, jako następstwa rozszerzenia małych naczyń krwio-
nośnych. Tromboksany agregują płytki krwi, kurczą naczynia krwionośne, sprzyjają powstawaniu za-
krzepów wewnątrznaczyniowych. Leukotrieny należą do mediatorów procesu zapalnego, mają zdol-
ność powolnego kurczenia mięśni gładkich dróg oddechowych i przewodu pokarmowego oraz zwięk-
szania przepuszczalności naczyń krwionośnych, co sprzyja powstawaniu obrzęków. Pobudzają leuko-
cyty do migracji do miejsc zapalnych.
Do związków tłuszczowych zawartych w osoczu należą: TG, CH wolny i CH zestryfikowany,
fosfolipidy oraz WKT.
4.3.4. Ketogeneza
Jeżeli intensywność utleniania kwasów tłuszczowych w wątrobie jest duża, organizm prze-
kształca część powstającego acetylo~CoA w acetooctan i β-hydroksymaślan w procesie ketogenezy.
β-hydroksymaślan, acetooctan i produkt jego nieenzymatycznego rozpadu – aceton – określa się łącz-
nie jako ciała ketonowe. Ich biosynteza zachodzi w mitochondriach wątroby.
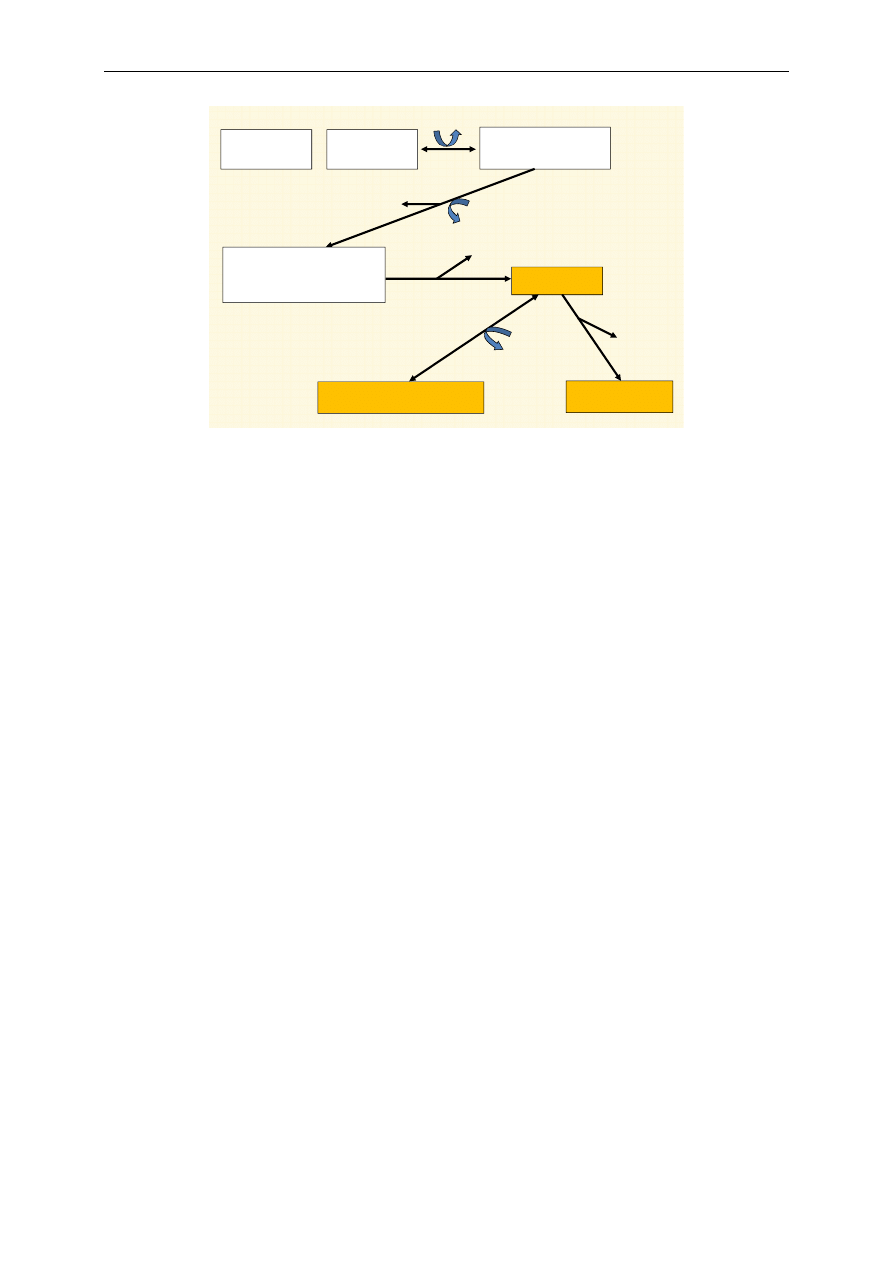
Część I. Zarys przemian biochemicznych
40
acetylo~CoA
acetylo~CoA
CoA
acetoacetylo~CoA
β-hydroksy-β-
-metyloglutarylo~CoA
acetylo~CoA
CoA
acetylo~CoA
acetooctan
β-hydroksymaślan
aceton
CO
2
NADH + H
+
NAD
+
+
H
2
O
H
2
O
Ryc. 13. Schemat przemian ciał ketonowych
W warunkach prawidłowych ilość powstających ciał ketonowych jest niewielka, wzrasta nato-
miast w okresie głodu i u chorych na cukrzycę. W okresie głodu brak glukozy do glikolizy, przez co
zmniejsza się synteza pirogronianu. W konsekwencji dochodzi do deficytu powstającego przez karbo-
ksylację pirogronianu – szczawiooctanu, który jest akceptorem acetylo~CoA w cyklu Krebsa. Zmniej-
sza się synteza NADPH potrzebnego do biosyntezy kwasów tłuszczowych i cholesterolu. W cukrzycy
ilość glukozy jest wystarczająca, nie może ona jednak być wykorzystana. Jedyną możliwością staje się
przekształcenie acetylo~CoA na drodze ketogenezy. Chociaż ciała ketonowe są wytwarzane w wątro-
bie, nie mogą być przez nią w znaczącym stopniu wykorzystywane. Są one jednak cennym materiałem
energetycznym dla tkanek pozawątrobowych. Z wątroby łatwo dyfundują do krwi i przenikają do na-
rządów, stając się źródłem energii m.in. dla mięśni szkieletowych, mięśnia sercowego, kory nerki,
a nawet dla mózgu.
Wzrost stężenia ciał ketonowych we krwi określamy jako ketonemię, a pojawienie się ich
w moczu jako ketonurię. W większości wypadków ketonemia jest spowodowana zwiększonym wy-
twarzaniem ciał ketonowych w wątrobie, a nie ich zmniejszoną utylizacją przez tkanki pozawątrobo-
we. Ciągłe wydzielanie ciał ketonowych w zwiększonych ilościach powoduje przekroczenie zdolności
ich buforowania przez organizm i doprowadza do rozwoju kwasicy ketonowej, co może być bardzo
niekorzystne, np. przy niekontrolowanej cukrzycy.
4.4. Budowa i rola lipoprotein
Transport lipidów w organizmie odbywa się za pomocą kompleksów białkowo-lipidowych, czy-
li lipoprotein. Lipoproteiny składają się z rdzenia lipidowego (zawierającego głównie niepolarne czą-
steczki triacylogliceroli i estrów cholesterolu), otoczonego warstwą powierzchniową (zawierającą
głównie fosfolipidy i wolny cholesterol) oraz części białkowej (tzw. apolipoproteiny), której skład jest
charakterystyczny dla danej lipoproteiny. Apolipoproteiny pełnią funkcje nośnikowe, wpływają na
integralność cząsteczki i jej skład lipidowy, reagują ze specyficznymi receptorami komórkowymi, co
powoduje internalizację cząsteczki i jej usuwanie z krążenia, są aktywatorami lub inhibitorami enzy-
mów lipoprotein.
Lipoproteiny można rozdzielić elektroforetycznie lub metodą ultrawirowania na następujące
frakcje:
− chylomikrony,
− lipoproteiny o bardzo małej gęstości, VLDL (very low density lipoproteins),
− lipoproteiny o pośredniej gęstości, IDL (intermediate density lipoproteins),
− lipoproteiny o małej gęstości, LDL (low density lipoproteins),
− lipoproteiny o dużej gęstości HDL (high density lipoproteins).

4. Tłuszcze i cholesterol
41
4.4.1. Chylomikrony
Są największymi lipoproteinami o najmniejszej ilości białka i najmniejszej gęstości, dlatego
w elektroforezie pozostają na starcie. Występują w surowicy przez kilka godzin po posiłku zawierają-
cym tłuszcz, natomiast nie powinny występować na czczo.
Chylomikrony uczestniczą w transporcie TG pokarmowych, które po emulacji, hydrolizie i mice-
lizacji ulegają wchłonięciu do enterocytów jelita cienkiego, skąd przechodzą do wątroby. Powstają
w błonie śluzowej jelita głównie z FFA, TG endogennych, apo B48, niewielkiej ilości fosfolipidów
oraz cholesterolu i z limfą dostają się do krwiobiegu. Po przejściu do osocza krwi pobierają od HDL
apoE oraz apoC, z których szczególną rolę odgrywa apoC-II, gdyż aktywuje lipazę lipoproteinową
(LPL) – enzym obecny na powierzchni komórek śródbłonka naczyń krwionośnych tkanek obwodo-
wych pozawątrobowych, przede wszystkim mięśni i tkanki tłuszczowej. Lipoza lipoproteinowa zako-
twiczona jest w ścianie naczyń włosowatych i dopiero pod wpływem heparyny jest uwalniana do krą-
żenia, co powoduje klarowanie lipemicznego osocza, hydrolizuje ona większość TG do glicerolu
i wolnych kwasów tłuszczowych. W mięśniach szkieletowych kwasy tłuszczowe ulegają β-oksydacji,
a glicerol włącza się do glikolizy. Uzyskana z tych procesów energia zostaje zużyta do pracy mięśni.
W tkance tłuszczowej kwasy tłuszczowe i glicerol ulegają resyntezie do TG i w tej postaci są magazy-
nowane, stanowiąc formę zapasową tłuszczu. Pozostałe kwasy tłuszczowe wiążą się z albuminami
i w tej postaci są przenoszone do odległych tkanek.
W wyniku działania LPL następuje utrata z chylomikronów około 90% TG oraz białka apoC,
które wraca do HDL. Powstające chylomikrony resztkowe, połączone z apoE, są wychwytywane przez
wątrobę za pośrednictwem receptora swoistego dla apoE. W wątrobie chylomikrony resztkowe są me-
tabolizowane przez lipazę wątrobową (lipaza acyloglicerolowa, HTGL), która znajduje się na komór-
kach endotelialnych wątroby i podobnie jak LPL uwalniana jest pod wpływem heparyny. Oba enzymy
zaliczane są do ektoenzymów. LPL wykazuje dużą aktywność w stosunku do lipoprotein o dużej za-
wartości TG, a więc chylomikronów i VLDL, natomiast lipaza wątrobowa do lipoprotein o małej za-
wartości TG, a więc resztkowych chylomikronów i VLDL.
Chylomikrony na skutek utraty TG stają się bogate w estry cholesterolu, które pobierają od
HDL i za pośrednictwem chylomikronów resztkowych transportują je do wątroby. Podobne zmiany
zachodzą w VLDL.
4.4.2. Lipoproteiny o bardzo małej i pośredniej gęstości – VLDL oraz IDL
W elektroforezie VLDL wędrują z frakcją pre-β-lipoprotein. Syntetyzowane są głównie w wą-
trobie oraz w niewielkim stopniu w komórkach błony śluzowej jelita. Transportują TG endogenne
z wątroby lub przewodu pokarmowego do tkanek peryferyjnych. Substratami do syntezy TG w wątro-
bie są glicerol i kwasy tłuszczowe otrzymane z krwiobiegu. Synteza VLDL w komórkach błony ślu-
zowej jelita przebiega z TG syntetyzowanych de novo. W odróżnieniu od chylomikronów w ich skład
wchodzą głównie długołańcuchowe kwasy tłuszczowe. VLDL wytwarzane w jelicie zawierają apo B-48
oraz apo C, lecz nie posiadają apo E, natomiast VLDL powstające w wątrobie zawierają białko apo B-
100. Po wejściu do krwi wzbogacają się w apo C i apo E pochodzące z HDL, po czym ulegają działa-
niu LPL, która zaktywowana przez apo C-II rozkłada TG, powodując zmniejszenie ich średnicy
i zwiększenie gęstości (podobnie jak w przypadku chylomikronów). Składniki białkowe VLDL apo C
i apo E powracają do HDL. W wyniku tych przemian VLDL przechodzą w IDL, które są aterogenne
i przekształcają się dwoma drogami. Połowa tworzy VLDL resztkowe, które podobnie jak chylomi-
krony resztkowe pobierają estry cholesterolu od HDL oddając im TG i fosfolipidy, po czym powracają
do wątroby. W wątrobie HTGL powoduje całkowity rozkład TG, a uwolniona reszta kwasów tłusz-
czowych bierze udział w syntezie TG lub ulega spaleniu w β-oksydacji. Druga połowa IDL jest prze-
kształcana w LDL.
4.4.3. Lipoproteiny o małej gęstości – LDL
W elektroforezie LDL wędrują z frakcją β-lipoprotein i są końcowym produktem katabolizmu
VLDL. Są najbardziej aterogenną frakcją zawierającą białko apo B-100. Transportują cholesterol
z wątroby do innych narządów, głównie nerek, mięśni oraz kory nadnerczy i regulują syntezę de novo
cholesterolu w tych miejscach. Pobierane są przez komórki docelowe na drodze endocytozy kierowa-

Część I. Zarys przemian biochemicznych
42
nej receptorami, które rozpoznają białko apo B-100. Receptory LDL to glikozydowe białka transbło-
nowe, znajdujące się na powierzchni komórek w specjalnych obszarach, zwanych opłaszczonymi doł-
kami. Wgłębienia te pokryte są od strony cytosolowej białkiem zwanym klatryną, które wycina je
z błony komórkowej w postaci pęcherzyka opłaszczonego. Pęcherzyk ulega fuzji z endosomem i w ten
sposób LDL związane z receptorami dostają się do wnętrza komórki (endocytoza). W komórce nastę-
puje dysocjacja LDL od receptorów, które w stanie nienaruszonym wracają na powierzchnię komórki,
natomiast LDL dostają się do lizosomów. W lizosomach, które zawierają szereg enzymów hydroli-
tycznych, białko apo B-100 ulega hydrolizie do aminokwasów, a estry cholesterolu są rozkładane do
kwasów tłuszczowych i wolnego cholesterolu.
Uwolniony cholesterol wnika do cytosolu, gdzie uczestniczy w wielu biosyntezach. Wszystkie
komórki wbudowują cholesterol do nowo syntetyzowanych błon komórkowych. W komórkach nad-
nerczy i jajnikach jest on przekształcany w hormony steroidowe, takie jak kortyzol czy estradiol, na-
tomiast w komórkach wątroby bierze udział w syntezie kwasów żółciowych. Metabolizm cholestero-
lowy komórki zależy od ilości cholesterolu uwalnianego z LDL. Nagromadzony cholesterol powoduje
zahamowanie syntezy receptorów LDL na powierzchni komórki na zasadzie ujemnego sprzężenia
zwrotnego, gdyż ich liczba jest regulowana zgodnie z zapotrzebowaniem komórki na cholesterol. Po-
woduje również zahamowanie jego endogennej biosyntezy poprzez hamowanie aktywności enzymu
regulatorowego reduktazy HMG-CoA. Pobudza natomiast ponowną estryfikację cholesterolu, a po-
wstałe estry gromadzone są w komórce w postaci kropelek tłuszczu, stanowiąc zapas energetyczny.
4.4.3. Lipoproteiny o dużej gęstości – HDL
Są najmniejszymi lipoproteinami i zawierają najwięcej białka, dlatego w elektroforezie wędrują
najszybciej z frakcją α-lipoproteiny. Pochodzą z dwóch źródeł: z syntezy wątrobowej i jelitowej, oraz
– podobnie jak IDL – z katabolizmu chylomikronów i VLDL. Nowo powstające cząsteczki HDL
i HDL
3
pobierają nadmiar wolnego cholesterolu z komórek obwodowych, estryfikują go przy udziale
apoAI i już jako dojrzałe HDL
2
przenoszą go do wątroby, gdzie wraz z cholesterolem LDL ulega on
przemianie do kwasów żółciowych. Frakcja HDL
2a
zawiera dużą ilość estrów cholesterolu, natomiast
HDL
2b
bogata jest w TG otrzymane od resztkowych chylomikronów i VLDL, a uboższa w estry cho-
lesterolu oddane tym lipoproteinom. W wymianie tej uczestniczy białko przenoszące estry cholestero-
lu (CEP). Wytworzone estry cholesterolu są silnie hydrofobowe i muszą być transportowane w rdze-
niu lipoprotein. Ponadto HDL wspomagają przemianę chylomikronów i VLDL przez wymianę lipi-
dów i apoprotein (C i E). Frakcja HDL ma największą gęstość ze względu na największą zawartość
apolipoprotein. W skład HDL wchodzą apo A-I, A-II, C-III, C-II, C-I, D oraz inne białka. HDL są
obok LDL głównymi lipoproteinami transportującymi cholesterol we krwi. Działanie HDL obniżające
stężenie cholesterolu we krwi polega na usuwaniu jego nadmiaru z komórek i transportowaniu go do
wątroby, gdzie jest metabolizowany.
4.5. Biosynteza i przemiany cholesterolu
Nieco więcej niż połowa cholesterolu powstaje w wyniku syntezy w organizmie, pozostała część
pochodzi z pożywienia. Cholesterol jest syntetyzowany przez prawie wszystkie tkanki, najwięcej powstaje
go w wątrobie, ścianie jelit, korze nadnerczy, jajniku, jądrze i w łożysku. Jest syntetyzowany z acety-
lo~CoA: acetylo~CoA i acetoacetylo~CoA kondensują tworząc hydroksymetylo-glutarylo-CoA (HMG-
-CoA), następnie – w reakcji katalizowanej przez reduktazę HMG-CoA – powstaje mewalonian
(enzym regulujący szybkość biosyntezy cholesterolu). Dalsze przekształcenia prowadzą przez szereg
redukcji metabolitów pośrednich z udziałem NADPH do powstania cholesterolu. W tkankach i osoczu
cholesterol występuje w postaci wolnej oraz zestryfikowanej, w połączeniu z długołańcuchowymi
kwasami tłuszczowymi. W osoczu obie formy cholesterolu są transportowane z lipoproteinami.
Cholesterol jest ważnym składnikiem strukturalnym błon, prekursorem wszystkich innych ste-
roidów w organizmie, w tym: kortykosteroidów, hormonów płciowych, witaminy D i kwasów żółcio-
wych. Około 1 g cholesterolu dziennie jest eliminowany z organizmu. Blisko połowa, po przekształ-
ceniu w kwasy żółciowe, jest wydalana w kale, reszta jest wydalana w postaci niezmienionej jako
cholesterol. Podwyższone stężenie cholesterolu w osoczu krwi uważa się za główny czynnik sprzyja-
jący rozwojowi miażdżycy.

4. Tłuszcze i cholesterol
43
4.6. Zaburzenia gospodarki lipoprotein
Zmiany jakościowe i ilościowe składu poszczególnych frakcji lipoproteinowych określamy jako
dyslipoproteinemie. Mogą one mieć charakter pierwotny (wrodzony) lub wtórny, w przebiegu np. cu-
krzycy, niedoczynności tarczycy, zespołu nerczycowego, miażdżycy.
Dyslipoproteinemie charakteryzują się: wzrostem (hiperlipoproteinemie) lub obniżeniem stężenia
jednej lub kilku frakcji lipoproteinowych (hipolipoproteinemie) bądź zmianami składu jakościowego
poszczególnych frakcji lipoproteinowych.
Zgodnie ze stanowiskiem Europejskiego Towarzystwa Miażdżycowego, za podstawę klasyfika-
cji hiperlipidemii przyjmuje się stężenie CH i TG w surowicy. Na tej podstawie wyróżniamy:
− izolowaną hipercholesterolemię,
− izolowaną hipertriglicerydemię,
− hiperlipidemię mieszaną.
4.7. Zaburzenia biochemiczne w miażdżycy
Miażdżyca jest przewlekłym procesem zapalnym zajmującym ogniskowo przede wszystkim
tętnice średniego i dużego kalibru. Zmiany chorobowe stwierdza się już w dzieciństwie, a nawet w ży-
ciu płodowym. Jednak objawy pojawiają się dopiero w 5 dekadzie życia u mężczyzn i po menopauzie
u kobiet. Miażdżyca charakteryzuje się odkładaniem złogów cholesterolu i jego estrów w ścianach
tętnic. Największy wpływ na stężenie cholesterolu we krwi mają czynniki dziedziczne. Równie ważne
są jednak oddziaływania środowiskowe, m.in. dieta zawierająca zamiast kwasów tłuszczowych nasy-
conych kwasy jedno- i wielonienasycone. Pozostałe czynniki ryzyka to: nadciśnienie, palenie tytoniu,
płeć męska, otyłość brzuszna, brak ruchu. Do nowych czynników ryzyka sercowo-naczyniowego na-
leżą zwiększone stężenia w osoczu: białka C reaktywnego (CRP), homocysteiny, lipoproteiny (a) i fi-
brynogenu.
Morfologiczne zmiany miażdżycowe stanowią ogniskowe zgrubienia błony wewnętrznej ściany
tętnic. Początkowo w warstwie podśródbłonkowej powstaje pasmo tłuszczowe, zbudowane z licznych
komórek piankowatych i pojedynczych limfocytów T. Zmiany takie, występujące głównie u ludzi
młodych, nie zmniejszają światła naczynia i nie wywołują objawów. Faza ta ma charakter odwracalny,
najczęściej jednak zmiany postępują, prowadząc do powstania blaszki miażdżycowej. W obrębie
blaszki wyróżnia się pokrywę (od strony światła, zawierającą dużo kolagenu i komórek mięśni gład-
kich) oraz rdzeń lipidowy o różnej wielkości. Wraz z powiększaniem się blaszki ściana tętnicy ulega
przebudowie odśrodkowej lub dośrodkowej. Ostatecznie dochodzi do zmniejszenia światła tętnicy lub
jej całkowitego zamknięcia.
Miażdżyca charakteryzuje się występowaniem w tętnicach u tego samego człowieka, a nawet
w obrębie jednej tętnicy zmian o różnym stopniu zaawansowania.
P i ś m i e n n i c t w o
1. Bańkowski E. Biochemia. Podręcznik dla studentów studiów licencjackich i magisterskich. Med-
Pharm Polska, Wrocław 2006, s. 145–184.
2. Biochemia Harpera ilustrowana. Red. R.K Murray, D.K. Granner, V.W. Rodwell. Wydawnictwo
Lekarskie PZWL, Warszawa 2008, s. 229–294.
3. Dembińska-Kieć A., Naskalski J. Diagnostyka laboratoryjna z elementami biochemii klinicznej.
Elsevier Urban & Partner, Wrocław 2010, s. 357–422.
4. Hames B.D., Hooper N.M., Houghton J.D. Biochemia. Krótkie wykłady. Wydawnictwo Naukowe
PWN, Warszawa 2000, s. 297–332.
5. Stryer L., Berg J.M., Tymoczko J.T. Biochemia. Wydawnictwo Naukowe PWN, Warszawa 2005,
s. 642–669.
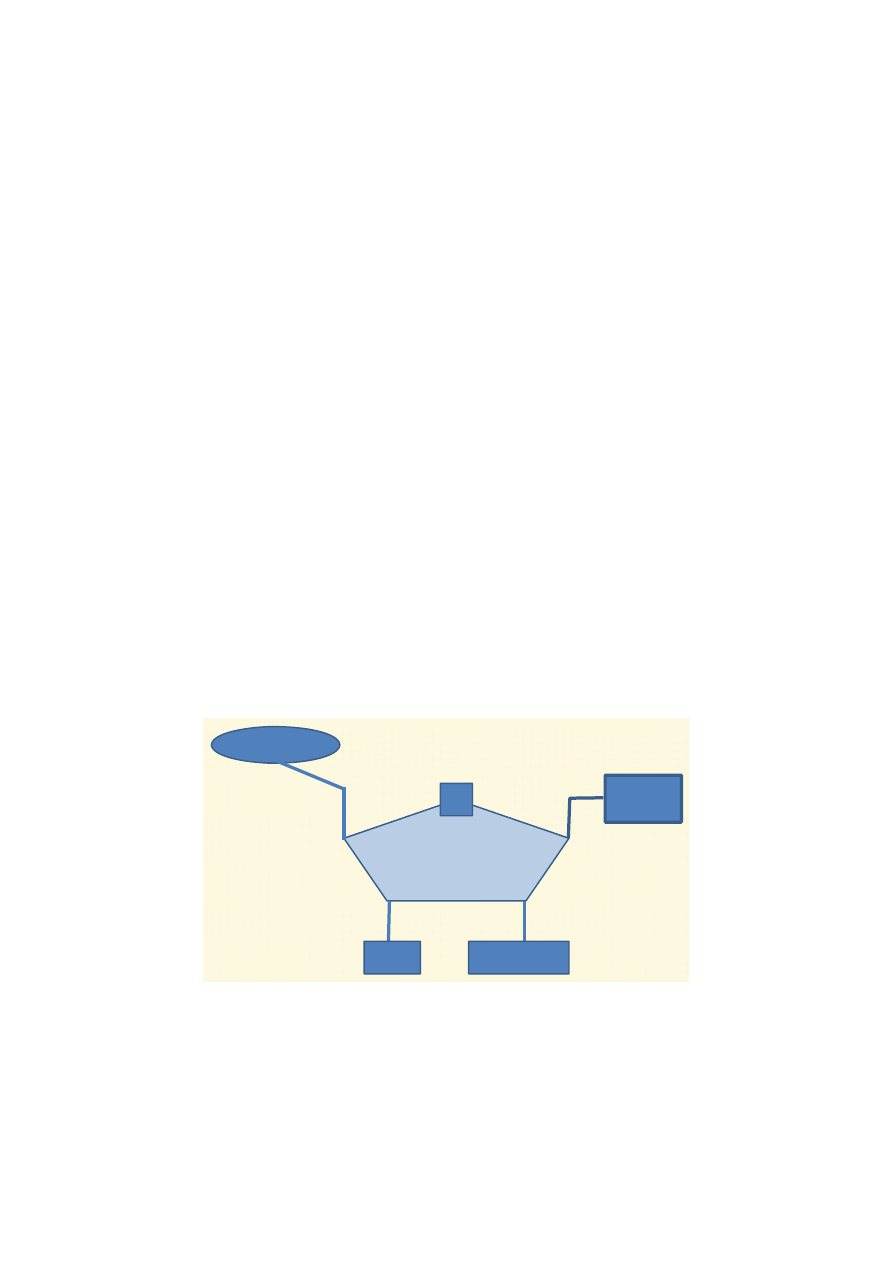
5. KWASY NUKLEINOWE I BIOSYNTEZA BIAŁKA
Aleksandra Kasperczyk
Kwasy nukleinowe są wielkocząsteczkowymi składnikami komórek, powstałymi przez polime-
ryzację wielu (od kilkudziesięciu do wielu tysięcy) nukleotydów monofosforanowych. Wśród kwasów
nukleinowych wyróżniamy DNA – kwas deoksyrybonukleinowy (dwuniciowy), który stanowi mate-
riał genetyczny wszystkich komórek, oraz RNA – kwas rybonukleinowy (jednoniciowy), który może
występować w złożonych konformacjach, co ma swoje odzwierciedlenie w różnorodności funkcji
pełnionych w komórce.
5.1. Budowa kwasów nukleinowych
Kwasy nukleinowe zbudowane są z nukleotydów złożonych z:
− zasad organicznych, w tym: pirymidynowych, jak: cytozyna, tymina i uracyl (występuje tylko w RNA
zamiast tyminy), oraz purynowych, jak: adenina i guanina (adenina zawsze tworzy parę z tyminą –
A-T, a guanina z cytozyną – G-C),
− pentoz (β-D-rybozy w przypadku RNA, DNA zawiera β-D-2-deoksyrybozę),
− fosforanu.
Nukleotydy łączą się za pomocą wiązań 3’,5`-difosfoestrowych, tworząc łańcuch cukrowo-fo-
sforanowy o przemiennie powtarzających się resztach pentozy i fosforanu.
cukier
zasada
OH
OH lub H
fosforan
1’
2’
3’
4’
5’
O
Ryc. 14. Schemat budowy nukleotydu lub deoksynukleotydu
Nukleozydy są produktami hydrolizy nukleotydów złożonymi z zasady organicznej i pentozy, po-
łączonych wiązaniami N-glikozydowymi. Składniki kwasów nukleinowych – zasady, nukleozydy
i nukleotydy przedstawiono w tabeli I.

5. Kwasy nukleinowe i biosynteza białka
45
Tabela I. Składniki kwasów nukleinowych
RNA
DNA
Zasada
rybonukleozyd
rybonukleotyd
zasada
deoksyrybonukleozyd
deoksyrybonukleotyd
Adenina
(A)
adenozyna
adenozynomonofosforan
(AMP)
adenina
(A)
deoksyadenozyna
deoksyadenozynomono-
fosforan (dAMP)
Guanina
(G)
guanozyna
guanozynomonofosforan
(GMP)
guanina
(G)
deoksyguanozyna
deoksyguanozynomono-
fosforan (dGMP)
Cytozyna
(C)
cytydyna
cytydynomonofosforan
(CMP)
cytozyna
(C)
deoksycytydyna
deoksycytydynomono-
fosforan (dCMP)
Uracyl
(U)
urydyna
urydynomonofosforan
(UMP)
tymina
(T)
tymidyna
tymidynomonofosforan
(dTMP)
5.2. Rodzaje DNA
Z uwagi na aktywność i funkcję w komórce wyróżnia się następujące, odmienne pod względem
sekwencji nukleotydów rodzaje DNA:
− unikalny – najważniejsza część euchromatyny, frakcja aktywna genetycznie, zbudowana z dwóch
oddzielnych łańcuchów DNA, owiniętych wokół siebie, tworzących dwuniciową prawoskrętną
antyrównoległą względem siebie helisę, która jest utrzymywana dzięki wiązaniom wodorowym,
− satelitarny (satDNA) – w czasie kariokinez współtworzy centromer i satelitę; jego ilość jest cechą
gatunkową,
− rybosomalny (rDNA) – występuje głównie w jąderku.
U organizmów eukariotycznych DNA jest zawarty w jądrach komórkowych, przy czym więk-
szość jest ściśle upakowana w chromosomach, gdzie występują również białka, głównie histony –
białka silnie zasadowe o przewadze aminokwasów (jak arginina i lizyna), a ich funkcją jest blokowanie
DNA. Pozostała część białek – białka niehistonowe – są dużym zbiorem indywidualnych łańcuchów
polipeptydowych, spełniających funkcje regulatorowe i stabilizujące. W swojej budowie zawierają one
dużo aminokwasów kwaśnych, m.in. kwasy glutaminowy i asparaginowy.
Jądrowy kompleks DNA, histonów i białek niehistonowych to chromatyna, której włókno wy-
stępuje na pięciu poziomach zorganizowania:
− poziom 1 – heliks DNA,
− poziom 2 – włókno nukleosomowe (nukleosom) złożone z DNA nawiniętego na oktamery histono-
we, jest to tzw. fibryla chromatynowa,
− poziom 3 – włókno solenoidowe, czyli fibryla zwinięta w sprężynę,
− poziom 4 – chromatyna interfazowa,
− poziom 5 – chromatyna metafazowa, najbardziej skondensowana forma DNA.
5.3. Rodzaje RNA
Kwas rybonukleinowy jest jednoniciową cząsteczką, mającą zdolność przyjmowania różnych
konformacji, co pozwala na spełnianie w komórce różnorodnych funkcji. Wyróżnia się cztery główne
klasy RNA: informacyjny, rybosomowy, transportujący i mały jądrowy.
Informacyjny (mRNA) – stanowi około 5% wszystkich kwasów rybonukleinowych, jest prze-
nośnikiem informacji z jądra komórkowego do cytoplazmy. Ma on zdolność do tworzenia komplek-
sów z rybosomami i służy jako matryca w biosyntezie białka. W środkowej części posiada kodon roz-
poczynający translację – AUG oraz kodony kończące ten proces – UAA, UAG, UGA.
Rybosomowy (rRNA) – stanowi około 80% wszystkich kwasów rybonukleinowych, prowadzi
syntezę polipeptydów, składa się z podjednostki mniejszej i większej (znajdują się w niej dwa aktyw-
ne miejsca: peptydylowe P i aminokwasowe A). Jeden rybosom może prowadzić syntezę jednego
łańcucha polipeptydowego. Większość białek wchodzących w skład rybosomów to białka zasadowe,
które łatwo łączą się z RNA.
Transportujący (tRNA) – stanowi około 15% wszystkich kwasów rybonukleinowych. Pełni
funkcję cząsteczki adaptorowej, dostarczając aminokwasy do rybosomu i dekodując mRNA; rozpo-

Część I. Zarys przemian biochemicznych
46
znaje aminokwas i odpowiadający mu kodon w mRNA; przenosi enzymatycznie związany odpowied-
ni aminokwas do tworzącego się na rybosomie łańcucha polipeptydowego.
W budowie tRNA wyróżniamy trzy struktury:
− I-rzędową – sekwencja liniowa, w której pojedynczy łańcuch zbudowany z 63–94 nukleotydów;
− II-rzędową – zawierającą cztery lub pięć podwójnych łańcuchów, stabilizowanych wiązaniami wo-
dorowymi oraz trzy lub cztery jednoniciowe pętle, z których jedna prawdopodobnie odpowiada za
przyłączanie się cząsteczki tRNA do powierzchni rybosomu;
− III-rzędową, którą tworzy dziewięć wiązań wodorowych jednoniciowych pętli tRNA, pakujących
strukturę II-rzędową w strukturę III-rzędową w kształcie litery L.
Mały jądrowy (snRNA) – uczestniczy w splicingu.
5.4. Biosynteza i degradacja puryn i pirymidyn
Puryny i pirymidyny są elementami składowymi nukleotydów, kwasów nukleinowych i nukleo-
protein. Pobierane są z przewodu pokarmowego jako produkty trawienia kwasów nukleinowych, mo-
gą być również syntetyzowane de novo.
Trawienie kwasów nukleinowych rozpoczyna się w dwunastnicy. W soku dwunastniczym są za-
warte enzymy, m.in. rybonukleazy (należące do transferaz) i deoksyrybonukleinazy (zaliczane do
fosfodiesteraz), które rozkładają kwasy nukleinowe do nukleotydów hydrolitycznie rozkładanych przy
udziale nukleotydaz. Za rozkład nukleozydów do wolnych zasad i rybozylo-1-fosforanów i deoksy-
rybozylo-1-fosforanów odpowiedzialne są fosforylazy nukleozydów.
5.4.1. Biosynteza pirymidyn
Pierwszym etapem biosyntezy pirymidyn jest synteza pierścienia zasady, która zostaje przyłą-
czona do rybozy – powstaje nukleotyd pirymidynowy. Pierścień pirymidynowy złożony jest z dwóch
cząsteczek wodorowęglanu, kwasu asparaginowego i NH
4
+
.
Biosynteza rozpoczyna się od kilkuetapowej syntezy karbamoilofosforanu:
− w pierwszym etapie następuje fosforylacja jonu wodorowęglanowego (z wykorzystaniem pierwszej
cząsteczki ATP), co prowadzi do powstania karboksyfosforanu i ADP,
− następnie w wyniku reakcji karboksyfosforanu z amoniakiem powstaje kwas karbaminowy i nie-
organiczny fosforan,
− kwas karbaminowy ulega fosforylacji (przy udziale drugiej cząsteczki ATP) i powstaje karbamoilo-
fosforan, etap ten katalizuje syntetaza karbamoilofosforanowa.
Karbamoilofosforan reaguje z asparaginianem przy udziale karbamoilotransferazy asparaginia-
nowej. Powstaje karbamoiloasparaginian, ulegający cyklizacji do dihydroorotanu, który przy
udziale NAD
+
zostaje utleniony do orotanu.
Orotan wiąże się z aktywną formą rybozy, czyli 5-fosforybozylo-1-pirofosforanem (PRPP),
powstaje orotydylan, który ulega dekarboksylacji przy udziale enzymu dekarboksylazy orotydylano-
wej i tworzy się UMP, czyli główny nukleotyd pirymidynowy.
Cytydyna powstaje w wyniku przekształcenia uracylu obecnego w UMP, musi to być jednak
poprzedzone przejściem UMP poprzez UDP w UTP, czyli urydynotrifosforan. Odbywa się to po-
przez stopniowe przyłączanie grup fosforanowych, których dawcą jest ATP. Reakcje te katalizują ki-
naza nukleozydomonofosforanowa i nukleozydodifosforanowa. W UTP dochodzi do wymiany tlenu
grupy karbonylowej na grupę aminową i powstaje cytydynotrifosforan (CTP).
5.4.2. Biosynteza puryn
Puryny mogą być syntetyzowane de novo albo poprzez wykorzystanie wolnych zasad pocho-
dzących z hydrolizy kwasów nukleinowych lub wchłanianych wraz z pożywieniem, co jest bardziej
korzystne ze względu na oszczędność energii.
Do syntezy de novo potrzebny jest PRPP stanowiący szkielet, na bazie którego jest tworzona
zasada. Pierwszy etap to zamiana pirofosforanu na grupę aminową, w wyniku czego powstaje 5-fosfory-
bozylo-1-amina, a reakcje katalizuje fosforybozyloamidotransferaza glutaminowa. Kolejnych 9 reak-
cji doprowadza do złożenia pierścienia purynowego. Każda z nich składa się z aktywacji tlenu związa-
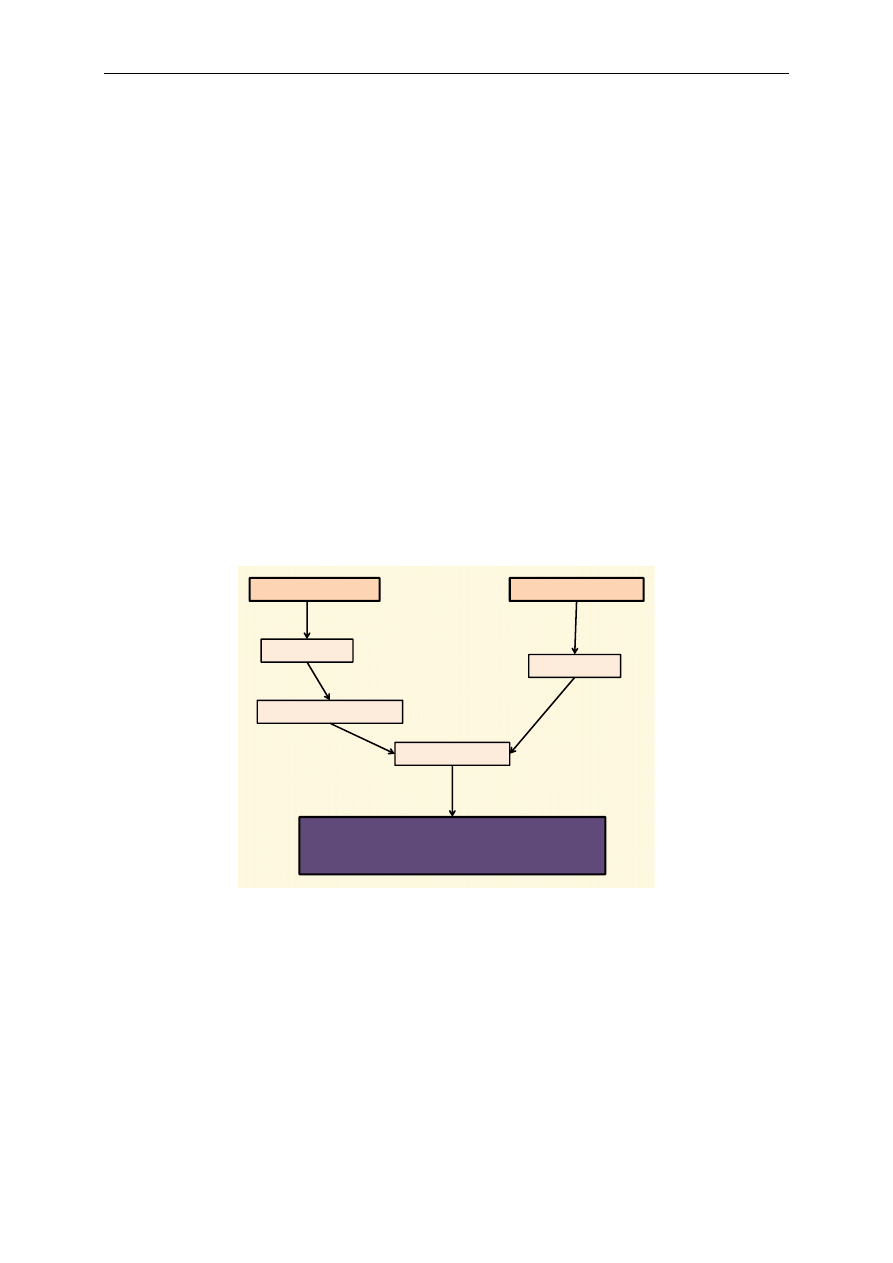
5. Kwasy nukleinowe i biosynteza białka
47
nego z atomem węgla na drodze fosforylacji, po której następuje wymiana grupy fosforanowej przez
jon amonowy lub grupę aminową. Na etapie początkowym i końcowym dochodzi do przyłączenia gru-
py formylowej z N
10
-formylotetrahydrofolianu, usuwany jest fumaran, następuje cyklizacja cząsteczki
i powstanie pierwszego nukleotydu purynowego, czyli inozynomonofosforan (IMP), który jest prekurso-
rem AMP i GMP.
W przypadku powstawania AMP grupa aminowa zostaje wprowadzona w miejsce tlenu karbo-
nylowego przy szóstym węglu. Dawcą grupy fosforanowej jest GTP, a reakcję tę katalizuje syntaza
adenylobursztynianowa. Synteza GMP rozpoczyna się od przyłączenia cząsteczki H
2
O oraz odwodo-
rowania z udziałem NAD
+
, po których następuje zamiana tlenu grupy karbonylowej na grupę amino-
wą, pochodzącą z hydrolizy glutaminy.
5.4.3. Degradacja pirymidyn
W procesie degradacji nukleotydów pirymidynowych powstają metabolity: CO
2
, NH
3
, β-alanina
oraz β-aminoizomaślan, które są bardzo dobrze rozpuszczalne w wodzie.
Od cytozyny jest odszczepiany amoniak i powstaje uracyl. Gdy do uracylu i tyminy przyłącza
się wodór, następuje utrata podwójnego wiązania między czwartym i piątym węglem. Pod wpływem
oksygenazy dochodzi do rozerwania podwójnego wiązania pomiędzy pierwszym azotem a szóstym
węglem. Z uracylu powstaje kwas ureidopropionowy, a z tyminy ureidoizomasłowy. Te dwa związ-
ki tracą amoniak oraz ditlenek węgla i tworzą β-alaninę lub β-aminoizomaślan.
5.4.4. Degradacja puryn
Końcowym produktem degradacji nukleotydów purynowych u człowieka jest kwas moczowy.
KWAS MOCZOWY
hipoksantyna
inozyna
adenozyna
deaminaza adenozynowa
guanozyna
guanina
ksantyna
oksydaza ksantynowa
Ryc. 15. Schemat degradacji puryn
Znane są liczne genetyczne zaburzenia katabolizmu puryn. Defekty genetyczne syntazy PRPP
objawiają się w postaci dny moczanowej (skazy moczanowej). Gdy stężenie moczanu w surowicy
krwi przekroczy limit rozpuszczalności, dochodzi do krystalizacji moczanu sodu w tkankach miękkich
i stawach, co prowadzi do reakcji zapalnej. Jednak w większości przypadków przyczyną dny jest za-
burzenie w usuwaniu kwasu moczowego przez nerki.
5.5. Replikacja DNA
Replikacja to proces, w którym następuje podwojenie materiału genetycznego. Jest to proces
enzymatyczny, katalizowany przez polimerazy DNA, mające zdolność wydłużania istniejących już
fragmentów DNA, lecz niemogące rozpocząć ich syntezy. Do zainicjowania polimerazy DNA po-
trzebny jest starter RNA (primer) – stanowiący krótki fragment RNA zbudowany z 10 nukleotydów,
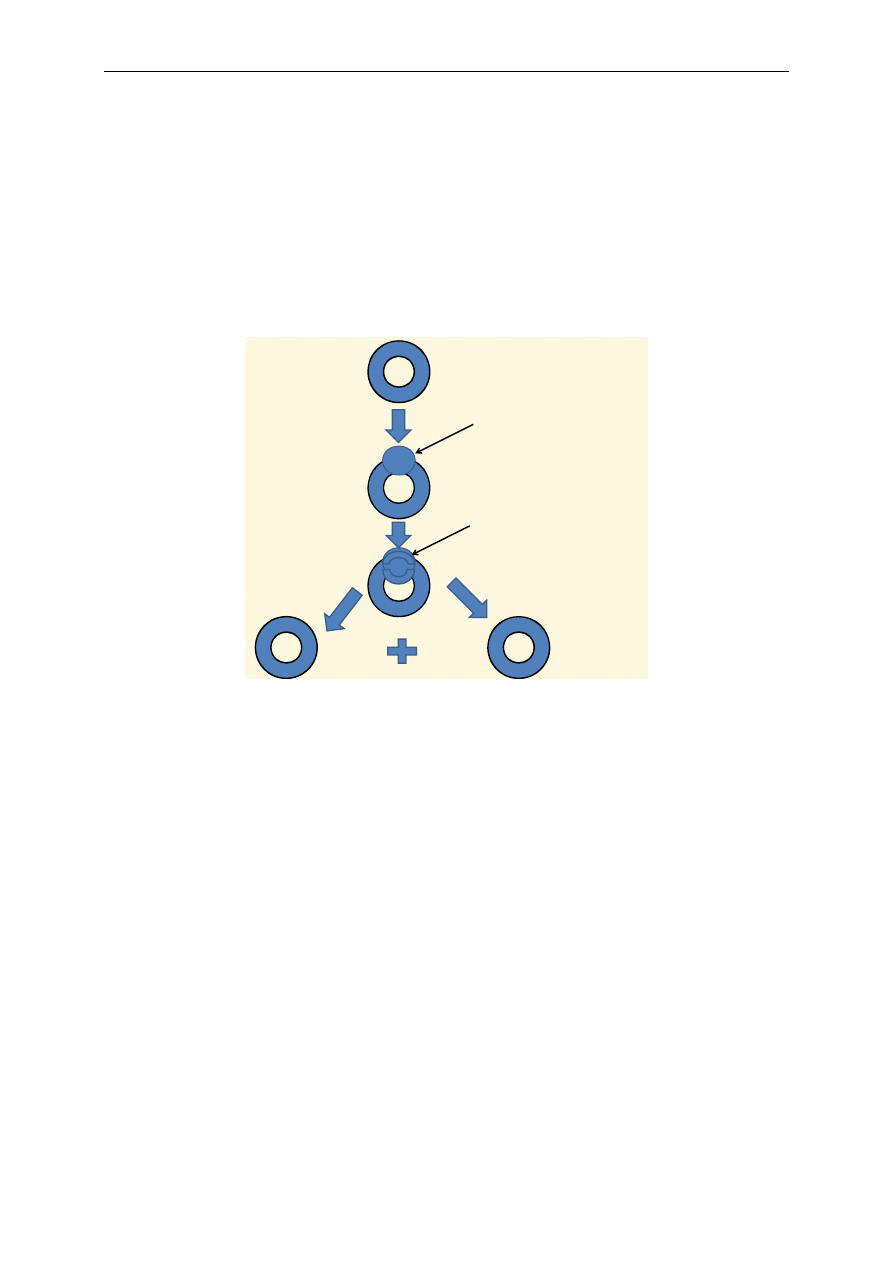
Część I. Zarys przemian biochemicznych
48
komplementarny (czyli odpowiadający) do matrycy DNA. Polimerazy DNA działają od końca 5’ do
3’ łańcucha nukleinowego i dlatego replikacja również będzie przebiegała tylko w tym kierunku.
Replikacja jest procesem semikonserwatywnym, co oznacza, że synteza nowych łańcuchów
DNA zachodzi zawsze z zachowaniem łańcuchów starych – rozdzielone nici są dokładnie kopiowane
podczas syntezy, dając dwie nowe cząsteczki. Obie macierzyste nici, służące jako matryce do syntezy
DNA, są zorientowane w przeciwnych kierunkach (tzn. po przeciwnej stronie podwójnej nici DNA
leżą końce 5’ i 3’). Tylko jedna z nici potomnych może się wydłużać w sposób ciągły zgodnie z ruchem
widełek replikacyjnych (są to fragmenty macierzystych nici, w obrębie których zachodzi replikacja).
Demontaż chromatyny (czyli usunięcie wszystkich elementów biorących udział w upakowaniu DNA)
w celu skopiowania DNA opóźnia przesuwanie się widełek i powoduje powstawanie krótkich frag-
mentów nici opóźnionej. Proces replikacji składa się z trzech etapów: inicjacji, elongacji i replikacji.
KULISTY GENOM
BĄBEL REPLIKACYJNY
WIDEŁKI REPLIKACYJNE
PODWOJONY
MATERIAŁ
GENETYCZNY
Ryc. 16. Schemat replikacji
5.5.1. Inicjacja replikacji
Rozpoczyna się w ściśle określonym miejscu chromosomu, czyli replikonie (jednostka genomu
o kształcie bąbla). U organizmów bezjądrowych (Prokariota) występuje tylko jedno takie miejsce, na-
tomiast u organizmów jądrowych (Eukariota) tysiące. Do zainicjowania replikacji i rozwinięcia po-
dwójnego heliksu niezbędne są: helikazy – enzymy rozrywające wiązania wodorowe między parami
zasad w łańcuchu DNA oraz białka SSB pomagające utrzymać z dala od siebie rozdzielone pojedyn-
cze nici podwójnego heliksu.
W DNA wyróżnia się 2 typy nici potomnych:
− nić prowadzącą (wiodąca lub wyprzedzająca) – syntetyzowaną w sposób ciągły w kierunku od 5`
do 3`, zgodnie z ruchem widełek replikacyjnych,
− nić opóźnioną – syntetyzowaną w sposób nieciągły, w kierunku przeciwnym do ruchu widełek,
w postaci krótkich fragmentów, nazywanych fragmentami Okazaki (około 1000 nukleotydów) łą-
czonych później kowalencyjnie przez ligazy DNA.
5.5.2. Elongacja replikacji
Polega na wydłużaniu starterów na niciach wiodącej i opóźnionej przez polimerazę DNA III.
Następnie są usuwane startery, a miejsca po nich są wypełniane przez polimerazę DNA I. Kolejnym
etapem, katalizowanym przez ligazę DNA jest powstawanie wiązań fosfodiestrowych między frag-
mentami Okazaki.
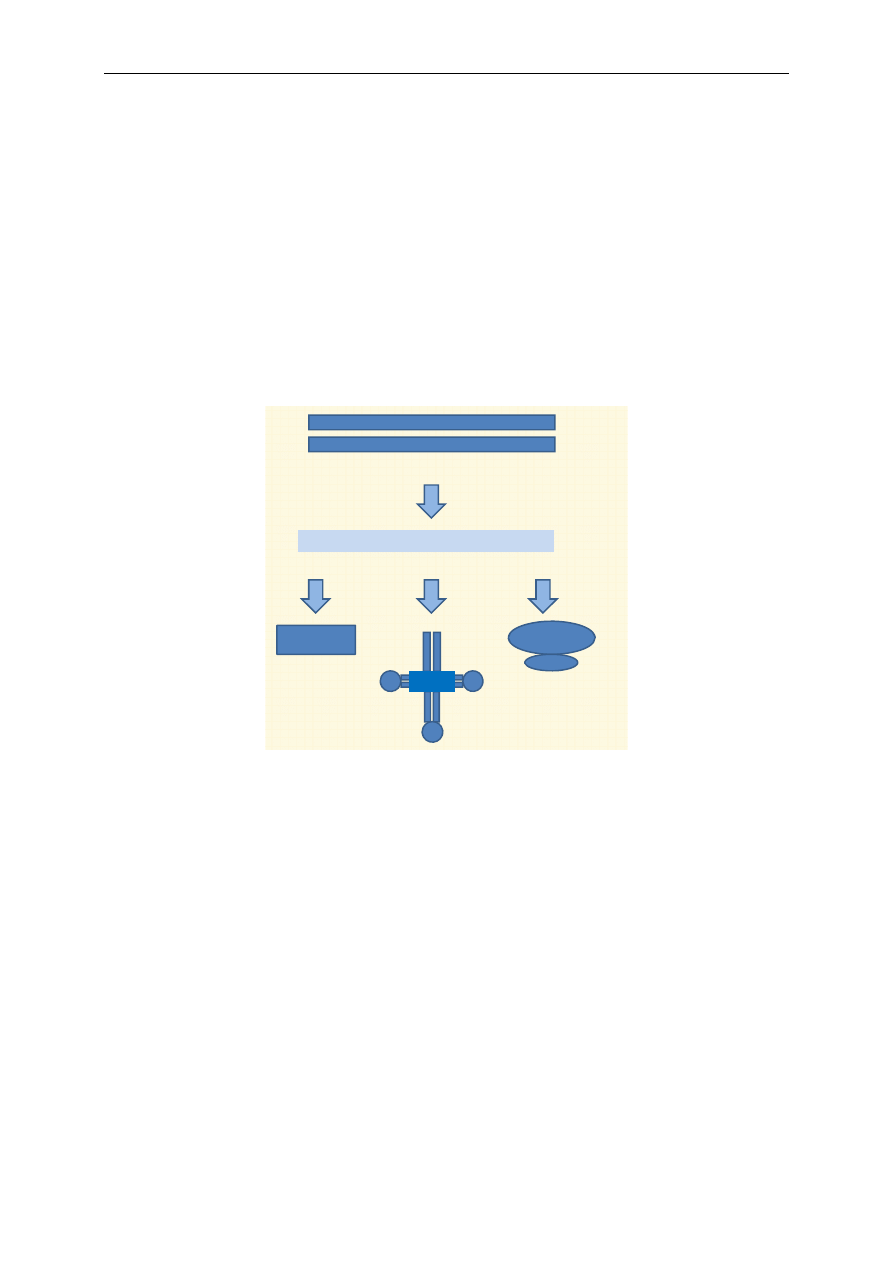
5. Kwasy nukleinowe i biosynteza białka
49
5.5.3. Terminacja replikacji
Końcowy etap syntezy DNA wymaga połączenia powstałych nici w kompletne chromosomy
i rozdzielenia ich między komórki potomne. Replikacja kończy się w momencie zetknięcia dwóch wi-
dełek replikacyjnych przesuwających się w przeciwnych kierunkach chromosomu.
5.6. Transkrypcja
Proces ten polega na syntezie jednoniciowego RNA na matrycy DNA. Przebiegająca w kierun-
ku od 5’ do 3’. Jest to pierwszy etap procesu ekspresji genów, który ostatecznie prowadzi do syntezy
białka kodowanego przez gen. W procesie tym jedna z dwóch nici DNA jest transkrybowana – infor-
macja zawarta w sekwencji nukleotydów DNA zostaje przepisana komplementarnie na RNA (mRNA),
a jego sekwencja odpowiada sekwencji nici DNA. Proces ten katalizuje polimeraza RNA, która nie
wymaga startera, lecz matrycy, czyli DNA i prekursorowych rybonukleotydów: ATP, GTP, CTP
i UTP. U organizmów prokariotycznych omawiany proces, składa się z trzech etapów, a u eukariota
z czterech.
DNA
TRANSKRYPCJA
mRNA
rRNA
tRNA
rRNA
Ryc. 17. Schemat transkrypcji
5.6.1. Inicjacja
Matryce DNA zawierają rejony zwane promotorami (specyficzne ułożenie nukleotydów), któ-
re znajdują się na początku genu od strony 5’ przed regionem kodującym. W specyficzny sposób wią-
żą one polimerazy RNA i determinują miejsce startu transkrypcji. Ponadto w miejscu promotorowym
nić DNA ulega rozpleceniu.
U prokariota miejscami promotorowymi są sekwencje TATAAT (kaseta Pribnowa) oraz
TTGACA. Natomiast u eukariota miejsce promotorowe to sekwencja TATAAA, nazywana kasetą TATA
(kaseta Hognessa), oraz sekwencja CAAT.
5.6.2. Elongacja transkrypcji
Polimeraza RNA, przesuwając się wzdłuż DNA zgodnie z jego sekwencją, syntetyzuje łańcuch
RNA. Odcinek DNA przed przemieszczającą się polimerazą ulega rozpleceniu i splata się ponownie
za nią.
5.6.3. Terminacja transkrypcji
Polimeraza RNA przemieszcza się aż do osiągnięcia miejsca terminacji transkrypcji, zwanego
sekwencją terminacyjną, która stanowi sygnał zakończenia transkrypcji. Sekwencje te zawierają re-
Część I. Zarys przemian biochemicznych
50
giony komplementarne względem siebie. W produkcie transkrypcji, czyli w RNA, tworzą one drugo-
rzędową strukturę typu ramię – pętla lub spinka do włosów. Dodatkowo za strukturą spinki występują
często ponad cztery reszty uracylu, co powoduje zatrzymanie polimerazy i transkrypcji.
5.6.4. Dojrzewanie RNA u eukariota
Większość eukariotycznych genów kodujących białka jest nieciągła, co oznacza, że występują
odcinki genu kodujące, zwane eksonami, rozdzielone odcinkami niekodującymi, intronami. Proces
dojrzewania polega m.in. na modyfikacji końców 5` i 3`, po którym następuje splicing (składanie) po-
legające na precyzyjnym wycinaniu sekwencji intronowych i łączeniu końców sąsiadujących ekso-
nów. Bierze w nim udział mały jądrowy RNA (snRNA).
Ostatnim etapem jest redagowanie RNA. Pojedyncze nukleotydy w obrębie mRNA mogą pod-
legać wymianie na inne, delecji lub być wprowadzone dodatkowe nukleotydy.
5.7. Translacja – biosynteza białka
Jest to ostatni etap ekspresji informacji genetycznej w komórce. Informacja zaszyfrowana
w łańcuchu mRNA za pośrednictwem „adaptorowych” cząsteczek tRNA jest tłumaczona na sekwen-
cję aminokwasów w białku. Kolejność włączania poszczególnych aminokwasów jest determinowana
przez sekwencje nukleotydów w genach strukturalnych. Biosynteza białka zachodzi u wszystkich
organizmów tak samo, czyli w kierunku od końca aminowego do karboksylowego rosnącego łańcucha
polipeptydowego. Aminokwasy dostarczane do syntetyzowanego łańcucha występują w formie
aktywnej, czyli pod postacią aminoacylo-tRNA.
I etap – dwuetapowa aktywacja aminokwasu, energia do przeprowadzenia tej reakcji pocho-
dzi z ATP.
aminokwas + ATP
aminoacylo-AMP
aminoacyloAMP + tRNA
aminoacylo-tRNA + AMP
II etap – synteza łańcucha polipeptydowego na rybosomie – obejmuje trzy stadia: inicjację,
elongację oraz terminację.
Inicjacja decyduje o prawidłowym odczytaniu informacji genetycznej zawartej w mRNA. Rybosom
i inicjatorowy tRNA muszą rozpoznać w mRNA właściwe miejsce rozpoczęcia syntezy polipeptydu.
Najpierw niezbędne jest zorganizowanie rybosomu, do czego są potrzebne trzy czynniki inicjujące
IF1, IF2 i IF3, odpowiedzialne za połączenie się dużej i małej podjednostki rybosomu. Tak złożony
rybosom posiada dwa miejsca wiążące tRNA: miejsce A, w którym są wiązane aminoacylo-tRNA,
oraz miejsce P, w którym znajduje się peptydylo-tRNA. Rybosom ma ponadto zdolność rozpoznawa-
nia na mRNA kodonu AUG, od którego rozpoczyna się synteza polipeptydu.
W stadium elongacji syntetyzowany łańcuch polipeptydowy wydłuża się o dalsze aminokwasy
przynoszone przez kolejne cząsteczki tRNA do miejsca A rybosomu. W tym etapie uczestniczą czyn-
niki elongacyjne EF-Tu, EF-Ts oraz EF-G.
Gdy miejsca A oraz P rybosomu są zajęte przez odpowiednie aminokwasy, peptydylotransfera-
za tworzy wiązanie peptydowe. Energia do tej reakcji pochodzi od ATP. Proces przebiega w trzech
cyklach elongacyjnych.
W zakończeniu translacji tj. w terminacji, biorą udział czynniki uwalniające – RF, oddziałujące
ze specyficznymi kodonami terminacyjnymi UAA, UAG, UGA, co prowadzi do uwolnienia gotowego
łańcucha polipeptydowego. Dzięki czynnikom RF peptydylotransferaza przenosi nowo zsyntetyzowa-
ny polipeptyd na cząsteczkę wody, a nie na aminoacylo-tRNA i w ten sposób uwalnia się nowe białko.
Następuje wówczas rozpad rybosomu na dwie podjednostki, uwolnienie tRNA oraz oddysocjowanie
mRNA.
5.8. Hamowanie biosyntezy białka
Biosynteza białek może być hamowana przez antybiotyki – substancje syntetyzowane przez mi-
kroorganizmy, działające toksycznie na inne mikroorganizmy. Niektóre antybiotyki nietoksyczne dla
człowieka znalazły zastosowanie w farmakoterapii. Są to:
5. Kwasy nukleinowe i biosynteza białka
51
− puromycyna – hamuje biosyntezę białka na wszystkich rybosomach, jest analogiem aminoacylo-
-tRNA i wbudowuje się w miejsce A na rybosomie do karboksykońcowego peptydu, co powoduje
natychmiastowe zakończenie translacji i uwolnienie niedokończonego białka,
− tetracyklina – blokuje miejsce A na rybosomie prokariotycznym i uniemożliwia dostęp aminoacy-
lo-tRNA,
− chloramfenikol – u prokariontów hamuje aktywność peptydylotransferazy podjednostki ryboso-
mowej 50S,
− streptomycyna – u prokariontów hamuje prawidłową inicjację translacji,
− toksyna maczugowca błonicy – jedna z najsilniejszych toksyn, działa na czynnik elongacyjny eu-
kariontów, co prowadzi do śmierci komórki,
− rycyna – silna trucizna otrzymywana z nasion rącznika pospolitego, powoduje inaktywację mniej-
szej podjednostki rybosomu eukariotycznego,
− cykloheksymid – u eukariontów hamuje aktywność peptydylotransferazy podjednostki większej
rybosomu.
Biosynteza białka hamowana jest również przez analogi aminokwasów. Białka zawierające ana-
logi aminokwasowe nie mogą pełnić ich funkcji biologicznych, są trawione do produktów drobnoczą-
steczkowych.
5.9. Kod genetyczny
Kod genetyczny to układ kodonów, czyli trzech kolejnych nukleotydów (tripletów) informacyj-
nego RNA (mRNA), które wyznaczają pozycje aminokwasów w łańcuchu polipeptydowym białek.
Istnieją 64 triplety kodu, z których 61 koduje 20 aminokwasów. Aż 18 z 20 aminokwasów jest kodo-
wanych przez więcej niż jeden kodon. Triplety: UAA (ochre), UAG (amber) i UGA (opal) nie kodują
żadnego aminokwasu. Generalnym kodonem inicjacji syntezy łańcucha polipeptydowego jest trinu-
kleotyd AUG.
Tabela II. Kod genetyczny – kodony
Pierwsza
pozycja
Koniec 5’
Druga pozycja
Trzecia
pozycja
Koniec 3’
U
C
A
G
Phe
Ser
Tyr
Cys
U
Phe
Ser
Tyr
Cys
C
Leu
Ser
Stop
Stop
A
U
Leu
Ser
Stop
Trp
G
Leu
Pro
His
Arg
U
Leu
Pro
His
Arg
C
Leu
Pro
Gln
Arg
A
C
Leu
Pro
Gln
Arg
G
Ile
Thr
Asn
Ser
U
Ile
Thr
Asn
Ser
C
Ile
Thr
Lys
Arg
A
A
Met
Thr
Lys
Arg
G
Val
Ala
Asp
Gly
U
Val
Ala
Asp
Gly
C
Val
Ala
Glu
Gly
A
G
Val
Ala
Glu
Gly
G
Kod genetyczny jest:
− trójkowy – trzem kolejnym nukleotydom w łańcuchu mRNA odpowiada jeden aminokwas,
− jednoznaczny – jedna trójka nukleotydów koduje zawsze jeden i tylko jeden określony aminokwas,

Część I. Zarys przemian biochemicznych
52
− zdegenerowany – miejsce tego samego aminokwasu w łańcuchu polipeptydowym może być wyzna-
czone przez więcej niż jeden trinukleotyd,
− niezachodzący – w łańcuchu mRNA odczytywane są kolejne triplety i każdy z nukleotydów wcho-
dzi w skład tylko jednego kodonu,
− współliniowy – kolejność kodonów w mRNA odpowiada kolejności aminokwasów wbudowywa-
nych w łańcuch polipeptydowy zgodnie z tymi kodonami,
− bezprzecinkowy – odczytywany jako pismo w sposób ciągły, z lewa na prawo, począwszy od kodo-
nu startowego, a kończąc na kodonie „STOP”,
− uniwersalny – kodony dla poszczególnych aminokwasów są identyczne u wszystkich organizmów.
P i ś m i e n n i c t w o
1. Bańkowski E. Biochemia. Podręcznik dla studentów uczelni medycznych. Wydawnictwo Medyczne
Urban & Partner, Wrocław 2004, s. 483–484.
2. Biochemia Harpera ilustrowana. Red. R.K. Murray, D.K. Granner, V.W. Rodwell. Wydawnictwo
Lekarskie PZWL, Warszawa 2008, s. 362–374, 439.
3. Freedland R.A., Miesfeld R.L., Matthews H.R. Biochemia i biologia molekularna w zarysie. Wy-
dawnictwo Prószyński, Warszawa 2000, s. 363–415.

6. HEMOGLOBINA I BARWNIKI ŻÓŁCIOWE
Iwona Błaszczyk
6.1. Erytrocyty
Fizjologicznym hormonem krwiotworzenia niezbędnym do powstania krwinek czerwonych jest
erytropoetyna (EPO). Miejscem jej wytwarzania są przede wszystkim nerki, ale zdolność tę wykazują
także komórki wątroby (główne źródło erytropoetyny w okresie płodowym), makrofagi i niektóre
komórki nowotworowe. W nerce syntetyzowany jest tzw. nerkowy czynnik erytopoetyczny, który jest
prekursorem aktywnej cząsteczki erytropoetyny.
Proces biosyntezy erytropoetyny regulują:
− stężenie tlenu we krwi dopływającej do nerek i dostępność tlenu dla tkanek,
− hormony tarczycy,
− hormony nadnerczy,
− hormony przysadki,
− substancje hamujące metabolizm i zmniejszające utlenowanie tkanek, np. sole kobaltu.
W reakcjach tych pośredniczą różne drobnocząsteczkowe i wielkocząsteczkowe związki, głów-
nie prostaglandyny.
Podstawową funkcją erytrocytów, czyli dojrzałych komórek układu czerwonokrwinkowego, jest
dostarczanie tkankom tlenu, usuwanie z nich ditlenku węgla (CO
2
) oraz utrzymanie równowagi kwa-
sowo-zasadowej. Spośród substancji białkowych zawartych w erytrocytach główne miejsce zajmuje
hemoglobina. Inne białka to przede wszystkim enzymy, m.in. katalaza, anhydraza węglanowa, reduk-
tazy methemoglobiny oraz peroksydaza glutationowa i reduktaza glutationowa.
6.2. Budowa hemoglobiny
Hemoglobina (Hb) jest hemoproteiną złożoną z części białkowej i grupy prostetycznej – hemu.
Grupa hemowa jest połączeniem pierścienia protoporfiryny z dwuwartościowym jonem żelaza. Proto-
porfirynę tworzą cztery pierścienie pirolowe, które łączą ze sobą mostki metinowe. Atom żelaza jest
umiejscowiony w centrum pierścienia protoporfiryny. Część białkowa hemoglobiny zbudowana jest
z czterech łańcuchów polipeptydowych, tworzących cząsteczkę globiny. W ludzkiej globinie mogą
występować łańcuchy
α, β, γ, δ, ε (alfa, beta, gamma, delta i epsilon).
Zależnie od obecności różnych rodzajów łańcuchów polipeptydowych w globinie, wyróżnia się
następujące prawidłowe hemoglobiny ludzkie:
− embrionalne: prehemoglobiny (występujące już w pierwszych tygodniach po zapłodnieniu), Gower
I (zawiera cztery łańcuchy
ε) oraz Gower II (zbudowana z dwóch łańcuchów α i dwóch łańcuchów ε);
− płodowa (HbF) – złożona z dwóch łańcuchów α i dwóch łańcuchów γ; u płodu i noworodka stanowi
ona około 75% całkowitej ilości hemoglobiny, u człowieka dorosłego jej stężenie wynosi ≤ 5%;
− HbA
1
– zbudowana z dwóch łańcuchów
α i dwóch łańcuchów β, jest podstawową hemoglobiną
u osób dorosłych, stanowi około 97% całkowitej ilości hemoglobiny;
− HbA
2
– zawiera dwa łańcuchy
α i dwa łańcuchy δ, występuje jako 2,5% całkowitej ilości hemoglo-
biny u dorosłego.
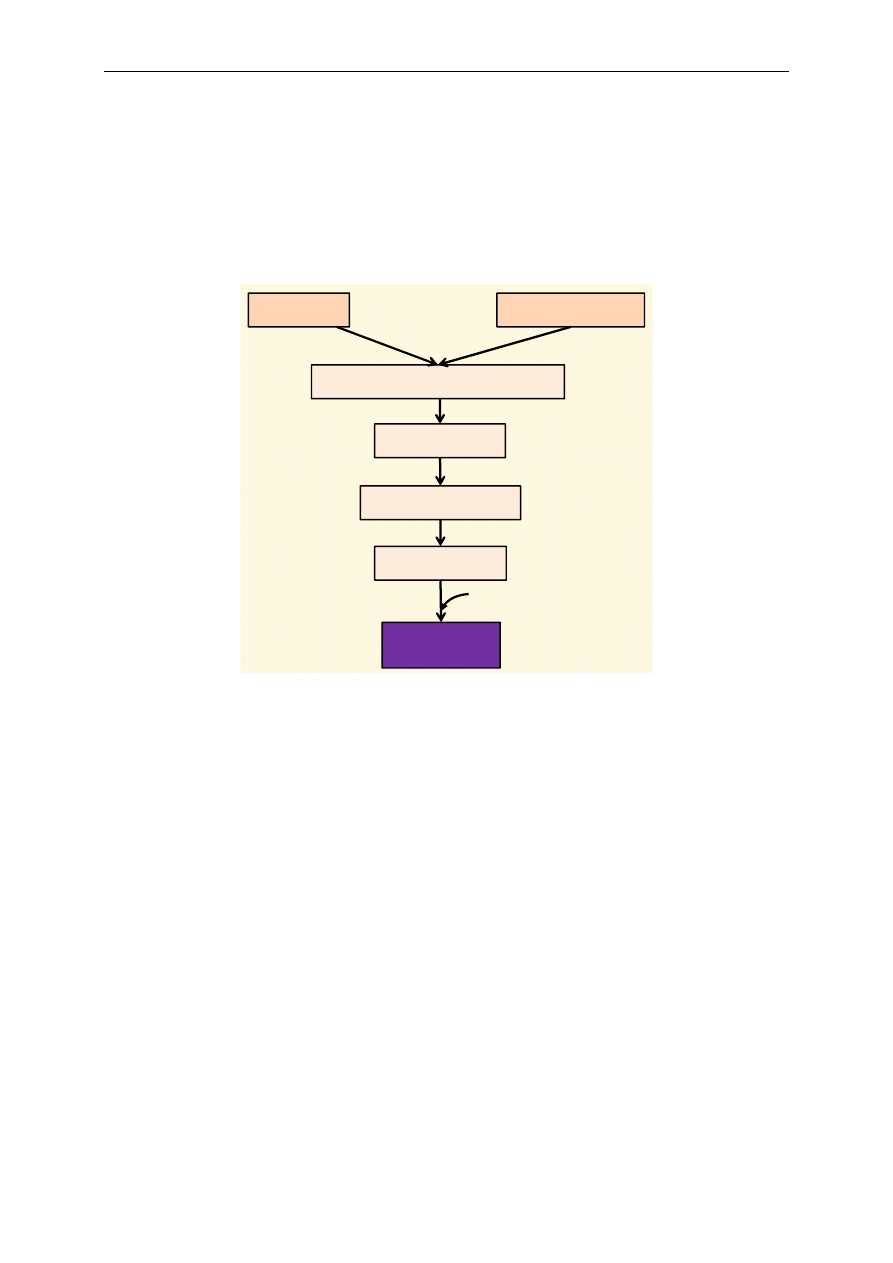
Część I. Zarys przemian biochemicznych
54
6.3. Biosynteza hemu i globiny
Substratami dla syntezy hemu są glicyna i sukcynylo~CoA. Przy udziale enzymu syntetazy
ALA powstaje kwas delta-aminolewulinowy (ALA), który ulega kondensacji pod wpływem dehydra-
tazy ALA. W ten sposób powstaje porfobilinogen, który jest pierwszym związkiem pośrednim w bio-
syntezie hemu posiadającym w swoim składzie pierścień indolowy. Dalsze przemiany porfobilinogenu
prowadzą poprzez kondensację jego czterech cząsteczek do powstania uroporfirynogenu, a następnie
protoporfiryny. Ostatnim etapem jest wbudowanie atomu żelaza do cząsteczki protoporfiryny. Reakcja
ta jest katalizowana przez ferrochelatazę.
glicyna
sukcynylo-CoA
HEM
kwas delta-aminolewulinowy
porfobilinogen
uroporfirynogen
protoporfiryna
Fe
2+
Ryc. 18. Powstawanie hemu
Biosynteza globiny obejmuje procesy powstawania wszystkich rodzajów łańcuchów polipepty-
dowych wchodzących w skład globiny. Poszczególne podjednostki globiny, głównie łańcuchy alfa
i beta, są syntetyzowane oddzielnie, a po połączeniu z hemem tworzą cząsteczkę hemoglobiny.
6.4. Rola hemoglobiny
Erytrocyty spełniają funkcję wymiany gazowej dzięki hemoglobinie. Zależność stopnia wysy-
cenia hemoglobiny tlenem od cząsteczkowego ciśnienia tlenu określa krzywa dysocjacji, przyjmująca
w prawidłowych warunkach kształt sigmoidalny. Za powinowactwo hemoglobiny do tlenu odpowia-
dają następujące czynniki:
− stężenie hemoglobiny – w rozcieńczonych roztworach powinowactwo Hb do tlenu wzrasta,
− stężenie CO
2
i pH – zależność między wiązaniami O
2
, H
+
i CO
2
to tzw. efekt Bohra, podwyższone
stężenie H
+
i CO
2
w naczyniach włosowatych i tkankach ułatwia uwalnianie tlenu z oksyhemoglo-
biny, natomiast duże stężenie tlenu w pęcherzykach płucnych powoduje oddawanie H
+
i CO
2
z he-
moglobiny,
− stężenie 2,3-difosfoglicerynianu (DPG) w erytrocycie – związek ten łączy się z hemoglobiną nie-
utlenowaną i powoduje zmniejszenie jej powinowactwa do tlenu, z kolei utlenowana hemoglobina
łączy się z DPG,
− temperatura – ma największy wpływ na reakcję przyłączania tlenu do pierwszego układu hemowe-
go,
− stężenie NaCl w erytrocytach i osoczu – małe stężenia chlorku sodu powodują zwiększenie powi-
nowactwa Hb do tlenu.

6. Hemoglobina i barwniki żółciowe
55
6.5. Pochodne hemoglobiny
Hemoglobina i oksyhemoglobina mogą ulegać przekształceniu w pochodne nieposiadające zdol-
ności wiązania tlenu. Należą do nich karboksyhemoglobina, methemoglobina, sulfohemoglobina i cy-
janomethemoglobina.
6.5.1. Karboksyhemoglobina
Powinowactwo tlenku węgla (CO) do hemoglobiny jest około 200–300 razy większe niż powi-
nowactwo tlenu. W wyniku tej reakcji powstaje karboksyhemoglobina (HbCO). Jej prawidłowe stęże-
nie wynosi do 1% całkowitego stężenia Hb. Zwiększone stężenie HbCO stwierdza się: w zatruciach
tlenkiem węgla (np. przy nieszczelnej wentylacji pieców gazowych i węglowych), u osób aktywnie
palących tytoń, u biernych palaczy tytoniu oraz u mieszkańców aglomeracji miejskich.
Zatrucie tlenkiem węgla prowadzi do upośledzenia funkcji ważnych dla życia układów, zwłasz-
cza ośrodkowego układu nerwowego. Głównym elementem leczenia zatruć jest intensywna tlenotera-
pia, ponieważ zwiększenie wentylacji pęcherzykowej i stężenia tlenu w powietrzu oddechowym znacz-
nie przyspiesza dysocjację HbCO.
6.5.2. Methemoglobina
Po utlenieniu Fe
2+
do Fe
3+
w hemoglobinie (np. pod wpływem żelazicyjanku potasu) powstaje
methemoglobina (MetHb). Jej obecność przy braku innych objawów klinicznych może wskazywać na:
wrodzony niedobór reduktazy methemoglobiny, zatrucie związkami wywołującymi methemoglobine-
mię (np. nitrobenzen, sulfonamidy) bądź na obecność hemoglobin ulegających autooksydacji. U osób
zdrowych stężenie MetHb we krwi wynosi od 0,7% do 1,7% całkowitego stężenia Hb.
6.5.3. Cyjanomethemoglobina
Cyjanomethemoglobina powstaje w reakcji methemoglobiny z anionami cyjanowymi. Jest to
połączenie nietoksyczne, umożliwiające odblokowanie cytochromów. Powstaje po podaniu np. azoty-
nu sodu osobom zatrutym cyjanowodorem.
6.5.4. Sulfohemoglobina
Sulfohemoglobina powstaje pod wpływem siarkowodoru lub siarczków, wywołując sulfohemo-
globinemię. Jej przyczyną jest najczęściej stosowanie niektórych leków, głównie fenacetyny. Do sta-
łych objawów tej choroby należy „szara” sinica. Sulfohemoglobina jest połączeniem trwałym i pozo-
staje w erytrocytach do końca ich życia.
6.6. Hemoglobiny patologiczne
Nieprawidłowa budowa hemoglobiny prowadzi do wystąpienia chorób typu hemoglobinopatii,
talasemii lub porfirii. Powodem hemoglobinopatii są mutacje genów kodujących łańcuchy polipepty-
dowe hemoglobiny, które prowadzą do zmiany struktury łańcuchów, a więc do zaburzeń funkcji Hb.
Przykładem jest hemoglobina S, wykazująca zmniejszoną rozpuszczalność formy nieutlenowanej, jej
obecność powoduje wystąpienie anemii sierpowatej. Podłożem talasemii jest natomiast zmniejszona
synteza łańcuchów polipeptydowych. Z kolei nieprawidłowości w zakresie biosyntezy układu hemo-
wego są przyczyną porfirii.
6.7. Powstawanie barwników żółciowych
Proces rozpadu erytrocytów, połączony z uwolnieniem wewnątrzkomórkowych składników jest
określany jako hemoliza. Możliwa jest hemoliza in vivo (w organizmie żywym) lub in vitro (poza
organizmem). Wskaźnikiem wystąpienia tego procesu w organizmie jest wysoka aktywność dehydro-
genazy mleczanowej i fosfatazy kwaśnej, ale bez jednoczesnego zwiększenia stężenia potasu w oso-
czu. Uwolnienie potasu i zmniejszenie stężenia sodu i chlorków towarzyszy hemolizie in vitro.
Okres przeżycia krwinek czerwonych w układzie krążenia wynosi około 120 dni. Hemoglobina
uwolniona z erytrocytów ulega szybko utlenieniu do MetHb, która w przypadku wystąpienia hemolizy
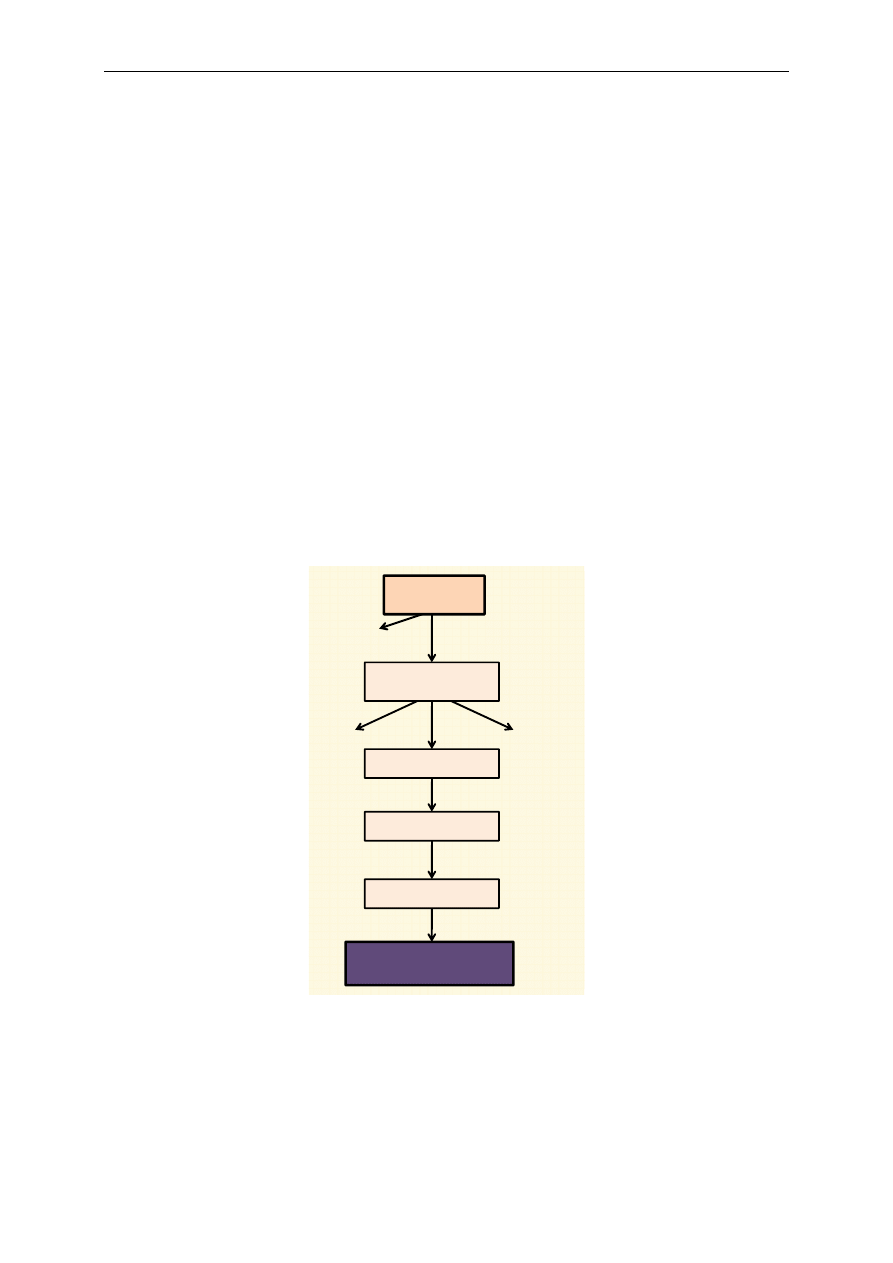
Część I. Zarys przemian biochemicznych
56
w łożysku naczyniowym łączy się z białkiem haptoglobiną. Powstały kompleks jest wychwytywany
przez komórki układu siateczkowo-śródbłonkowego (w śledzionie, wątrobie i szpiku kostnym). Pierw-
szy etap rozpadu hemu ma miejsce wówczas, gdy jest on jeszcze połączony z globiną. Pod wpływem
oksygenazy hemowej następuje odszczepienie mostka
α-metinowego i uwolnienie go w postaci tlenku
węgla. Tak powstaje choleoglobina, która ulega rozpadowi na biliwerdynę, jon żelazowy i globinę.
Część białkowa hemoglobiny jest hydrolizowana do wolnych aminokwasów, które mogą być wyko-
rzystane ponownie. Żelazo uwolnione z układu hemowego jest włączane w ogólną pulę żelaza w orga-
nizmie. Biliwerdyna jest redukowana do bilirubiny, która z komórek układu siateczkowo-śródbłon-
kowego przenika do krwi, gdzie łączy się z albuminą. W ten sposób powstaje nierozpuszczalna w wo-
dzie bilirubina pośrednia (bilirubina wolna). Kompleks ten jest wychwytywany przez komórki wą-
troby.
Dalszym etapem przemian bilirubiny jest odłączenie od niej albuminy i połączenie z kwasem
glukuronowym przy udziale UDP-glukuronylotransferazy (możliwe są również połączenia z siarcza-
nem, adenozynometioniną, glicyną lub tauryną). Powstały diglukuronian bilirubiny i pozostałe sprzę-
żone pochodne noszą nazwę bilirubiny bezpośredniej (bilirubina związana), która jest rozpuszczal-
na w wodzie. Sprzężona bilirubina jest wydalana z żółcią do jelita. W przewodzie pokarmowym swo-
iste enzymy bakteryjne odłączają kwas glukuronowy z diglukuronianu bilirubiny i redukują bilirubinę
do bezbarwnych związków, zwanych urobilinogenami. W jelicie krętym oraz w grubym część urobili-
nogenów jest zwrotnie wchłaniana i ponownie wydzielana do wątroby, co stanowi krążenie jelitowo-
wątrobowe barwników żółciowych. Nieznaczna część urobilinogenu przechodzi do krążenia i tą drogą
do nerek. Większość bezbarwnych urobilinogenów utlenia się do barwnych związków, czyli urobilin,
wydalanych głównie z kałem i w minimalnej ilości z moczem. Bilirubina ma właściwości przeciwu-
tleniające, utleniając się do biliwerdyny, która jest redukowana ponownie do bilirubiny.
urobilina
urobilinogen
bilirubina
biliwerdyna
choleoglobina
HEM
CO
Fe
3+
Globina
Ryc. 19. Powstawanie barwników żółciowych
6.8. Żółtaczki
Stan charakteryzujący się zwiększonym stężeniem bilirubiny we krwi to hiperbilirubinemia
(żółtaczka). Powyżej stężenia około 34,2–42,75
μmol/l (2–2,5 mg%) bilirubina przenika do tkanek,
gdzie ulega gromadzeniu. Wyróżnia się trzy typy żółtaczek: hemolityczną, zastoinową oraz miąż-
szową.
6. Hemoglobina i barwniki żółciowe
57
6.8.1. Żółtaczka hemolityczna
W zdrowym organizmie zdolność wątroby do przekształcania bilirubiny jest wykorzystywana
w 10%. W czasie nasilonego rozpadu hemoglobiny zostaje uruchomiona pozostała rezerwa. Stan taki,
indukowany wzmożonym rozpadem erytrocytów, prowadzi do rozwoju żółtaczki hemolitycznej i wy-
stępuje w przypadku: konfliktu serologicznego u noworodków, przetoczenia krwi niezgodnej grupo-
wo, niedokrwistości hemolitycznych oraz malarii.
Wzmożone uwalnianie i katabolizm hemoglobiny prowadzi do powstawania bilirubiny w stęże-
niach przekraczających możliwość jej sprzęgania w wątrobie. Obserwuje się wówczas: zwiększone
stężenie bilirubiny pośredniej w krwi, zwiększone wydalanie urobilinogenu z moczem i kałem, zwięk-
szone stężenie żelaza we krwi oraz zwiększoną aktywność dehydrogenazy mleczanowej (LDH) we
krwi.
Fizjologicznie nasilony rozpad erytrocytów występuje w pierwszych dniach po urodzeniu. Nasi-
lona żółtaczka noworodków jest jednak niebezpieczna dla organizmu noworodka mającego niewielką
wydajność procesu glukuronizacji bilirubiny w wątrobie. Dochodzi wówczas do odkładania bilirubiny
w mózgowiu i rozwoju żółtaczki jąder podkorowych.
6.8.2. Żółtaczka zastoinowa
Jeśli odpływ żółci z wątroby jest utrudniony z powodu przeszkody mechanicznej (np. kamica
dróg żółciowych, nowotwór brodawki Vatera), dochodzi do rozwoju żółtaczki zastoinowej. Bilirubina
sprzężona nie jest wówczas transportowana z wątroby poprzez żółć do jelita, wskutek czego digluku-
ronian bilirubiny przenika do krwi, wywołując:
− zwiększone stężenie bilirubiny bezpośredniej we krwi,
− obecność bilirubiny w moczu (składnik patologiczny moczu dający ciemne zabarwienie),
− brak urobilinogenu w moczu,
− brak lub ilości śladowe urobilinogenu i innych barwników żółciowych w kale (kał ulega odbarwie-
niu),
− zwiększoną aktywność fosfatazy zasadowej i γ-GT (γ-glutamylotransferazy) we krwi.
6.8.3. Żółtaczka miąższowa
Ten rodzaj żółtaczki spowodowany jest uszkodzeniem komórek wątrobowych przez wirusy,
bakterie, czynniki toksyczne lub genetycznie uwarunkowaną zmniejszoną aktywnością enzymów
uczestniczących w sprzęganiu bilirubiny w wątrobie. Martwica blaszek komórek wątrobowych od-
dzielających przestrzeń żółciową od krwi prowadzi do przenikania składników żółci do płynu poza-
komórkowego i krwi. W późniejszym czasie zmniejsza się wydolność enzymatyczna hepatocytów.
W żółtaczce miąższowej obserwuje się:
− zwiększone stężenie bilirubiny bezpośredniej i/lub pośredniej we krwi,
− zwiększone stężenie urobilinogenu w moczu,
− zmniejszone stężenie urobilinogenu w kale,
− zwiększoną aktywność enzymów: izoenzymu dehydrogenazy mleczanowej (LDH
5
), aminotransami-
nazy alaninowej (ALT) i aminotransaminazy asparaginowej (AST) we krwi.
Tabela III. Podstawowa diagnostyka żółtaczek
Bilirubina
Urobilinogen
Żółtaczka
we krwi
w moczu
w moczu
w kale
Hemolityczna
↑ pośredniej
brak
↑
↑
Zastoinowa
↑ bezpośredniej
obecna
brak
ilości śladowe
lub brak
Miąższowa
↑ pośredniej
i bezpośredniej
obecna
↑
↓

Część I. Zarys przemian biochemicznych
58
P i ś m i e n n i c t w o
1. Choroby wewnętrzne. Red. F. Kokot. Wydawnictwo Lekarskie PZWL, Warszawa 1991, s. 548–725,
784–832.
2. Ćwiczenia praktyczne z biochemii. Skrypt dla studentów II roku Wydziału Lekarskiego z Oddziałem
Lekarsko-Dentystycznym. Red. E. Birkner. Wydawnictwo SUM, Katowice 2006, s. 118–128.
3. Hematologia kliniczna. Red. K. Janicki. Wydawnictwo Lekarskie PZWL, Warszawa 1991, s. 103–
–127.

CZĘŚĆ II
PODSTAWY REGULACJI METABOLICZNYCH
7. HORMONY
Alina Ostałowska, Ewa Birkner
Do najważniejszych substancji regulujących procesy życiowe ustroju zalicza się hormony. Hor-
mon jest produktem wydzielania gruczołów bez przewodów wyprowadzających, uwalnianym w kata-
litycznych ilościach do krwi i transportowanym do swoistych komórek (lub narządów) docelowych,
gdzie wywołuje odpowiednie reakcje fizjologiczne, morfologiczne i biochemiczne.
Wszystkie narządy organizmu człowieka przejawiają funkcje wydzielnicze. Głównymi gruczo-
łami wewnętrznego wydzielania są:
− przysadka mózgowa (hormony tropowe – hormon adrenokortykotropowy, hormon wzrostu, prolak-
tyna),
− podwzgórze (hormony hipofizjotropowe – hormony uwalniające, wazopresyna, oksytocyna),
− gruczoł tarczowy (tyroksyna, trijodotyronina),
− nadnercza (mineralokortykoidy, glukokortykoidy, katecholaminy),
− przytarczyce (parathormon),
− gruczoły płciowe (testosteron, estradiol, progesteron),
− wyspy trzustkowe (insulina, glukagon, somatostatyna).
Inne narządy wewnątrzwydzielnicze wytwarzają następujące hormony:
− serce: przedsionkowy peptyd natriuretyczny (ANP),
− nerki: 1,25-dihydroksycholekalcyferol (kalcytriol),
− wątroba: 25-hydroksycholekalcyferol (kalcydiol),
− szyszynka: melatonina,
− skóra: kalcyferol (witamina D
3
),
− przewód pokarmowy: gastryna, cholecystokinina (CCK), sekretyna, wazoaktywny peptyd jelitowy
(VIP).
7.1. Funkcje i działanie hormonów
Hormony regulują podstawowe procesy życiowe organizmu, lecz nie zapoczątkowują reakcji
komórkowych de novo. W przeciwieństwie do witamin, nie pełnią żadnej funkcji odżywczej w odpo-
wiednich tkankach i nie są wbudowywane do innych cząsteczek jako ich część strukturalna. Jako re-
gulatory pobudzają albo hamują prędkość reakcji biochemicznych, kontrolując aktywność enzymów
i wywołując w następstwie tego morfologiczne, biochemiczne oraz czynnościowe zmiany w tkankach
docelowych. Termin „hormon” pochodzi z języka greckiego i oznacza „zwiększenie aktywności”. Dział
nauki dotyczący budowy i działania hormonów oraz funkcjonowania wydzielających je gruczołów to
endokrynologia.
Kontrola wydzielania dokrewnego może być typu:
− nerwowego, związana z regulacją czynności gruczołów dokrewnych przez układ autonomiczny,
− hormonalnego, polegająca na bezpośrednim działaniu pobudzającym hormonów na wydzielanie
gruczołów dokrewnych oraz na ich wpływie troficznym,
− metabolicznego, dotycząca bezpośredniego wpływu substratów lub produktów na wydzielanie do-
krewne.

Część II. Podstawy regulacji metabolicznych
60
7.2. Podział hormonów
Hormony można podzielić w różny sposób – ze względu na rodzaj działania, charakter chemicz-
ny, mechanizm działania, miejsce powstawania, częstotliwość wydzielania oraz zasięg działania.
7.2.1. Podział hormonów ze względu na rodzaj działania
A – Hormony efektorowe – działające bezpośrednio na narządy.
B – Hormony tropowe – regulujące syntezę i wydzielanie innych hormonów.
Hormony tropowe są grupą hormonów wydzielanych przez komórki przedniego płata przysadki
mózgowej, ich zadaniem jest regulacja wydzielania innych hormonów. Jako przykład można wymie-
nić hormon tyreotropowy (TSH), który wpływa na zwiększenie wydzielania hormonów tarczycy –
tyroksyny (T
4
), a także trijodotyroniny (T
3
). Poza tym TSH wpływa na zwiększenie ukrwienia gruczo-
łu tarczowego, a także taką przebudowę strukturalną pęcherzyków tarczycowych, która pozwala spro-
stać wymogom zwiększonej czynności hormonalnej.
Wydzielanie hormonów tropowych jest regulowane przez podwzgórze, które wydziela liberyny,
oraz – zwrotnie – przez hormony syntetyzowane przez gruczoły dokrewne. Działa tutaj zasada ujem-
nego sprzężenia zwrotnego. Sprzężenie zwrotne jest podstawowym mechanizmem kontroli syntezy
i wydzielania hormonów. Wydzielany hormon działa na komórkę docelową, powodując wzrost wy-
dzielania substancji (zwykle innego hormonu). Substancja ta działa zwrotnie, najczęściej hamująco
(ujemne sprzężenie zwrotne) lub pobudzająco (dodatnie sprzężenie zwrotne), na gruczoł, którego wy-
dzielina stymulowała jej sekrecję.
7.2.2. Podział hormonów ze względu na budowę
A – Hormony pochodne aminokwasów. Należą do nich adrenalina, noradrenalina, dopamina, tyrok-
syna, trijodotyronina i melatonina. Aminy katecholowe, rozpuszczalne w wodzie oraz hormony
tarczycy, rozpuszczalne w tłuszczach, krążą w osoczu krwi głównie w formie związanej z globu-
linami.
B – Hormony peptydowe i białkowe. Są to przede wszystkim: insulina, glukagon, hormon wzrostu,
hormon tyreotropowy, hormon adrenokortykotropowy, prolaktyna, oksytocyna, wazopresyna, kal-
cytonina, parahormon czy gastryna. Zazwyczaj są one rozpuszczalne w wodzie i krążą we krwi
w postaci niezwiązanej.
C – Hormony steroidowe. Są to glukokortykoidy, mineralokortykoidy, androgeny, estrogeny i gesta-
geny. Są rozpuszczalne w tłuszczach i krążą w osoczu krwi w postaci związanej z białkami nośni-
kowymi, tzw. globulinami wiążącymi steroidy. Substratem zużywanym do biosyntezy hormonów
steroidowych jest cholesterol. Głównym etapem w tym procesie jest podwójna hydroksylacja cho-
lesterolu z udziałem NADPH oraz tlenu. W ten sposób powstaje 20,22-dihydroksycholesterol,
który w kolejnych etapach przekształca się w pregnenolon, a ten z kolei w progesteron. Tak po-
wstaje pierwszy hormon steroidowy, będący jednocześnie prekursorem wszystkich innych hormo-
nów tej grupy. Hydroksylacja w pozycji C
21
kieruje progesteron na tor przemian, prowadzący do
powstania mineralokortykoidów (aldosteron), natomiast hydroksylacja w pozycji C
17
zmierza do
przemiany progesteronu w glukokortykoidy (kortyzol). Schemat biosyntezy przedstawiono na
rycinie 20.
7.2.3. Podział hormonów ze względu na mechanizm działania
A – Hormony wiążące się z receptorami powierzchni komórkowej (rozpuszczalne w wodzie). Hor-
mony te „komunikują się” ze śródkomórkowymi procesami metabolicznymi za pośrednictwem
cząsteczek określanych jako przekaźniki drugorzędowe (sam hormon jest określany jako prze-
kaźnik pierwszorzędowy). Przekaźniki drugorzędowe powstają w wyniku oddziaływania hormo-
nu z receptorem (cAMP, cGMP, Ca
2+
, metabolity złożonych fosfoinozytydów, kaskady kinazo-
we). Do tej grupy hormonów należy większość hormonów białkowych i peptydowych oraz amino-
kwasowych i neuromodulatorów (z wyjątkiem hormonów tarczycy, T
3
i T
4
).
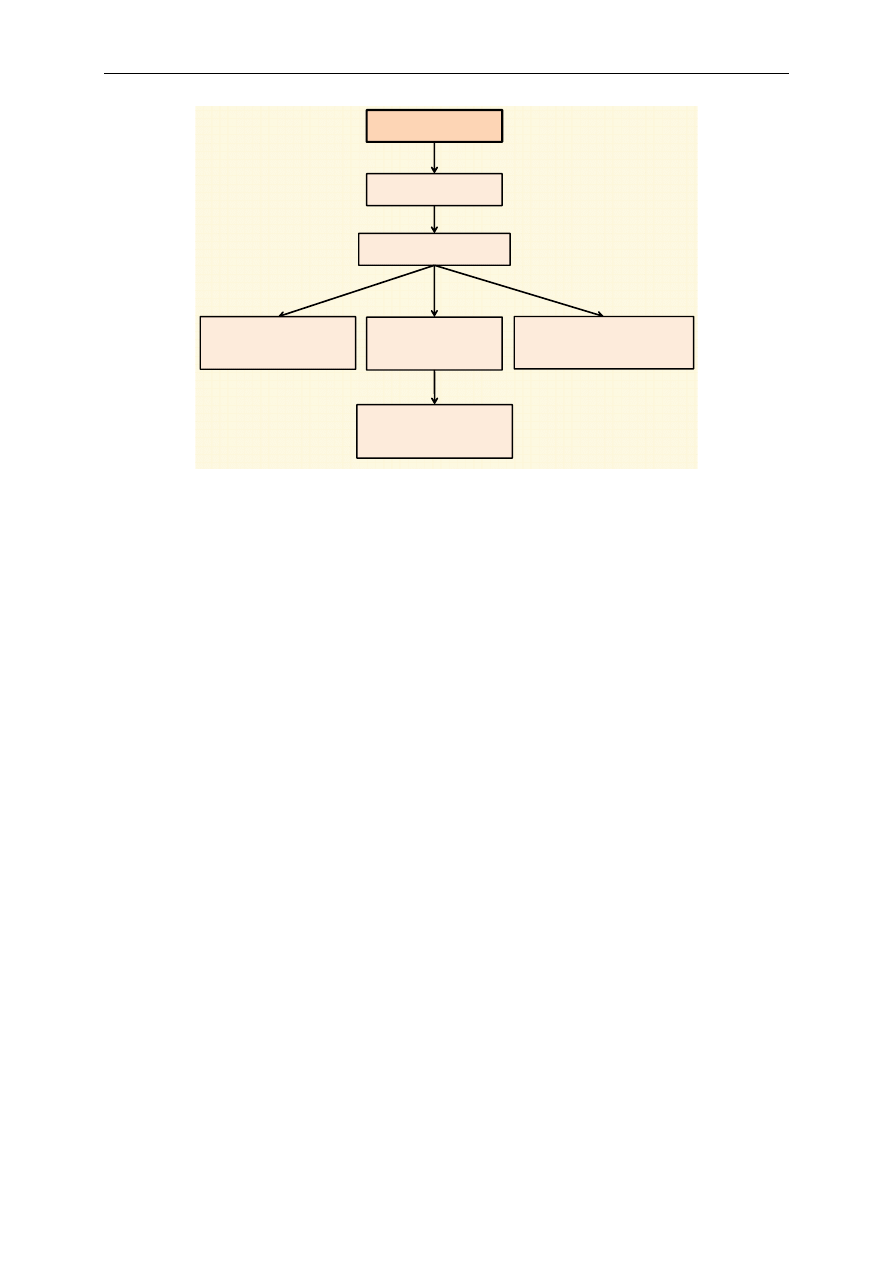
7. Hormony
61
progesteron
pregnenolon
cholesterol
androgeny
(testosteron,
dehydroepiandrosteron)
glukokortykoidy
(hydrokortyzon)
estrogeny
(estradiol, estron, estriol)
mineralokortykoidy
(aldosteron)
Ryc. 20. Schemat steroidogenezy
B – Hormony wiążące się z receptorami śródkomórkowymi. Są to pochodne cholesterolu (glukokor-
tykoidy, mineralokortykoidy, estrogeny, progestyny, androgeny, kalcytriol) oraz hormony tarczy-
cy. Mają właściwości lipofilowe, dzięki czemu przenikają przez lipidową warstwę błony komór-
kowej i uzyskują dostęp do receptora w cytoplazmie lub jądrze komórki docelowej. Nie korzysta-
ją z wtórnych przekaźników. Nie powodują modyfikacji białek enzymatycznych lub przenośni-
ków błonowych, lecz indukują bądź hamują ich biosyntezę.
7.2.4. Podział hormonów ze względu na miejsce powstawania
A – Hormony o działaniu ogólnym. Wydzielane są przez swoiste gruczoły dokrewne i działają na
komórki docelowe wyłącznie za pośrednictwem układu krążenia.
B – Hormony miejscowe. Wytwarzane są przez różne komórki i działają w najbliższym sąsiedztwie
miejsca uwalniania. Zalicza się do nich m.in. acetylocholinę, serotoninę, histaminę i prostaglan-
dyny.
C – Hormony tkankowe. Są to związki chemiczne wytwarzane w komórkach nieskupionych w od-
dzielnych gruczołach wydzielania wewnętrznego, które wpływają na czynność innych narządów
w miejscu swojego uwalniania. Należy do nich duża grupa hormonów przewodu pokarmowego
(gastryna, cholecystokinina, sekretyna), jak również hormony wytwarzane przez nerkę (renina
i erytropoetyna).
7.2.5. Podział hormonów ze względu na częstotliwość wydzielania
A – Hormony wydzielane w sposób ciągły, np. insulina.
B – Hormony wydzielane okresowo, w zależności od potrzeb, np. hormony płciowe.
7.2.6. Podział hormonów ze względu na zasięg działania
A – Hormony o działaniu ogólnoustrojowym, np. hormon wzrostu, tyroksyna.
B – Hormony działające na określony narząd, np. tyreotropina, wazopresyna.

Część II. Podstawy regulacji metabolicznych
62
7.3. Charakterystyka wybranych hormonów
7.3.1. Hormon antydiuretyczny (wazopresyna, ADH)
Jest hormonem podwzgórzowym zaliczanym do polipeptydów. Powoduje zagęszczanie moczu
poprzez resorpcję wody i jonów sodu w kanalikach nerkowych, pobudzając receptory V2. Oddziałuje
również na naczynia krwionośne, powodując ich skurcz dzięki obecnym w ścianie naczyń receptorom
V1. Wydzielanie wazopresyny jest pobudzane przez wzrost ciśnienia osmotycznego osocza krwi i pły-
nu mózgowo-rdzeniowego, hipowolemię lub angiotensynę II. Spadek osmolarności osocza lub hiper-
wolemia hamują jej wydzielanie. Niedobór wazopresyny lub brak jej działania powoduje moczówkę
prostą. Jeśli dotyczy ona zaburzenia wydzielania na poziomie podwzgórza lub przysadki, jest to mo-
czówka prosta ośrodkowa. Jeżeli występuje niewrażliwość cewek nerkowych na działanie hormonu
antydiuretycznego, jest to moczówka prosta nerkowa.
7.3.2. Oksytocyna
Podobnie jak ADH, jest hormonem peptydowym, syntetyzowanym w podwzgórzu i magazyno-
wanym w tylnym płacie przysadki. Powoduje skurcze mięśni macicy, co ma znaczenie podczas akcji
porodowej. Uczestniczy także w akcie płciowym i zapłodnieniu. Uwalniana jest po podrażnieniu me-
chanoreceptorów brodawek sutkowych, np. podczas ssania piersi, co ułatwia wydzielanie mleka, oraz
po podrażnieniu receptorów szyjki macicy i pochwy. Estrogeny wzmagają wydzielanie oksytocyny,
a progesteron je hamuje. Bezpośrednio po porodzie oksytocyna powoduje obkurczanie macicy oraz
położonych w ścianie macicy naczyń krwionośnych, tamując w ten sposób krwawienie po urodzeniu
łożyska.
7.3.3. Hormon wzrostu (GH)
Jest polipeptydowym hormonem produkowanym przez komórki kwasochłonne przedniego płata
przysadki mózgowej. Częściowo działa poprzez stymulację wytwarzania peptydów pośredniczących –
somatomedyn (insulinopodobnych czynników wzrostu) – IGF-1 oraz IGF-2 – w wątrobie, a być może
także w innych tkankach. Głównym działaniem hormonu wzrostu, w którym pośredniczą somatome-
dyny, jest pobudzanie wzrostu będące wynikiem pobudzenia chondrogenezy i osteogenezy w chrząst-
kach wzrostowych kości. Bez udziału somatomedyn GH wpływa na gospodarkę węglowodanową,
powodując pobudzenie glikogenolizy i zwiększone uwalnianie glukozy z wątroby. Działając na tkankę
tłuszczową, zwiększa lipolizę i zmniejsza lipogenezę, prowadząc do zwiększenia stężenia wolnych
kwasów tłuszczowych w osoczu. Nadmierne wydzielanie GH u dzieci prowadzi do wystąpienia gigan-
tyzmu (przerost całego organizmu), zaś u osób dorosłych – do akromegalii (przerost tylko niektórych
części ciała, np. rąk, stóp, żuchwy). Brak lub niedobór wydzielania hormonu wzrostu u dzieci prowa-
dzi do karłowatości przysadkowej.
7.3.4. Prolaktyna (PRL, hormon laktogeniczny)
Jest hormonem peptydowym wytwarzanym przez komórki kwasochłonne przysadki. Pobudza
wzrost piersi podczas ciąży i wywołuje laktację. Działa także na gonady, komórki limfoidalne i wątro-
bę – narządy te mają swoiste receptory. U kobiet karmiących piersią prolaktyna hamuje wydzielanie
hormonu folikulotropowego (FSH) i luteinizującego (LH), blokując owulację i menstruację, szczegól-
nie w pierwszych miesiącach po porodzie. U kobiet podwyższone stężenie prolaktyny w surowicy
objawia się bezpłodnością i brakiem miesiączki. U mężczyzn hiperprolaktynemia powoduje impoten-
cję i obniżenie pociągu płciowego (libido).
7.3.5. Tyroksyna (T
4
) i trijodotyronina (T
3
)
Są hormonami tarczycy syntetyzowanymi przez komórki pęcherzykowe tarczycy. Pobudzają
procesy utleniania w tkankach, pobudzają rozpad tłuszczów do kwasów tłuszczowych i glicerolu,
wzmagają wchłanianie glukozy z przewodu pokarmowego i jej zużycie przez komórki. Zwiększają
także wydzielanie i efekty działania somatotropiny i glukokortykoidów, wpływają na czynność gru-
czołów płciowych. Hormony te są bardzo ważne dla rozwoju fizycznego i psychicznego młodych
organizmów. Niedoczynność tarczycy i wynikający z tego niedobór hormonów tarczycy obniża pod-

7. Hormony
63
stawowy poziom przemiany materii, wywołuje obrzęk śluzowaty i zmniejsza aktywność psychomoto-
ryczną. Nadczynność tarczycy, która występuje najczęściej w chorobie Gravesa-Basedowa, objawia
się wytrzeszczem oczu, nadpobudliwością, zwiększoną męczliwością mięśni i tachyarytmią.
7.3.6. Kalcytonina
Jest hormonem polipeptydowym syntetyzowanym przez komórki C tarczycy, który razem z pa-
rathormonem i kalcytriolem odgrywa istotną rolę w regulacji gospodarki wapniowo-fosforanowej
ustroju. Wzrost stężenia jonów wapnia powoduje zwiększenie wydzielania kalcytoniny, natomiast spa-
dek ich stężenia
ogranicza jej wydzielanie. Kalcytonina obniża stężenie wapnia i fosforanów w oso-
czu. Hamując działanie osteoklastów w kościach oraz zwrotne wchłanianie wapnia i fosforanów przez
komórki cewek nerkowych powoduje zwiększone ich wydalanie. Wydzielanie kalcytoniny jest pobu-
dzane przez glukagon, kilka hormonów przewodu pokarmowego oraz wysokie stężenie jonów wapnia
we krwi.
7.3.7. Parathormon (PTH)
Jest to wytwarzany w przytarczycach hormon polipeptydowy, odpowiadający za regulację hor-
monalną gospodarki wapniowo-fosforanowej organizmu. Uwalnianie PTH uwarunkowane jest stęże-
niem Ca
2+
w surowicy krwi – spadkowi poziomu Ca
2+
towarzyszy zwiększony wyrzut PTH. Czynni-
kiem decydującym o wrażliwości przytarczyc na wahania stężenia wolnego wapnia jest aktywna postać
witaminy D. Narządami docelowymi dla PTH są kości i nerki. W kościach, pod wpływem 1,25-dihy-
droksycholekalcyferolu, PTH zwiększa uwalnianie wapnia, w przypadku niedoboru aktywnej formy
witaminy D występuje oporność kości na jego działanie. W nerkach PTH zwiększa wchłanianie
zwrotne jonów wapnia, hamując zwrotną resorpcję fosforanów, zwiększa też wytwarzanie aktywnej
postaci witaminy D. W wyniku niedoczynności przytarczyc następuje zmniejszona synteza i wydzie-
lanie PTH, co wywołuje hipokalcemię. Mogą się wtedy pojawić objawy tężyczki. Nadczynność przy-
tarczyc skutkuje większym wydzielaniem PTH. Wzrasta stężenie wapnia we krwi na skutek jego re-
sorpcji z kości. Może to wywołać groźne zaburzenia funkcji mózgu i kości.
7.3.8. Insulina
Jest hormonem polipeptydowym, wytwarzanym przez komórki B (β) wysepek trzustkowych
(Langerhansa), regulującym metabolizm energetyczny. Zbudowana jest z dwóch łańcuchów polipep-
tydowych A (21 aminokwasów) i B (30 aminokwasów), połączonych dwoma międzyłańcuchowymi
mostkami disiarczkowymi. Jest syntetyzowana w postaci jednołańcuchowego prekursora, zwanego
preproinsuliną, przekształconego następnie w jednołańcuchową proinsulinę. Ta ostatnia, po wycięciu
łączącego peptydu C, przechodzi w dwułańcuchową insulinę. Insulina jest magazynowana w ziarnisto-
ściach cytosolowych, skąd jest uwalniana w wyniku egzocytozy. Peptyd C i insulina wydzielane są
przez trzustkę w stosunku 1:1. U osób chorych na cukrzycę typu 1, na skutek braku wydzielania endo-
gennej insuliny, nie jest wytwarzany również peptyd C, w związku z czym może on być stosowany
jako marker czynności hormonalnej wysepek trzustkowych. W cukrzycy typu 2 obserwuje się nato-
miast prawidłowe lub podwyższone stężenie peptydu C. Cząsteczka insuliny funkcjonuje około 6 mi-
nut, po czym jest rozkładana przez obecną w wątrobie i nerce insulinazę. Najważniejszym bodźcem do
produkcji insuliny jest poposiłkowe zwiększenie stężenia glukozy we krwi. Dzięki zwiększeniu wy-
twarzania insuliny i jej wpływowi na komórki efektorowe (miocyty, adipocyty, hepatocyty), zwiększa
się transport glukozy do wnętrza komórek, co powoduje obniżenie stężenia glukozy we krwi. Insulina
jest jednym z najsilniejszych hormonów o działaniu anabolicznym na gospodarkę białkową, cukrową
i tłuszczową.
7.3.9. Glukagon
Jest polipeptydowym hormonem wytwarzanym przez komórki A (α) wysp trzustkowych. Hor-
mon ten wykazuje działanie antagonistycznie w stosunku do insuliny. Wzmaga procesy glukoneoge-
nezy i glikogenolizy oraz utleniania kwasów tłuszczowych. Glukagon wydzielony przez wysepki
trzustkowe dostaje się do wątroby przez żyłę wrotną i tam prawie całkowicie jest pochłaniany, do krwi
krążenia ogólnego przedostaje się tylko w niewielkiej ilości. W stanie głodu wydzielanie glukagonu

Część II. Podstawy regulacji metabolicznych
64
wzrasta, co powoduje zachowanie prawidłowego stężenia glukozy we krwi. Jest to niezwykle ważne
dla właściwego funkcjonowania mózgu.
Glukagon i insulina należą do podstawowych regulatorów przemian węglowodanowych w orga-
nizmie, wpływają na aktywny transport przez błonę komórkową oraz biosyntezę białek i tłuszczów
w komórkach.
7.3.10. Adrenalina (epinefryna)
Jest katecholaminą syntetyzowaną w rdzeniu nadnerczy. Jej działanie polega na bezpośrednim
pobudzeniu receptorów α- i β-adrenergicznych, przez co wykazuje działanie sympatykomimetyczne.
Wyraźny wpływ na receptory α widoczny jest wobec naczyń krwionośnych, ponieważ w wyniku ich
skurczu następuje wzrost ciśnienia tętniczego. Adrenalina przyspiesza czynność serca, zwiększając
jednocześnie jego pojemność minutową. Wpływając nieznacznie na rozszerzenie naczyń wieńcowych,
rozszerza źrenice i oskrzela, ułatwiając i przyspieszając oddychanie. Ponadto hamuje perystaltykę
jelit, wydzielanie soków trawiennych i śliny oraz obniża napięcie mięśni gładkich. Działa antagoni-
stycznie w stosunku do insuliny – przyspiesza glikogenolizę, zwiększając stężenie glukozy w krwi.
Wyrzut adrenaliny do krwi jest jednym z mechanizmów uruchamianych przy hipoglikemii. Zwiększa
ciśnienie rozkurczowe w aorcie oraz pobudza przepływ mózgowy i wieńcowy. Poprawia przewodnic-
two i automatykę w układzie bodźcowo-przewodzącym. Zwiększa amplitudę migotania komór, przez
co wspomaga defibrylację i jest stosowana w resuscytacji i reanimacji.
7.3.11. Glukokortykoidy (glukokortykosteroidy)
Są to hormony kory nadnerczy regulujące przemiany białek, węglowodanów i tłuszczów. Zali-
cza się do nich hydrokortyzon (kortyzol), kortykosteron i kortyzon. Nadmierne wydzielanie kortyko-
steroidów powoduje hiperkortyzolemię. Glukokortykoidy zmieniają czynności wielu narządów i wpły-
wają na przebieg reakcji odpornościowych. Zmniejszają zużycie glukozy w tkankach i jednocześnie
nasilają glukoneogenezę, co prowadzi do wzrostu stężenia glukozy we krwi (hiperglikemia) i tym sa-
mym wzmocnienia działania adrenaliny. Mogą też powodować rozpad białek mięśniowych, przyczy-
niając się do spadku siły mięśni. Przebudowują tkankę tłuszczową, powodując charakterystyczne prze-
mieszczenie się depozytów tkanki tłuszczowej (bawoli kark, twarz „księżyc w pełni”, otyłość brzusz-
na, chude kończyny), nazywane otyłością typu Cushinga. Zmniejszają wchłanianie wapnia z jelit,
a nasilają jego wydalanie z moczem, co może powodować zaburzenia w układzie kostnym (osteoporo-
za). W większych stężeniach wywołują działanie mineralokortykosteroidowe, zatrzymując w organiz-
mie sód, co wywołuje obrzęki.
Glukokortykoidy są najsilniejszymi znanymi środkami przeciwzapalnymi. W warunkach fizjo-
logicznych modulują odczyny immunologiczne, zapobiegając nadmiernemu pobudzeniu układu od-
pornościowego i rozwojowi chorób z autoagresji. Hamują zarówno wczesną, jak i późną odpowiedź
immunologiczną. Pobudzają syntezę lipokortyny, która hamuje fosfolipazę A, enzym niezbędny
w procesie syntezy substancji prozapalnych (eikozanoidów) z kwasu arachidonowego. W ten sposób
upośledzają syntezę m.in. leukotrienów odpowiedzialnych za niebezpieczne późne zmiany w astmie
oskrzelowej. Zmniejszają również powstawanie i uwalnianie cytokin i czynników adhezji (przylega-
nia) komórek.
Powodują spadek ruchliwości i aktywności większości komórek biorących udział w reakcjach
odpornościowych: neutrofili, makrofagów, bazofili, limfocytów T i B. Hamują też aktywność fibro-
blastów i wytarzanie kolagenu i glikozoaminoglikanów. Wszystko to prowadzi do łagodzenia obja-
wów zapalenia. Z tego powodu glukokortykoidy stosuje się dla zmniejszenia nadwrażliwości. Przy
długotrwałym podawaniu działania te mogą doprowadzić do zaniku tkanki limfatycznej, osłabienia
działania węzłów chłonnych, zmniejszenia liczby limfocytów i – co za tym idzie – do wyraźnego
spadku odporności organizmu.
7.3.12. Mineralokortykoidy (mineralokortykosteroidy)
Są to steroidowe hormony wytwarzane w organizmie człowieka przez warstwę kłębkowatą kory
nadnerczy. Wpływają na nieorganiczną przemianę materii. Głównym przedstawicielem mineralokor-
tykosteroidów jest aldosteron. Jego najważniejsze działanie to zatrzymywanie jonów sodowych

7. Hormony
65
w ustroju i dokomórkowy napływ jonów potasu oraz wtórne zatrzymanie wody w ustroju. Hormon ten
wchodzi w skład układu hormonalnego renina-angiotensyna-aldosteron (RAA). Wydzielanie aldoste-
ronu pobudzają: wzrost stężenia angiotensyny II i III we krwi, wzrost stężenia jonów K
+
i spadek Na
+
we krwi, spadek objętości krwi krążącej lub płynu zewnątrzkomórkowego, nadmierne wydzielanie
ACTH przez przysadkę. Oprócz aldosteronu do mineralokortykoidów zalicza się: deoksykortykoste-
ron (DOC), 18-hydroksykortykosteron, kortykosteron i kortyzol.
7.3.13. Androgeny
Są to steroidowe hormony płciowe o działaniu maskulinizującym, fizjologicznie występujące
u mężczyzn, a w małych stężeniach również u kobiet. U mężczyzn syntetyzowane są przez znajdujące
się w męskich gonadach, czyli jądrach komórki Leydiga (śródmiąższowe) oraz część siatkowatą kory
nadnerczy, zaś u kobiet wytwarzane są przez jajniki i część siatkowatą kory nadnerczy. Pierwotnym
materiałem do syntezy androgenów jest cholesterol. Synteza androgenów pozostaje pod kontrolą hor-
monu luteinizującego (LH) wytwarzanego przez przedni płat przysadki mózgowej. Do androgenów
wytwarzanych w jądrach należą: testosteron, 5-alfa-dihydrotestosteron (5-α-DHT), androsteron. W jaj-
nikach powstają dihydrotestosteron i androstendion, zaś w korze nadnerczy testosteron i dehydro-
epiandrosteron (DHEA).
Fizjologiczne działanie androgenów to: kształtowanie się męskich narządów płciowych w życiu
płodowym, wykształcanie się wtórnych cech płciowych (budowa ciała, głos, typ owłosienia itp.),
wpływ na spermatogenezę, wpływ anaboliczny (zwiększenie masy mięśniowej itp.). Nadmiar andro-
genów u kobiet powoduje szereg zaburzeń, m.in. wykształcanie się męskiej budowy ciała (maskulini-
zacja), męskiego typu owłosienia (wirylizacja), a także zaburzenia płodności, trądzik, łojotok, łysienie
typu męskiego.
7.3.14. Estrogeny
Są grupą steroidowych hormonów płciowych, do których zalicza się estradiol, estron i estriol.
Nazywa się je hormonami żeńskimi, gdyż najważniejszą rolę odgrywają w organizmie kobiet, są też
jednak niezbędne u mężczyzn, bowiem niedobór estrogenów w jądrach może powodować bezpłod-
ność. Ich synteza zachodzi w jajnikach oraz w niewielkim stopniu w innych tkankach: łożysku, tkance
tłuszczowej, kościach, mózgu i jest regulowana przez hormon folikulotropowy (FH) wydzielany przez
przysadkę mózgową. Po menopauzie czynność wydzielnicza jajników ustaje, co prowadzi do niedobo-
rów estrogenów. U mężczyzn estrogeny są w niewielkich ilościach syntetyzowane przez jądra i korę
nadnerczy.
Estrogeny wpływają na wiele cech i funkcji organizmu, szczególnie kobiecego: kształtowanie
się żeńskich narządów płciowych w czasie rozwoju płodowego i po urodzeniu (I-rzędowe cechy płcio-
we), rozwój II-rzędowych cech płciowych kobiecych, kształtowanie się psychiki i popędu płciowego
(III-rzędowe cechy płciowe).
Niedobór estrogenów jest powszechny u kobiet po menopauzie, ponieważ w tym okresie jajniki
przestają je syntetyzować. Niedobory występują też u młodych kobiet i są przyczyną licznych chorób
metabolicznych: zaburzenia miesiączkowania, niepłodność, zanik (lub ograniczone występowanie) II-
-rzędowych cech płciowych, męska sylwetka, hirsutyzm, obniżenie barwy głosu, zanik III-rzędowych
cech płciowych, osteoporoza.
Nadmiar estrogenów występuje w schorzeniach związanych z ich nadmierną syntezą (np. nowo-
twory jajników) oraz podczas przyjmowania zbyt dużych dawek leków zawierających te hormony.
Skutkiem nadmiaru estrogenów są: zaburzenia miesiączkowania, zwiększone prawdopodobieństwo
wystąpienia zakrzepów i zatorów, nadmierny przerost błony śluzowej macicy, obrzęki, nadmierny za-
stój wody i jonów Na
+
, przyrost masy ciała, powiększenie piersi, zaburzenia funkcji wątroby, kamica
dróg żółciowych, żółtaczka, napady migreny, nudności, wymioty, złe samopoczucie.
7.3.15. Progesteron (luteina)
Jest to steroidowy żeński hormon płciowy wytwarzany przez ciałko żółte i łożysko (w czasie
ciąży), najważniejszy hormon wydzielany przez gonady (jajniki i jądra). Wydzielanie progesteronu
wzrasta po owulacji, co przygotowuje błonę śluzową macicy na przyjęcie zapłodnionego jaja, hamuje

Część II. Podstawy regulacji metabolicznych
66
skurcze macicy, wstrzymuje dojrzewanie pęcherzyków Graafa. Hormon ten umożliwia implantację
zapłodnionego jaja w błonie śluzowej macicy i utrzymanie ciąży. Jeśli do ciąży nie dojdzie, wydziela-
nie progesteronu zmniejsza się i dochodzi do menstruacji. W przeciwnym wypadku progesteron za-
czyna być wytwarzany także przez łożysko i do piątego miesiąca ciąży jego synteza jest na tyle duża,
że ciałko żółte nie jest niezbędne do dalszego utrzymania ciąży. Progesteron działa synergistycznie
z estrogenami na gruczoł sutkowy, pobudzając wzrost pęcherzyków gruczołowych i nabłonka prze-
wodów oraz uczestnicząc w ekspresji receptorów niezbędnych do laktacji.
Progesteron jest niezbędny do utrzymania ciąży przez cały okres jej trwania: hamuje odpowiedź
immunologiczną matki na antygeny płodu, jest substratem do syntezy gluko- i mineralokortykoidów
płodu, hamuje poród, znosi samoistną czynność skurczową ciężarnej macicy. Zmniejsza kurczliwość
mięśniówki macicy, pobudza błonę śluzową jajowodów i macicy do wydzielania substancji odżyw-
czych, przygotowuje gruczoł sutkowy do laktacji, zmniejsza wrażliwość macicy na oksytocynę i syn-
tezę receptorów. Ponadto hamuje powstawanie prostaglandyn, zatrzymuje wodę powodując obrzęki.
Inne metaboliczne efekty oddziaływania progesteronu to: podwyższanie temperatury ciała, stymulacja
oddychania, obniżanie stężenia aminokwasów w surowicy, normalizacja stężenia glukozy w surowicy.
P i ś m i e n n i c t w o
1. Bańkowski E. Biochemia. Podręcznik dla studentów uczelni medycznych. Wydawnictwo Medyczne
Urban & Partner, Wrocław 2004, s. 549–586.
2. Biochemia Harpera ilustrowana. Red. R.K. Murray, D.K. Granner, V.W. Rodwell. Wydawnictwo
Lekarskie PZWL, Warszawa 2008, s. 531–556.
3. Choroby wewnętrzne. Red. A. Szczeklik, T. I, Medycyna Praktyczna, Kraków 2005.
4. Zaburzenia hormonalne. Red. M.Pawlikowski. Wydawnictwo Lekarskie PZWL, Warszawa 2003.
5. Zarys endokrynologii klinicznej. Red. M. Pawlikowski. Wydawnictwo Lekarskie PZWL, Warszawa
1992.

8. WITAMINY
Bronisława Skrzep-Poloczek, Ewa Romuk
Witaminy to drobnocząsteczkowe substancje niezbędne w niewielkich ilościach do prawidło-
wego funkcjonowania organizmu. Nie mają wartości energetycznej, ale pełnią najczęściej rolę koenzy-
mów w przemianach metabolicznych. Nazwa „witaminy” została nadana tej grupie niskocząsteczko-
wych substancji przez polskiego biochemika, Kazimierza Funka.
Budowa biochemiczna poszczególnych witamin decyduje o ich działaniu. Dzielimy je na rozpu-
szczalne w tłuszczach (ADEK) i rozpuszczalne w wodzie (grupy B i witamina C). Zapotrzebowanie na
witaminy zależy od warunków klimatycznych oraz osobniczo od płci, wieku, masy ciała i stanu fizjo-
logicznego.
Brak odpowiedniej ilości witamin doprowadza do stanu patologicznego, zwanego hipowitami-
nozą, nadmierna podaż witamin rozpuszczalnych w tłuszczach jest przyczyną hiperwitaminozy. W przy-
padku witamin rozpuszczalnych w wodzie nadwyżka jest wydalana przez nerki. Jedynie przy prze-
dawkowaniu witamin z grupy B opisywane są zaburzenia neurologiczne, a powstające z kwasu askor-
binowego szczawiany mogą tworzyć złogi w nerkach.
8.1. Witaminy rozpuszczalne w wodzie
8.1.1. Witamina B
1
(tiamina)
W niewielkich ilościach syntetyzowana jest przez florę bakteryjną przewodu pokarmowego. Ła-
two wchłania się w przewodzie pokarmowym. Składa się z części pirymidynowej i tiazolowej. Po-
przez fosforylację przechodzi w postać aktywną – pirofosforan tiaminy, w postaci którego organizm
magazynuje około 80% witaminy B
1
. Pirofosforan tiaminy jest koenzymem, którego rola polega na
wiązaniu α-ketokwasów w procesie oksydacyjnej dekarboksylacji i przenoszeniu aldehydów.
Ciężki niedobór witaminy B
1
prowadzi do rozwoju choroby beri-beri, objawiającej się zanikami
mięśniowymi i obniżeniem siły skurczu mięśnia sercowego. Brak witaminy B
1
skutkuje zaburzeniem
procesu dekarboksylacji kwasu pirogronowego. Wysokie stężenie kwasu pirogronowego i mlekowego
we krwi jest szkodliwe, zwłaszcza dla układu nerwowego, prowadząc do zaniku otoczki mielinowej
nerwów, zmian w przewodzie pokarmowym i układzie sercowo-naczyniowym oraz upośledzenia wy-
dzielania soku żołądkowego, co powoduje zaburzenia w trawieniu i przyswajaniu składników pokar-
mowych.
8.1.2. Witamina B
2
(ryboflawina)
Ryboflawina jest wchłaniana w górnym odcinku jelita cienkiego i stamtąd transportowana do
tkanek, gdzie stanowi substrat do biosyntezy mononukleotydu flawinowego (FMN) lub dinukleotydu
flawinoadeninowego (FAD), które są grupami prostetycznymi flawoprotein, pełniących funkcje enzy-
mów oksydoredukcyjnych.
Ryboflawina wpływa na prawidłowe funkcjonowanie układu nerwowego oraz systemu odpor-
nościowego. Jej niedobór wywołuje: tzw. zajady w kącikach ust, łojotok skóry, zapalenie języka, pie-
czenie pod powiekami oczu, łzawienie, światłowstręt, zapalenie tęczówki oka. Niedobory witaminy B
2
zwykle towarzyszą niedoborom innych witamin. Występują przede wszystkim u alkoholików oraz

Część II. Podstawy regulacji metabolicznych
68
w stanach ujemnego bilansu azotowego, ponieważ witamina B
2
nie jest przez organizm magazynowa-
na, lecz wydalana z moczem.
8.1.3. Witamina B
3
(niacyna, kwas nikotynowy, witamina PP)
Niacyna to kwas nikotynowy lub jego amid. Może powstawać w organizmie człowieka w szla-
ku przemian tryptofanu, ale jest to proces mało wydajny, a sam tryptofan jest aminokwasem egzogen-
nym.
Amid kwasu niacynamidowego stanowi element strukturalny NAD
+
i NADP
+
. NAD
+
jest koen-
zymem dehydrogenaz, a jego postać zredukowana, NADH, powstaje w czasie katabolizmu cukrów,
tłuszczów oraz białek i dostarcza organizmowi energii w postaci ATP (fosforyzacja oksydacyjna).
NADP
+
jest koenzymem reduktaz, a jego postać zredukowana, NADPH,
bierze udział w licznych bio-
syntezach, w których często wymagany jest udział ATP.
Kwas nikotynowy stosuje się w leczeniu hiperlipidemii, gdyż w wysokich dawkach zmniejsza
uwalnianie kwasów tłuszczowych z tkanki tłuszczowej i hamuje wytwarzanie VLDL w wątrobie. Nie-
dobór zarówno niacyny, jak i tryptofanu jest przyczyną pelagry – zespołu chorobowego charakteryzu-
jącego się osłabieniem, brakiem apetytu, zaburzeniami perystaltyki jelit (biegunki), zmianami skór-
nymi i zapaleniem jamy ustnej oraz zaburzeniami psychicznymi.
8.1.4. Witamina B
5
(kwas pantotenowy)
Składa się z β-alaniny oraz fosfopantotenianu. Fosfopantotenian jest substratem do syntezy
koenzymu A i fosfopanteteiny biorących udział w wielu procesach metabolicznych. Koenzym A
uczestniczy w oksydacyjnej dekarboksylacji α-ketokwasów, β-oksydacji kwasów tłuszczowych, bio-
syntezie cholesterolu i innych steroidów oraz tworzeniu estrów i amidów kwasowych. Fosfopantete-
ina, będąca składnikiem białka przenoszącego acyl, bierze udział w syntezie kwasów tłuszczowych.
Głównym połączeniem CoA jest acetylo~CoA – najważniejszy łącznik wszystkich przemian w orga-
nizmie. Powstaje prawie w 100% w wyniku katabolizmu tłuszczów (β-oksydacja), w około 70%
w wyniku katabolizmu cukrów (glikoliza) oraz w 50% w wyniku rozpadu białek (aminokwasy keto-
genne).
Niedobór kwasu pantotenowego z powodu powszechności występowania stwierdza się nie-
zmiernie rzadko. Jedyny opisany przypadek to objaw palących stóp u jeńców wojennych. U chorych
stwierdza się zmniejszoną aktywność procesów acetylacji. Może to prowadzić do uszkodzeń kory nad-
nerczy oraz do zaburzeń układu mięśniowego i nerwowego.
8.1.5. Witamina B
6
Witamina B
6
obejmuje trzy podobne do siebie pochodne pirydyny: pirydoksynę, pirydoksal i pi-
rydoksaminę. Koenzymem jest fosforan pirydoksalu – najbardziej wszechstronny jako jedyny uczest-
niczący we wszystkich klasach enzymów z wyjątkiem hydrolaz, które nie posiadają koenzymów. Bie-
rze udział w biosyntezie hemu (koenzym syntazy delta-aminolewulinianowej), w utrzymaniu stałego
stężenia glukozy we krwi (koenzym fosforylazy glikogenowej). Wiatamina B
6
jest konieczna do syn-
tezy hormonów: serotoniny i adrenaliny, mających wpływ na prawidłowe funkcjonowanie układu ner-
wowego (koenzym dekarboksylaz hydroksylowych pochodnych tryptofanu i tyrozyny).
Fosforan pirydoksalu bierze udział w przemianach białek, węglowodanów i tłuszczów, ale
szczególnie związany jest z przemianami aminokwasów, uczestnicząc we wszystkich ich reakcjach
(koenzym dekarboksylaz, transaminaz oraz niektórych deaminaz).
Niedobory witaminy B
6
występują rzadko i charakteryzują się przede wszystkim objawami neu-
rologicznymi oraz skórnymi.
8.1.6. Witamina B
12
(kobalamina)
Ma bardzo złożoną budowę – charakteryzuje się pierścieniem porfirynowym z dużą ilością róż-
nych podstawników. Zapotrzebowanie na kobalaminę jest pokrywane wyłącznie przez produkty spo-
żywcze pochodzenia zwierzęcego. Prawidłowa absorpcja B
12
z przewodu pokarmowego zależy od
tzw. czynnika Castla, wydzielanego przez komórki okładzinowe żołądka. Wraz z kwasem foliowym

8. Witaminy
69
bierze udział w syntezie kwasu deoksyrybonukleinowego – DNA, aminokwasów i białek szpiku. Od-
grywa ważną rolę w przemianach węglowodanów i tłuszczów oraz w procesie transmetylacji (przeno-
szenia) i syntezie grup metylowych (-CH
3
). Jest niezbędna do prawidłowej czynności układu nerwo-
wego i przewodu pokarmowego.
Niedobór wywołuje zahamowanie dojrzewania i rozmnażania się komórek, zwłaszcza krwinek
czerwonych, co prowadzi do niedokrwistości złośliwej (megaloblastycznej), zaniku błony przewodu
pokarmowego (bezkwaśności) oraz zmian zwyrodnieniowych rdzenia kręgowego i nerwów obwodo-
wych.
8.1.7. Kwas foliowy (folacyna, foliany)
Nazwa ta obejmuje kwas foliowy oraz grupę związków o bardzo złożonej budowie, wywodzą-
cych się z kwasu foliowego. Związki te różnią się ilością reszt kwasu glutaminowego. Aktywną posta-
cią tej witaminy jest tetrahydrofolian – koenzym w reakcjach przenoszenia rodników jednowęglowych
(np. -CHO, -CH
3
, -CH
2
OH), odgrywających ważną rolę w syntezie zasad purynowych i pirymidyno-
wych oraz w przemianie niektórych aminokwasów.
Kwas foliowy jest biokatalizatorem w procesach hydroksylacji enzymatycznej (przyłączenia
grupy OH) egzogennego aminokwasu – fenyloalaniny. W wyniku tego powstaje tyrozyna potrzebna
do syntezy hormonów: adrenaliny, noradrenaliny, tyroksyny, oraz melanin – barwników skóry i wło-
sów. Kwas foliowy bierze również udział w przemianie fosfolipidów. Jego niedobór lub brak hamuje
prawidłowe procesy wzrostu i rozmnażania komórek. Ujawnia się to przede wszystkim na poziomie
syntezy kwasów nukleinowych układu krwiotwórczego (niedokrwistością megaloblastyczną).
Niedobory kwasu foliowego obserwuje się u kobiet w ciąży, osób w wieku podeszłym, u nad-
używających alkoholu, stosujących leki przeciwepileptyczne, leki zmniejszające kwasowość żołądka,
środki antykoncepcyjne oraz w niektórych nowotworach.
8.1.8. Witamina H (biotyna)
Jest to połączenie mocznika z pierścieniem tiofanu i kwasu walerianowego. Wchodzi w skład
enzymów katalizujących reakcje karboksylacji, dzięki czemu uczestniczy w syntezie kwasów nukle-
inowych, nukleotydów purynowych oraz w metabolizmie białek i węglowodanów.
Niedobór witaminy H zmniejsza syntezę kwasów tłuszczowych oraz białek ustrojowych, obja-
wiając się zmianami skórnymi (łojotok, łupież, zanik brodawek języka, łuszczenie skóry), znużeniem,
bólami mięśniowymi, brakiem łaknienia, depresją, niedokrwistością oraz zwiększonym stężeniem
cholesterolu we krwi.
8.1.9. Witamina C (kwas askorbinowy)
Jest pochodną węglowodanów. Ma wielorakie działanie. Uczestniczy w reakcjach oksydore-
dukcyjnych (jest donatorem wodoru w procesach enzymatycznej hydroksylacji – uwodorowania, jest
więc silnym czynnikiem redukującym). Odgrywa ważną rolę w przemianie aminokwasów, syntezie
hormonów steroidowych, barwników skóry (melanin), amin katecholowych. Jest niezbędna w wytwa-
rzaniu kolagenu – podstawowej substancji tkanki łącznej, substancji macierzystych chrząstek, kości,
zębiny oraz substancji uszczelniającej śródbłonek naczyń włosowatych. Zwiększa odporność organi-
zmu. Ułatwia przyswajanie żelaza w przewodzie pokarmowym przez jego redukcję z Fe
3+
na Fe
2+
.
Zaliczana jest do witamin antyoksydacyjnych, tzn. chroni organizm przed szkodliwym działaniem
wolnych rodników, nadtlenków lipidowych i innych substancji toksycznych. Korzystnie wpływa na
metabolizm lipidów. Odgrywa ważną rolę w profilaktyce choroby niedokrwiennej serca i chorób no-
wotworowych.
Niedobór witaminy C objawia się szybkim męczeniem się, brakiem łaknienia, bólami stawowo-
-mięśniowymi, zaczerwienieniem i krwawieniem dziąseł. Jej brak jest przyczyną szkorbutu charakte-
ryzującego się krwawieniem i zmianami zapalno-martwiczymi dziąseł oraz wypadaniem zębów. Awi-
taminoza prowadzi do niedokrwistości i osłabienia odporności organizmu. Objawy niedoboru wystę-
pują najczęściej w okresie zimowym i zimowo-wiosennym.

Część II. Podstawy regulacji metabolicznych
70
8.2. Witaminy rozpuszczalne w tłuszczach
8.2.1. Witamina A (retinol, retinal i kwas retinowy)
Aktywnymi formami witaminy A są retinoidy: retinol, retinal i kwas retinowy. Prekursorami ro-
ślinnymi witaminy A są związki zwane karotenami. Transport retinolu z wątroby do tkanek pozawą-
trobowych odbywa się przy współudziale białka wiążącego retinol: RBP (retinol binding protein).
Retinal i kwas retinowy są najbardziej aktywnymi postaciami witaminy A.
Retinal bierze udział w mechanizmie procesu widzenia. Tworzy on grupę prostetyczną białek
komórek siatkówki – rodopsyny. Składa się z opsyny (białko) i 11-cis-retinalu. Światło powoduje
przekształcenie, tzw. fotoizomeryzację 11-cis-retinalu do trans-retinalu, co prowadzi do zmian kon-
formacyjnych w rodopsynie zmieniających potencjał błonowy komórek siatkówki. Dalej powstający
w ten sposób sygnał elektryczny jest przesyłany przez nerw wzrokowy do mózgu. Zarówno retinoidy,
jak i karoteny wykazują właściwości antyoksydacyjne. Uczestniczą w likwidacji reaktywnych form
tlenu.
Niedobór retinalu powoduje zaburzenie widzenia polegające na upośledzeniu widzenia o zmro-
ku. Niedobór kwasu retinowego wpływa też na procesy regeneracji tkanki nabłonkowej skóry.
8.2.2. Witamina D (ergokalcyferol, cholekalcyferol)
Znane są dwie postacie witaminy D – ergokalcyferol (witamina D
2
) syntetyzowany przez rośli-
ny oraz cholekacyferol (D
3
) pochodzenia zwierzęcego. Cholekalcyferol jest zaliczany do witamin,
które z natury są egzogenne. Jednak witamina D powstaje również w skórze człowieka pod wpływem
promieni słonecznych promieniowania UVB o długości fali 290–320 nm. U ludności żyjącej w na-
szym obszarze geograficznym synteza skórna jest efektywna (zapewniająca minimum 400 j.m./d) od
marca do października. Witamina D jest syntetyzowana z 7-dehydrocholesterolu, obecnego w małych
ilościach we wszystkich tkankach. Steroid ten jest drogą fotochemiczną przekształcany w cholekalcy-
ferol, zwany witaminą D
3
. Powstały w skórze cholekalcyferol jest transportowany do krwi, gdzie two-
rzy kompleks ze swoistym białkiem osoczowym. Umożliwia to transport międzynarządowy witaminy
D
3
. W wątrobie i w nerkach cholekalcyferol jest dwukrotnie hydroksylowany: w pozycji C
1
i C
25
, two-
rząc dihydroksycholekalcyferol, czyli kalcytriol.
Kalcytriol jest fizjologicznie aktywną postacią witaminy D. Ma cechy hormonu. Receptory wi-
taminy D znajdują się w jelicie cienkim, okrężnicy osteoblastach, aktywowanych limfocytach T i B
oraz w narządach, takich jak: mózg, serce, skóra, jądra, jajniki, gruczoł sterczowy i gruczoły piersiowe.
Po związaniu kalcytriol pełni funkcję czynnika transkrypcyjnego. Współdziała z parathormonem. Pod-
wyższa stężenie jonów Ca
2+
w osoczu.
Niedobór witaminy D u dzieci wywołuje krzywicę, a u dorosłych osteomalację lub osteoporozę.
Aby sprawdzić prawidłowy stan gospodarki wapniowo-fosforanowej, należy oznaczyć stężenie
25(OH)D, wapnia, parathormonu, fosforanów i aktywność fosfatazy alkalicznej w surowicy krwi.
8.2.3. Witamina E (tokoferole i tokotrienole)
Witamina ta obejmuje kilka pokrewnych związków, wśród których największą aktywność bio-
logiczną wykazuje
α-tokoferol. Główna rola biologiczna witaminy E polega na zdolności przeprowa-
dzania reakcji antyoksydacyjnych. Inaktywuje reaktywne formy tlenu w błonach biologicznych,
w komórkach tłuszczowych i lipoproteinach. Produktami spożywczymi szczególnie bogatymi w wi-
taminę E są przede wszystkim oleje roślinne, nasiona roślin oleistych i kiełki pszenicy. Wchłonięta do
krwi jest wiązana i transportowana przez lipoproteiny osoczowe. Akumuluje się przede wszystkim
w strukturach bogatych w tłuszcze, głównie w tkance tłuszczowej.
U człowieka objawy niedoboru witaminy E są niezwykle rzadkie (u wcześniaków zdarza się ła-
godna postać niedokrwistości hemolitycznej).
8.2.4. Witamina K (filochinon)
Witamina K
1
to związek dwupierścieniowy (pierścień aromatyczny i pierścień chinonowy
z podstawnikami, w tym z podstawnikiem poliizoprenoidowym), uczestniczący w procesie krzepnię-

8. Witaminy
71
cia krwi oraz w enzymatycznej karboksylacji reszt glutaminianu w trakcie posttranslacyjnej modyfika-
cji protrombiny i innych osoczowych czynników krzepnięcia (II, VII, IX, X). Jest również niezbędna
do syntezy i prawidłowego utrzymywania stężenia białek wiążących wapń w nerkach, łożysku i płu-
cach. Występuje w produktach spożywczych pochodzenia roślinnego, głównie w warzywach, oraz jest
syntetyzowana przez saprofityczną florę jelita cienkiego.
Objawy niedoboru witaminy K pod postacią osoczowych skaz krwotocznych ujawniają się
wcześnie, ze względu na niewielkie możliwości jej magazynowania. Objawowa hipowitaminoza wy-
stępuje głównie u noworodków, przede wszystkim u wcześniaków, dlatego w tej grupie wiekowej
witaminę tę stosuje się profilaktycznie.
P i ś m i e n n i c t w o
1. Bańkowski E. Biochemia. Podręcznik dla studentów uczelni medycznych. Urban & Partner, Wro-
cław 2004, s. 513–540.
2. Biochemia Harpera ilustrowana. Red. R.K. Murray, D.K. Granner, V.W. Rodwell. Wydawnictwo
Lekarskie PZWL, Warszawa 2008, s. 588–608.
3. Standardy medyczne (pediatria) 2009, T. 6. Chemik w panteonie medycyny. Z historii badań nad
witaminą C. Grzegorz Grynkiewicz, s. 183–188.
4. Standardy medyczne (pediatria) 2009, T. 6. Polskie zalecenia dotycząc profilaktyki niedoborów
witaminy D rok 2009, s. 876–879.

9. PODSTAWOWE REGULACJE METABOLIZMU
Ewa Birkner
9.1. Metabolizm
Metabolizm można zdefiniować jako sumę wszystkich reakcji enzymatycznych zachodzących
w komórce, mających na celu wymianę materii i energii między komórką a otaczającym ją środowi-
skiem. Związki występujące w organizmach są przekształcone w reakcjach enzymatycznych tworzą-
cych tzw. drogi lub szlaki metaboliczne. Można je podzielić na dwa rodzaje: kataboliczne i anaboliczne.
Katabolizm określa procesy, w wyniku których związki wielkocząsteczkowe (cukry, tłuszcze
i białka), dostarczane wraz z pożywieniem lub pochodzące z materiałów zapasowych, są przekształca-
ne głównie w reakcjach hydrolizy i utleniania w związki drobnocząsteczkowe. Do procesów katabo-
licznych zaliczamy:
− proteolizę, uwalniającą aminokwasy z białek,
− hydrolizę kwasów nukleinowych z deaminacją i utlenianiem zasad purynowych i pirymidynowych,
− lipolizę powodującą rozkład acyloglicerolu do glicerolu i kwasów tłuszczowych,
− glikogenolizę polegającą na rozpadzie glikogenu do glukozo-1-fosforanu,
− oksydację kwasów tłuszczowych, powodującą ich rozpad na fragmenty dwuwęglowe acetylo~CoA,
− dekarboksylację pirogronianu, prowadzącą do rozpadu glukozy poprzez pirogronian do acety-
lo~CoA,
− cykl kwasów trikarboksylowych (cykl Krebsa), w którym zachodzi ostateczne utlenienie dwuwę-
glowych grup acetylowych do ditlenku węgla (CO
2
) i wody (H
2
O).
Katabolizm obejmuje 3 etapy degradacji:
− rozkład związków złożonych na prostsze, np. cukry, tłuszcze, białka są rozkładane na monocukry,
glicerol i kwasy tłuszczowe oraz aminokwasy; na tym etapie energia uwalniana jest w bardzo nie-
wielkiej ilości lub wcale,
− dalsza degradacja do związków, które mogą być utleniane do CO
2
i H
2
O; na tym etapie część uwal-
nianej energii jest magazynowana w postaci ATP,
− końcowe szlaki metaboliczne, w których zachodzi całkowite utlenienie do CO
2
i H
2
O, obejmujące
cykl Krebsa, łańcuch oddechowy i fosforyzację oksydacyjną; uwalniana podczas reakcji energia jest
magazynowana w postaci ATP.
Katabolizm jest procesem, w którym wiele substratów przekształca się w nieliczne produkty
końcowe, jak mocznik, CO
2
i H
2
O. Grupy aminowe lub amoniak (NH
3
) pochodzące z deaminacji ami-
nokwasów, puryn, pirymidyn lub hydrolizy amidów kwasowych przekształcają się w wątrobie
w mocznik. Glukoza, kwasy tłuszczowe, etanol, glicerol, ciała ketonowe i niektóre aminokwasy roz-
padają się do acetylo~CoA i – w ostateczności – do CO
2
i H
2
O.
Procesy anaboliczne prowadzą do syntezy związków wielkocząsteczkowych: kwasów nukle-
inowych, cukrów (glukoneogeneza, glikogenogeneza), tłuszczów (lipogeneza) i białek przy udziale
NADPH i wymagają często reduktaz oraz dostarczenia energii w postaci ATP. W procesach biosynte-
zy substratami są proste związki, jak:
− CO
2
i NH
3
,
− aktywne fragmenty jednowęglowe biorące udział w biosyntezie puryn i pirymidyn,

9. Podstawowe regulacje metabolizmu
73
− karbamoliofosforan budujący pirymidyny i mocznik,
− pirogronian, z którego powstaje glukoza, a z niej polisacharydy, jak glikogen i glikozoaminoglikany,
− acetyloCoA przekształcający się w kwasy tłuszczowe, a dalej w fosfolipidy i sfingolipidy,
− aminokwasy budujące białka.
Anabolizm jest procesem, w którym te same proste prekursory tworzą związki złożone, np. ace-
tylo~CoA bierze udział zarówno w biosyntezie kwasów tłuszczowych i cholesterolu, a więc wszyst-
kich steroidów, ciał ketonowych, jak i w procesie acetylacji aminokwasów budujących glikozoamino-
glikany.
Ogniwem łączącym katabolizm z anabolizmem są wspólne metabolity:
− acetylo~CoA – produkt rozpadu kwasów tłuszczowych, pirogronianu, ciał ketonowych, niektórych
aminokwasów, staje się substratem w biosyntezie innych kwasów tłuszczowych, cholesterolu, stero-
idów lub acetyloaminoheksoz tworzących glikozoaminoglikany,
− pirogronian – produkt rozpadu glukozy lub niektórych aminokwasów (alaniny, glicyny, seryny,
treoniny, cysteiny, tryptofanu), jest jednocześnie substratem w procesach anabolicznych, takich jak
glukoneogeneza, biosynteza szczawiooctanu lub alaniny,
− ATP – powstający w procesach katabolicznych w wyniku fosforylacji substratowej lub oksydacyj-
nej, jest dawcą energii dla procesów anabolicznych zużywających ATP,
− NADPH – powstający w procesach katabolicznych, jak szlak pentozofosforanowy lub rozkład jabł-
czanu przez enzym jabłczanowy, jest dawcą wodoru w takich reakcjach anabolicznych, jak biosyn-
teza kwasów tłuszczowych, cholesterolu i w następstwie hormonów steroidowych, kwasów żółcio-
wych oraz redukcji tioredoksyny i tetrahydrobiopteryny.
Równowaga między tymi procesami warunkuje prawidłowy wzrost, rozwój i prawidłowe funk-
cjonowanie komórki.
9.2. Regulacje metaboliczne
Drogi kataboliczne są katalizowane przez inne enzymy i przebiegają z reguły za pośrednictwem
innych metabolitów niż drogi anaboliczne. Przykładem nieidentyczności tych dróg mogą być prze-
miany aminokwasów. Aminokwasy aromatyczne są degradowane z wytworzeniem acetylo~CoA i fu-
maranu, natomiast prekursorem tych aminokwasów jest fosfoenlopirogronian (u bakterii). Seryna jest
katabolizowana do pirogronianu, a jej synteza zachodzi przy udziale 3-fosfoglicerynianu jako źródła
szkieletu węglowego.
W czasie lipolizy uwalniany jest glicerol, natomiast synteza lipidów wymaga udziału glicerolo-
-3-fosforanu. Produktem degradacji kwasów tłuszczowych jest acetylo~CoA, natomiast prekursorem
w ich biosyntezie jest malonylo-CoA. Ponadto kolejne etapy biosyntezy i degradacji kwasów tłusz-
czowych znacznie się różnią. Są katalizowane przez inne enzymy, zlokalizowane w różnych przedzia-
łach komórkowych. Podobnie synteza i degradacja glikogenu przebiegają różnie.
Istnienie w komórkach różnych dróg dla procesów degradacji i biosyntezy jest możliwe dzięki
nieodwracalności początkowych i końcowych reakcji szlaków katabolicznych i anabolicznych. Enzy-
my katalizujące te nieodwracalne etapy są nazywane enzymami regulatorowymi. Ogniwem łączą-
cym katabolizm i anabolizm jest cykl Krebsa, którego metabolity są produktami dróg katabolicznych
i mogą być wykorzystywane jako prekursory dróg anabolicznych. Ponadto cykl ten może funkcjono-
wać jako droga kataboliczna umożliwiająca całkowite spalanie reszty acylowej związanej z CoA, po-
wstającej w wyniku katabolizmu białek, cukrów lub tłuszczów z wytworzeniem CO
2
i H
2
O.
9.3. Regulacja metabolizmu poprzez enzymy
Ze względu na istnienie w komórkach wielu rozgałęziających się i przeciwstawnych dróg meta-
bolicznych, zachodzące w nich procesy muszą być precyzyjnie regulowane. Ponieważ w zasadzie
wszystkie reakcje w komórkach są katalizowane przez enzymy, najpowszechniejszym mechanizmem
decydującym o szybkości procesów metabolicznych jest regulacja zawartości i aktywności enzy-
mów. Ilość enzymu można wyrazić jako ilość białka, a jej miarą jest aktywność enzymu.
Regulacje metaboliczne organizmu przebiegają kilkoma drogami: allosterycznie, kowalencyj-
nie, poprzez aktywację proteolityczną, zawartość, aktywność i ilość enzymów w komórce oraz hor-
monalnie.

Część II. Podstawy regulacji metabolicznych
74
9.3.1. Regulacja allosteryczna
Enzymami allosterycznymi nazywamy enzymy, które oprócz centrum katalitycznego mają cen-
tra efektorowe, z którymi wiążą się swoiste efektory. Powoduje to zmiany konformacyjne enzymu –
efekt allosteryczny – zwiększając aktywność enzymu (efektory dodatnie) lub ją hamując (efektory
ujemne).
Enzymy allosteryczne charakteryzuje inny przebieg krzywej kinetyki wiązania substratu, który
w obecności inhibitora allosterycznego przybiera postać sigmoidalną. Najlepiej poznanym enzymem
allosterycznym jest karbamoilotransferaza asparaginianowa, która katalizuje pierwszą reakcje w bio-
syntezie pirymidyn i jest allosterycznie hamowana przez trifosforan cytydyny (CTP). Enzym zawiera
kilka podjednostek katalitycznych i regulatorowych, każda podjednostka katalityczna zawiera cztery
miejsca wiązania substratu (asparaginian), natomiast regulatorowa co najmniej dwa miejsca wiązania
efektora (CTP). CTP hamuje aktywność enzymu przez zmniejszenie powinowactwa obydwu substra-
tów, a więc karbamoilofosforanu i asparaginianu do enzymu. Efekt odwrotny wywiera natomiast ade-
nozynotrifosforan (ATP), który jest efektorem allosterycznym dodatnim, czyli aktywatorem alloste-
rycznym.
Często spotykanym efektem allosterycznym jest hamowanie czynności katalitycznej enzymu,
który zapoczątkowuje dany szlak (enzym regulatorowy) przez produkt reakcji (inhibitor allosteryczny)
na zasadzie ujemnego sprzężenia zwrotnego.
e
1
e
2
e
3
A → B → C → D
Duże stężenie produktu reakcji (związek D), hamuje początkowy etap reakcji katalizowany
przez enzym regulatorowy (e
1
). Przykładem tego typu regulacji jest również hamowanie syntetazy
5-fosforybozylo-1-pirofosforanu (PRPP) przez adenozynomonofosforan (AMP) oraz guanozynomono-
fosforan ( GMP) w biosyntezie nukleotydów purynowych.
9.3.2. Regulacja kowalencyjna
Mianem regulacji kowalencyjnych określa się zmiany aktywności enzymów powstające wsku-
tek przyłączenia grup chemicznych za pomocą wiązań kowalencyjnych. Na tym polega zasadnicza
różnica między tym typem regulacji a efektorami allosterycznymi, przy których efektory wiążą się
z enzymem słabymi wiązaniami niekowalencyjnymi, co nie wymaga nakładu energii. W procesie mo-
dulacji kowalencyjnej przyłączanie i odłączanie grup chemicznych zachodzi enzymatycznie.
Częstymi modulacjami są fosforylacje, acetylacje i metylacje. Pomocniczymi enzymami są
w nich fosfotransferazy, czyli kinazy białkowe i fosfatazy, transmetylazy i demetylazy oraz acetylazy
i deacetylazy. Dawcami grupy fosforanowej są ATP, GTP, CTP, UTP, metylowej – S-adenozynome-
tionina, zaś acylowej – acylo~CoA.
Najczęstsze i najlepiej poznane są procesy fosforylacji białek. Kinazy białkowe znaleziono we
wszystkich tkankach ustroju. Zależnie od funkcji fizjologicznej mogą one mieścić się w cytosolu, bło-
nie komórkowej, jądrze lub mitochondriach. Występują w postaci nieaktywnej i ulegają aktywacji po
zadziałaniu różnego rodzaju regulatorów. Ze względu na rodzaj aktywatora kinazy podzielono na za-
leżne od cyklicznych nukleotydów i jonów Ca
2+
oraz niezależne od wymienionych regulatorów. Pod
wpływem kinaz białkowych zachodzi fosforylacja reszt aminokwasowych w cząsteczce białka, takich
jak seryna, treonina i tyrozyna. Swoistość kinaz jest niezbyt wysoka i ta sama kinaza może fosforyzo-
wać tak różne białka, jak histony, syntazę glikogenu i kinazę pirogronianową.
Najczęściej występującymi kinazami są kinazy zależne od cAMP. Odgrywają one kluczową ro-
lę w działaniu licznych hormonów, które zwiększają lub zmniejszają stężenie cAMP, w zależności od
tkanki. Adrenalina powoduje znaczny wzrost stężenia cAMP w mięśniach szkieletowych, natomiast
nieznaczny w wątrobie. Odwrotny wpływ na stężenie cAMP wykazuje glukagon. Kinazy zależne od
cGMP są dimerami o jednym typie podjednostek. Stają się aktywne po przyłączeniu cGMP do cen-
trum efektorowego. Zmienia to konformację enzymu, odsłaniając centrum katalityczne. Kinazy zależ-
ne od cGMP biorą czynny udział w procesach proliferacji i wzrostu. W szybko rosnących tkankach
wzrasta wydatnie ich aktywność. Fosforylacje zależne od cGMP zachodzą w układzie nerwowym,

9. Podstawowe regulacje metabolizmu
75
w mięśniach gładkich, nabłonku jelit, trzustce i płucach. Działanie tych kinaz uważa się za antagoni-
styczne względem kinaz zależnych od cAMP. Synteza cGMP jest stymulowana przez acetylocholinę,
adrenalinę związaną z receptorem alfa, histaminę i glutaminian.
Kinazy zależne od wapnia działają w wielu tkankach, m.in. w mięśniach gładkich, tkance ner-
wowej, gruczołach wydzielniczych. Kinazy niezależne od znanych aktywatorów występują przeważ-
nie w wirusach, bakteriach i roślinach. Są wprowadzane do komórek zwierzęcych przez wirusy i wią-
żą się z transformacją nowotworową.
9.3.3. Aktywacja proteolityczna
Regulacja tego typu jest nieodwracalna. Wiele enzymów ulega aktywacji w wyniku hydrolizy
kilku lub nawet jednego wiązania peptydowego, występującego w nieaktywnym prekursorze, zwanym
proenzymem. Usunięcie na drodze proteolizy części łańcucha białkowego powoduje zmianę konfor-
macji centrum aktywnego, umożliwiając dostęp substratów do centrum aktywnego. Pod postacią pro-
białek powstają liczne enzymy (pepsynogen, trypsynogen, chymotrypsynogen, prokarboksylazy, pro-
elastaza), a także prekursory wielu hormonów (proinsulina, proglukagon), czynniki fibrynolizy (pla-
zminogen) i czynniki strukturalne (prokolagen, prochityna).
Wytwarzanie enzymów trawiennych w postaci proenzymów ma swoje wytłumaczenie fizjolo-
giczne, gdyż w tej postaci nie mogą trawić białek w komórkach, w których powstają. Proenzymy są
aktywowane przez odpowiednie aktywatory (HCl-pepsynogen, enterokinaza-trypsynogen, trypsyna-
-chymotrypsynogen, proelastaza, prokarboksypeptydazy) w świetle przewodu pokarmowego.
Dla enzymów proteolitycznych wytwarzanych w trzustce bardzo istotne znaczenie ma powsta-
nie aktywnej postaci trypsyny z trypsynogenu. Pod wpływem enzymu enterokinazy, wytwarzanej
przez błonę śluzową jelit, heksapeptyd odłącza się od trypsynogenu, co powoduje odsłonięcie seryny
w centrum aktywnym z grupą –OH oraz powstanie wiązania wodorowego między –H pochodzącym
z pierścienia imidazolowego histydyny a –O seryny. Tak powstała aktywna postać trypsyny działa
zarówno na dalsze cząsteczki trypsynogenu na zasadzie autokatalizy, jak i na pozostałe proenzymy
trzustki.
9.3.4. Zawartość i aktywność enzymów w komórce
Zawartość enzymów w komórkach jest kontrolowana głównie w wyniku działania dwóch pro-
cesów: regulacji syntezy białek enzymatycznych oraz ich degradacji.
Synteza białka enzymatycznego jest często hamowana przez produkt końcowy szlaku na zasa-
dzie sprzężenia zwrotnego lub przez związki hamujące syntezę białka enzymatycznego de novo. Nale-
żą tu antybiotyki, które wybiórczo hamują biosyntezę białka na poziomie transkrypcji – aktynomycy-
na D, lub translacji – puromycyna.
Szybkość degradacji enzymu określamy przez pomiar spadku aktywności po zahamowaniu syn-
tezy białka przez puromycynę D lub stosując metody izotopowe. Białka o większej masie cząsteczko-
wej są degradowane szybciej, natomiast zbudowane z podjednostek ulegają degradacji po uprzedniej
ich dysocjacji do monomerów.
Aktywność enzymu może być również regulowana bez zmiany ilości białka enzymatycznego,
a z udziałem enzymów regulatorowych. W każdym szlaku bądź cyklu metabolicznym znajduje się co
najmniej jeden enzym regulatorowy, który spełnia następujące kryteria:
− jest enzymem allosterycznym,
− ma niską aktywność,
− znajduje się na początku, rzadziej na końcu danego cyklu lub szlaku metabolicznego,
− katalizuje reakcje nieodwracalne,
− posiada aktywatory bądź inhibitory,
− od jego efektywności zależy szybkość danego cyklu lub szlaku metabolicznego.
Bardzo korzystne dla komórki są układy wieloenzymowe, złożone z zespołów enzymów katali-
zujących dwie lub więcej reakcji danego szlaku metabolicznego. Istnienie ich jest bardzo korzystne
dla energetyki komórki, gdyż produkt reakcji działania jednego enzymu może reagować z następnym
bez uprzedniego odłączania od kompleksu. Kompleksy wieloenzymowe są wydajniejsze i szybciej

Część II. Podstawy regulacji metabolicznych
76
katalizują reakcje niż enzymy występujące niezależnie. Rozróżniamy układy frakcji rozpuszczalnych
oraz związane z błonami. Do układów frakcji rozpuszczalnych należą enzymy katalizujące oksydacyj-
ną dekarboksylację ketokwasów: pirogronowego i ketoglutarowego (mitochondrium) oraz syntezę
kwasów tłuszczowych (cytosol). Do układów błonowych należą enzymy łańcucha oddechowego zlo-
kalizowane w wewnętrznej błonie mitochondrialnej.
Zawartość enzymów w poszczególnych tkankach zależy od wielu czynników, takich jak: rodzaj
tkanki, etap rozwoju, składniki pożywienia, hormony czy związki farmakologiczne.
9.3.4.1. Rodzaj tkanki
Zawartość enzymu katalizującego daną reakcję enzymatyczną zależy w znacznym stopniu od
tkanki, w jakiej enzym ten występuje. Mitochondria izolowane z różnych tkanek zawierają enzymy
występujące w stałych proporcjach bez względu na rodzaj tkanki, np. dehydrogenaza jabłczanowa,
izocytrynianowa oraz aminotransferaza asparaginianowa (AST) są podstawowymi składnikami
wszystkich mitochondriów.
Bardziej zmienny poziom dehydrogenazy glutaminianowej, acylotransferazy karnitynowej czy
kinezy fosfokreatynowej można przypisać roli tych enzymów w metabolizmie danej tkanki, będącej
wynikiem jej funkcji metabolicznej. Szczególnie duże różnice zaobserwowano w poziomie izoenzy-
mów dehydrogenazy mleczanowej, heksokinazy i kinazy pirogronianowej w mięśniach, wątrobie i ser-
cu, np. izoenzym 5 dehydrogenazy mleczanowej występuje w mięśniu w ilości 50-krotnie większej,
a w wątrobie w ilości 300-krotnie większej niż w sercu.
9.3.4.2. Etap rozwoju
We wczesnym okresie rozwoju enzymy poszczególnych tkanek są znacznie mniej zróżnicowane
niż w organizmie dorosłym. Synteza nowych enzymów wiąże się z nowymi możliwościami metabo-
licznymi rozwijającego się organizmu. Często jednak pojawienie się nowych enzymów w życiu za-
rodkowym znacznie wyprzedza zapotrzebowanie. Detoksykacja produktów szkodliwych dla płodu
odbywa się za pośrednictwem krążenia łożyskowego, a synteza enzymów cyklu mocznikowego ma
miejsce już w okresie poprzedzającym urodzenie, natomiast UDP-glukuronylotransferaza niezbędna
dla usuwania bilirubiny pojawia się po urodzeniu. Podobnie enzymy syntezy i degradacji glikogenu są
syntetyzowane już w życiu zarodkowym organizmu, podczas gdy enzymy procesu glukoneogenezy
pojawiają się wkrótce po urodzeniu.
9.3.4.3. Rodzaj pożywienia
Rodzaj pożywienia znacznie wpływa na ilość enzymów w wątrobie związanych z metaboli-
zmem aminokwasów, kwasów tłuszczowych i cholesterolu. W zależności od składu diety następuje
jednoczesne wzmożenie syntezy enzymów potrzebnych przy danym typie pokarmu. Jeżeli dieta zmie-
ni się z wysokotłuszczowej na wysokocukrową, po 7–10 dniach zaobserwujemy wzrost ilości enzy-
mów trawiących cukry (amylaza, sacharaza itp.) oraz glukokinazy sprzyjającej gromadzeniu glukozy
w wątrobie, z jednoczesnym zmniejszeniem ilości enzymów glukoneogenezy. Jednocześnie nie zmie-
nia się ilość enzymów trawiących tłuszcze, natomiast nasila się synteza enzymów lipogenezy, takich
jak syntaza kwasów tłuszczowych, karboksylaza acetylo~CoA, dehydrogenaza glukozo-6-fosforano-
wa. Przy diecie wysokotłuszczowej zachodzi zjawisko odwrotne.
Spośród enzymów katalizujących degradację aminokwasów największą korelację między ich
zawartością w tkance wątrobowej a rodzajem spożywanego pożywienia wykazują przede wszystkim
enzymy cyklu mocznikowego. Spośród enzymów związanych z metabolizmem kwasów tłuszczowych
enzymem najbardziej wrażliwym na stężenie lipidów w pożywieniu jest karboksylaza acetylo~CoA,
pierwszy enzym występujący w procesie syntezy kwasów tłuszczowych. Przykładem wpływu poży-
wienia na poziom enzymu w wątrobie na zasadzie hamowania w wyniku sprzężenia zwrotnego jest
hamujące działanie cholesterolu na zawartość β-hydroksy-β-metyloglutanylo-CoA. Przy podawaniu po-
żywienia niezawierającego cholesterolu jego aktywność wzrasta 100-krotnie w porównaniu z aktyw-
nością mierzoną w obecności cholesterolu.

9. Podstawowe regulacje metabolizmu
77
9.3.4.4. Hormony i ich receptory
Do hormonów zwiększających poziom wielu enzymów należą glukokortykosteroidy. Stymulują
one przede wszystkim syntezę enzymów glukoneogenezy, ale również enzymów związanych z prze-
mianami aminokwasów.
Hormony płciowe mają również silne działanie anaboliczne, ale do najbardziej anabolicznych
hormonów należy insulina, która pobudza biosyntezę enzymów regulatorowych głównych szlaków
metabolicznych biorących udział w reakcjach syntezy cukrów, tłuszczów i białek, hamując jednocześ-
nie syntezę enzymów katalizujących ich rozpad.
Wiele hormonów ma swoich antagonistów, np. antagonistą insuliny jest glukagon. Główne
działanie insuliny polega na magazynowaniu energii przez pobudzenie glikogenogenezy, lipogenezy
oraz syntezy białek, natomiast glukagon powoduje szybką mobilizację źródeł energetycznych, tj. gli-
kogenolizę i lipolizę. Glukagon należy również do hormonów najsilniej pobudzających glukoneoge-
nezę i działa ketogennie, w przeciwieństwie do insuliny. Wraz z adrenaliną, kortyzonem i hormonem
wzrostu glukagon należy do grupy hormonów przeciwregulacyjnych, działających przeciwstawnie do
insuliny. Najważniejszym efektem ich działania jest wzrost stężenia glukozy we krwi.
Wewnątrzkomórkowe działanie hormonów zależy od połączenia ich ze swoistymi receptorami.
Obserwuje się je tylko w tych tkankach, których komórki zawierają receptory swoiste dla danych hor-
monów. Połączenie z receptorem komórkowym jest pierwszym etapem działania hormonów. Wszyst-
kie hormony posiadają co najmniej dwie domeny, z których jedna rozpoznaje hormon, a druga
wytwarza sygnał wywołujący określoną czynność komórkową.
9.4. Regulacja transportu metabolitów przez błony
Przepływ substancji przez błony wewnątrzkomórkowe reguluje dostęp substratów do komórki,
a więc także intensywność metabolizmu. Zasadniczą rolę odgrywa hydrofobowe wnętrze błony lipi-
dowej, gdyż zapobiega ono przechodzeniu większości cząsteczek hydrofilowych. Błona komórkowa
jest nieprzepuszczalna dla większości cząsteczek polarnych, co zapobiega wyjściu z komórki jej meta-
bolitów o charakterze polarnym. Transport przez błony może zachodzić w sposób bierny, aktywny lub
wspomagany.
O transporcie biernym mówimy wtedy, gdy cząsteczka przechodzi przez błonę drogą dyfuzji,
zgodnie z gradientem stężeń, bez utraty energii. Transport bierny prowadzi do wyrównania stężeń
transportowanego metabolitu po obu stronach błony. W ten sposób przemieszcza się przede wszyst-
kim woda oraz metabolity niepolarne, lipofilne, takie jak kwasy tłuszczowe lub steroidy. W błonach,
szczególnie w błonie plazmatycznej, występują liczne kanały, np. wapniowe, sodowe lub potasowe.
Wykazują one swoistość wobec określonych jonów, a ich otwieranie i zamykanie regulowane jest
przez odpowiednie mechanizmy.
Transport aktywny zachodzi niezależnie od gradientu stężeń lub wbrew niemu i wymaga
energii pochodzącej z hydrolizy ATP. Znaczną rolę odgrywa tu pompa sodowo-potasowa. Wewnątrz-
komórkowe stężenie potasu jest wysokie, sodu zaś niskie. W płynie pozakomórkowym sytuacja jest
odwrotna. Stężenie sodu jest utrzymane kosztem energochłonnego wyrzucania jego jonów z komórki.
Duże znaczenie regulacyjne ma transport przez błonę mitochondrialną. Uczestniczące w nim
translokazy podlegają allosterycznej regulacji przez odpowiednie efektory. Glukoneogeneza jest uwa-
runkowana działaniem dwóch translokaz: pirogronianowej, transportującej pirogronian do mitochon-
drium, oraz dikarboksylowej przenoszącej produkt karboksylacji pirogronianu szczawiooctan, który
jako jabłczan przechodzi do cytosolu.
Transport wspomagany jest formą pośrednią i wykazuje zarówno cechy transportu biernego,
jak i czynnego. Zachodzi zgodnie z gradientem stężeń, bez zużycia energii, lecz wymaga udziału prze-
nośnika.
P i ś m i e n n i c t w o
1. Biochemia Harpera ilustrowana. Red. R.K. Murray, D.K. Granner, V.W. Rodwell. Wydawnictwo
Lekarskie PZWL, Warszawa 2008, s. 354–363.
2. Bryła J. Regulacja metabolizmu komórki. PWN, Warszawa 1981, s. 117–237.
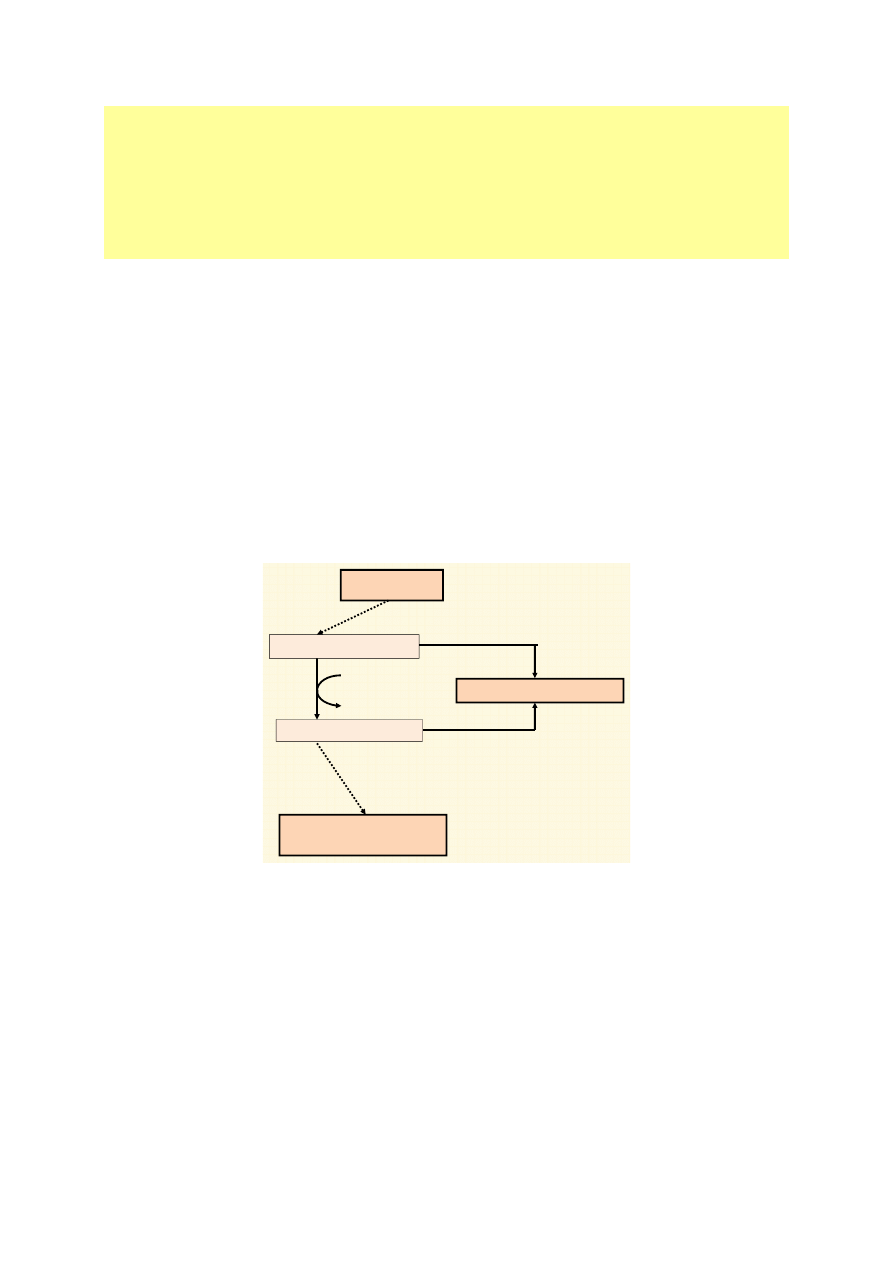
CZĘŚĆ III
PŁYNY BIOLOGICZNE
I GOSPODARKA WODNO-ELEKTROLITOWA
Z ELEMENTAMI DIAGNOSTYKI LABORATORYJNEJ
10. KREW
Iwona Błaszczyk, Ewa Romuk
10.1. Metabolizm erytrocytów
Dojrzały erytrocyt jest pozbawiony jądra, mitochondriów i rybosomów, a więc nie zachodzi
w nim synteza DNA, RNA, białek i lipidów. Źródłem energii dla krwinki czerwonej są procesy fosfo-
rylacji substratowej w glikolitycznej przemianie glukozy, a wychwyt glukozy przez erytrocyty zacho-
dzi niezależnie od insuliny. W ten sposób około 90% glukozy ulega zużyciu. W wyniku przemiany
jednej cząsteczki glukozy powstają dwie cząsteczki kwasu mlekowego i dwie ATP. Powstający ATP
jest niezbędny do utrzymania prawidłowego kształtu krwinki czerwonej i pokrycia potrzeb energe-
tycznych związanych z funkcjonowaniem pompy sodowo-potasowej.
glukoza
1,3-bifosfoglicerynian
2,3-bifosfoglicerynian
kwas mlekowy
3-fosfoglicerynian
ADP
ATP
Ryc. 21. Glikoliza i powstawanie 2,3-bifosfoglicerynianu w erytrocytach
Przemiana beztlenowa glukozy w erytrocytach do kwasu mlekowego przebiega wieloetapowo,
identycznie jak w innych komórkach organizmu. Charakterystycznym jej elementem jest przekształ-
cenie części 1,3-bifosfoglicerynianu do 2,3-bifosfoglicerynianu (ryc. 21). Reszta 1,3-bifosfoglicerynia-
nu ulega kolejnym przemianom glikolitycznym. Zespół przemian prowadzących do powstania w ery-
trocytach 2,3-bifosfoglicerynianu, w postaci odgałęzienia od toru glikolitycznego jest nazywany cy-
klem Rappoporta-Lueberinga.
10.2. Niedokrwistości
Niedokrwistość (anemia) jest stanem zmniejszonego stężenia hemoglobiny we krwi. Jej przy-
czyną są procesy wywołujące niewystarczającą erytropoezę lub wzmożony rozpad erytrocytów (tab.
IV). Stan taki prowadzi do ogólnoustrojowego niedotlenienia tkanek.

10. Krew
79
Tabela IV. Kliniczny podział niedokrwistości
Rodzaj niedokrwistości
Patomechanizm
Pokrwotoczne
utrata krwi
Aplastyczne
zaburzenia różnicowania (uszkodzenie puli komórek
macierzystych)
immunologiczne hamowanie przez T-supresory
Dyserytropoetyczne
nieskuteczna erytropoeza – defekt komórek macierzys-
tych lub mikrośrodowiska, zaburzenia syntezy hemu
Niedoborowe
zaburzenia syntezy DNA, hemoglobiny
Hemolityczne
zaburzenia syntezy globiny, lipidów błony komórko-
wej erytrocytów, enzymów glikolitycznych i układów
redukujących erytrocytów
niszczenie erytrocytów przez czynniki zewnątrzkrwin-
kowe i niszczenie w śledzionie
Wtórne w przebiegu różnych schorzeń
patomechanizm złożony
10.3. Białka osocza krwi
W osoczu człowieka wykazano obecność licznych białek, lecz tylko kilkanaście z nich ozna-
czanych jest rutynowo. Stężenia białek podlegają znacznym wahaniom w różnych okresach życia, za-
leżne są również od fizjologicznego stanu organizmu. Wiele białek obecnych w surowicy pochodzić
może z rozpadających się komórek, stanowiąc ważny wskaźnik patologii narządowych. Stężenie biał-
ka w osoczu wynosi 60–80 g/l. Większość białek osocza powstaje w wątrobie, drugą znaczącą grupą
są immunoglobuliny syntetyzowane w komórkach układu immunologicznego – limfocytach. Niewiel-
ka cześć białek powstaje w tkankach i narządach, np. niektóre lipoproteiny w jelitach, transferyna
w jelitach i szpiku kostnym. Okres półtrwania białek osocza jest bardzo różny – dla albuminy wynosi
około 14 dni, dla immunoglobulin 24 dni, dla czynnika VIII krzepnięcia kilka godzin.
Białka osocza poza albuminami są glikoproteinami (białkami, w których łańcuchy oligosacha-
rydowe przyłączone są kowalencyjnie do rdzenia peptydowego).
10.3.1. Zaburzenia ilościowe białek osocza
Hiperproteinemia to stan odpowiadający stężeniu białka w surowicy krwi powyżej 80 g/l. Naj-
częściej jest ona efektem zwiększonej syntezy immunoglobulin (hipergammaglobulinemia), a jej przy-
czynami są:
− gammapatie poliklonalne – przewlekłe stany zapalne, choroby autoimmunologiczne (reumatoidalne
zapalenie stawów, twardzina układowa, toczeń układowy),
− gammapatie monoklonalne – szpiczak mnogi, makroglobulinemia Waldenstroma, choroba łańcu-
chów ciężkich,
− odwodnienie,
− błąd pobrania – przetrzymana zbyt długo staza.
Hipoproteinemia to stan odpowiadający stężeniu białka w surowicy krwi poniżej 60 g/l. Za
krytyczne uważa się stężenie białka całkowitego poniżej 45 g/l i stężenie albumin poniżej 20 g/l. Do-
chodzi wtedy, na skutek spadku ciśnienia osmotycznego, do przemieszczania się wody z łożyska na-
czyniowego do przestrzeni śródtkankowej i – w efekcie – do powstawania obrzęków i przesięków do
jam ciała oraz hipowolemii. Przyczynami hipoproteinemii są:
− zahamowanie syntezy białek w wątrobie (niedożywienie, zaburzenia wchłaniania, choroby wątroby
– marskość, choroby nowotworowe),
− zwiększona utrata białek (nerki, jelita, skóra, wysięki, stany kataboliczne),
− niedobory immunoglobulin,
− przewodnienie,
− pobranie krwi z płynem infuzyjnym.

Część III. Płyny biologiczne i gospodarka wodno-elektrolitowa ...
80
10.3.2. Albumina
Albumina jest głównym białkiem ludzkiego osocza (60%) o masie cząsteczkowej 66 kD. W 40%
występuje w przestrzeni wewnątrznaczyniowej, a w 60% w przestrzeni pozakomórkowej, pozanaczy-
niowej. Ma kształt eliptyczny, co sprawia, że nie zwiększa lepkości krwi, lecz łatwiej przenika przez
kłębuszki nerkowe. Główną jej funkcją jest regulowanie ciśnienia onkotycznego krwi (odpowiada za
75–80% tego ciśnienia). Ma także zdolność do wiązania i transportu różnych ligandów: wolnych kwa-
sów tłuszczowych, wapnia, miedzi, hormonów steroidowych, bilirubiny, leków. Buforuje zmiany pH
krwi. U ludzi występuje jeden rodzaj albuminy. W rzadkich przypadkach dochodzi do bisalbuminemii,
czyli występowania dwóch rodzajów albumin. Praktycznie nie obserwuje się stanów hiperalbuminemii
(z wyjątkiem odwodnienia).
Hipoalbuminemia może wynikać z obniżonej syntezy, zaburzonej dystrybucji (choroby wątro-
by) lub zwiększonej utraty (zespół nerczycowy, krwotoki, oparzenia) albumininy. Zmiany stężenia
albuminy są jednym z głównych objawów zaawansowanego niedożywienia białkowego, spadek jest
też wskaźnikiem kacheksji u chorych z nowotworami złośliwymi, a w powiązaniu z czynnikami za-
palnymi jest wykorzystywany do oceny stanów krytycznych. Albumina znajduje zastosowanie w le-
czeniu oparzeń oraz wstrząsu krwotocznego.
10.3.3. Białka ostrej fazy
Jest to grupa białek syntetyzowanych głównie w wątrobie pod wpływem cytokin prozapalnych
(Il-2, Il-6) w przebiegu martwicy, stanów zapalnych, chorób zakaźnych i nowotworowych. Białka te
są częścią niespecyficznej odpowiedzi immunologicznej. Ich rola polega na modulowaniu odczynu
zapalnego i ochronie tkanek nieobjętych procesem zapalnym przed niszczącym działaniem proteinaz
i oksydantów wydzielanych przez fagocyty. W elektroforezie wędrują one wraz z frakcjami
α
1
i
α
2
.
Białka ostrej fazy dzielimy na dodatnie i ujemne.
10.3.3.1. Ujemne białka ostrej fazy
Jest to grupa białek, których stężenie obniża się w wyniku stymulacji zapalnej. Należą do niej
albumina, prealbumina i transferyna.
10.3.3.2. Dodatnie białka ostrej fazy
Dzielą się na trzy grupy:
− silnie reagujące – charakteryzujące się kilkudziesięcio- lub nawet stukrotnym wzrostem stężenia
w osoczu w odpowiedzi na odczyn zapalny; należą do nich białko C-reaktywne (CRP), surowicze
amyloidowe białko A (SAA) oraz prokalcytonina (PCT),
− umiarkowanie reagujące – charakteryzujące się przynajmniej dwukrotnym wzrostem stężenia
w osoczu, zaliczamy do nich α
1
-antytrypsynę, kwaśną α
1
-glikoproteinę (orozomukoid), haptoglobi-
nę oraz fibrynogen,
− słabo reagujące – charakteryzujące się minimalnym wzrostem stężenia w osoczu, należą do nich
ceruloplazmina oraz składowe dopełniacza C
3
, C
4
.
Białko C-reaktywne jest silnie dodatnim białkiem ostrej fazy syntetyzowanym w wątrobie.
Wzrost jego stężenia obserwujemy już w pierwszych godzinach po zadziałaniu bodźca (2–4 godzina).
Ma krótki okres półtrwania wynoszący 12 godzin. Powrót do normy obserwujemy po około 3–4
dniach. Wartości prawidłowe wynoszą 0–10 mg/l. Wzrost stężenia CRP jest pojedynczym wskaźni-
kiem rozwijającego się stanu zapalnego na tle infekcji bakteryjnej, ostrego zapalenia trzustki, zapale-
nia otrzewnej i martwicy. Stężenia CRP > 10 mg/l są charakterystyczne dla lokalnego ogniska zapal-
nego, natomiast CRP > 100 mg/l są związane z infekcjami bakteryjnymi i rozległym procesem zapal-
nym.
Prokalcytonina wykorzystywana jest m.in. w różnicowaniu bakteryjnej i niebakteryjnej mar-
twicy w ostrym zapaleniu trzustki, bakteryjnego i wirusowego zapalenia opon mózgowo-rdzeniowych
u dzieci, ostrego odrzutu przeszczepu od zakażenia potransplantacyjnego. Norma dla prokalcytoniny
wynosi poniżej 0,5 ng/ml.

10. Krew
81
10.3.3.3. Białka ostrej fazy biorące udział w gospodarce żelazem
Ogólna pula żelaza w organizmie wynosi 3–5 gramów. Występuje ono w postaci hemoglobiny,
mioglobiny, ferrytyny i hemosyderyny. Laboratoryjna ocena żelaza w organizmie obejmuje badanie:
morfologii krwi obwodowej, stężenia żelaza w surowicy, stężenia ferrytyny w surowicy, stężenia
transferyny w surowicy, całkowitej zdolności wiązania żelaza oraz rozpuszczalnego receptora transfe-
ryny w surowicy.
Haptoglobina migruje w elektroforezie białek krwi w regionie α
2
-globulin. Wiąże pozakrwin-
kową hemoglobinę w niekowalencyjny kompleks, zabezpieczając w ten sposób ustrój przed utratą
żelaza. Wzrost stężenia obserwujemy w oparzeniach i zespole nerczycowym, spadek zaś w niedokrwi-
stości hemolitycznej, wewnątrznaczyniowej hemolizie, po transfuzji, a także w ostrych chorobach
wątroby.
Ferrytyna zawiera około 23% żelaza oraz apoferrytynę. Zbudowana z 24 podjednostek, wiążą-
cych 3000–4000 atomów żelaza. W warunkach niedoboru żelaza jej wartość maleje, natomiast w wa-
runkach nadmiaru rośnie.
Transferyna jest białkiem transportującym żelazo na trzecim stopniu utlenienia z jelita do szpi-
ku kostnego. Jedna cząsteczka białka wiąże dwa atomy żelaza. Prawidłowo 1/3 transferyny jest wysy-
cona żelazem. W warunkach niedoboru żelaza stężenie transferyny jest podwyższone, a w warunkach
niedożywienia obniżone.
10.3.3.4. Pozostałe białka osocza ostrej fazy
Alfa-1-antytrypsyna – główny składnik α
1
-globulin (90%). Odpowiedzialna za hamowanie
trypsyny, chymotrypsyny, reniny, plazminy, trombiny, proteaz, elastazy uwalnianej z granulocytów.
Inaktywuje ją palenie papierosów. Objawy niedoboru to u noworodków żółtaczka, u dorosłych – ro-
zedma płuc, rozstrzenie oskrzeli, marskość wątroby. Spadek stężenia obserwujemy w ostrych zespo-
łach utraty białek, zespole niewydolności oddechowej noworodków.
Alfa-1-kwaśna glikoproteina wiąże i transportuje progesteron. Znaczny wzrost jej stężenia
występuje w chorobie Crohna, reumatoidalnym zapaleniu wątroby, toczniu rumieniowatym trzewnym,
chorobach nowotworowych i zawale mięśnia sercowego, spadek zaś w ciężkich uszkodzeniach wątro-
by i niedożywieniu.
Ceruloplazmina wykazuje ruchliwość α
2
-globulin. Wiąże jony miedzi, zawiera 90% miedzi
zawartej w osoczu. Każda cząstka ceruloplazminy wiąże 6–7 atomów Cu. Katalizuje także utlenianie
Fe
2+
do Fe
3+
oraz odgrywa rolę antyoksydacyjną w stanie ostrej fazy. Wzrasta w procesach zapalnych
i martwiczych, nowotworach, chorobie Hodgkina, zapaleniu i obstrukcji przewodów żółciowych, w nie-
doborze żelaza, w okresie ciąży, przy doustnej antykoncepcji. W chorobie Wilsona obserwujemy w su-
rowicy niskie stężenie ceruloplazminy, wysokie stężenie dializowanej miedzi, u dzieci objawy wątro-
bowe, a u dorosłych objawy neurologiczne. W niedożywieniu, zespole nerczycowym i marskości wą-
troby stężenie ceruloplazminy także jest niskie.
Beta-2-mikroglobulina występuje na powierzchni wszystkich komórek jądrzastych, szczegól-
nie limfocytów i komórek nowotworowych. Jej stężenie we krwi wzrasta w niewydolności nerek, za-
paleniach i nowotworach (szczególnie związanych z limfocytami B). W płynie mózgowo-rdzeniowym
wzrost stężenia B
2
-mikroglobulina obserwujemy w przebiegu białaczki w obrębie ośrodkowego ukła-
du nerwowego.
Fibrynogen wytwarzany jest w wątrobie. Jest pierwszym czynnikiem krzepnięcia krwi zaanga-
żowanym w końcowej fazie procesu krzepnięcia polegającej na przekształceniu w białko fibrylarne –
fibrynę (włóknik) współtworzącą skrzep krwi. Jego stężenie rośnie w przebiegu procesów martwi-
czych i zapalnych. Spadek stężenia fibrynogenu obserwujemy w zespole rozsianego wykrzepiania
śródnaczyniowego, w niedożywieniu i marskości wątroby.
Białka układu dopełniacza to około 20 białek, które w kaskadzie ulegają aktywacji przez pro-
teolizę. Ich aktywatorami są kompleksy immunoglobulin IgG i IgM oraz CRP z antygenem (droga
klasyczna) lub kompleksy IgA z mikroorganizmami (droga alternatywna). Najwyższe wśród białek
tego układu jest stężenie białka C3. Wykrywane jest we frakcji β
2
-globulin – tylko w świeżej surowi-
cy. Choroby z autoagresji wywołują spadek stężenia C3. Przyczynami spadku stężenia C3 i/lub C4 są:

Część III. Płyny biologiczne i gospodarka wodno-elektrolitowa ...
82
toczeń trzewny rumieniowaty, kłębuszkowe zapalenie nerek, krioglobulinemia, bakteriemia Gram(+)
oraz uogólniona infekcja cytomegalowirusowa.
10.3.4. Immunoglobuliny
Są to białka wytwarzane w odpowiedzi na wprowadzenie do organizmu obcej substancji wiel-
kocząsteczkowej, czyli antygenu. Immunoglobuliny wędrują w elektroforezie głównie z frakcją gam-
ma, ale także częściowo z frakcjami alfa i beta. Jest to rodzina białek zbudowana według wspólnego
schematu i syntetyzowana przez limfocyty B w ramach odpowiedzi immunologicznej typu humoral-
nego. Każda cząsteczka immunoglobuliny jest zbudowana z połączonych za pomocą mostków di-
siarczkowych 2 łańcuchów lekkich i 2 łańcuchów ciężkich. W sekwencji polipeptydowej łańcucha
lekkiego możemy wyróżnić obszar zmienny V, obszar łącznikowy J i obszar stały C. Łańcuch ciężki
ma dodatkowo umieszczony pomiędzy fragmentem V i J fragment „nadzmienny” D. Wyróżniamy
dwa typy łańcuchów lekkich: kappa i lambda. Łańcuchy ciężkie dzielą się na pięć głównych klas: α, β,
γ, δ, ε. W budowie immunoglobuliny wyróżnia się dwa fragmenty Fab, z których każdy zawiera jedno
miejsce wiązania antygenu i jeden fragment Fc, odpowiadający za wiązanie dopełniacza i reakcje fa-
gocytozy.
Immunoglobuliny klasy IgG – stanowią około 75% wszystkich immunoglobulin. Warunkują
wtórną (nabytą) odpowiedź immunologiczną. Wyróżniamy cztery podklasy IgG (IgG1–IgG4). IgG2
słabo przechodzą przez łożysko. Noworodek rodzi się z zapasem IgG dostarczonych przez łożysko
matki. Zapas ten wyczerpuje się stopniowo wraz z narastaniem IgG produkowanych przez organizm
dziecka.
Immunoglobuliny IgA – stanowią do 15% wszystkich immunoglobulin. Większość jest synte-
tyzowana w postaci wydzielniczej, tj. dimeru połączonego łańcuchem łącznikowym. Obecne są we
wszystkich wydzielinach, są głównymi immunoglobulinami śliny, łez i mleka.
Immunoglobuliny IgM – stanowią 5–10% wszystkich przeciwciał w osoczu. Warunkują pier-
wotną (wrodzoną) odpowiedź immunologiczną. Są to wczesne przeciwciała produkowane zanim dru-
ga ekspozycja na antygen nie wywoła transformacji do komórek plazmatycznych produkujących IgG.
Mają postać pentametru i dziesięć miejsc wiążących antygen, dzięki czemu cząsteczki IgM odznaczają
się dużą zdolnością wiązania antygenu. Do klasy tej należą izoaglutyniny układu ABO grup krwi.
Immunoglobuliny IgE – pobudzają komórki tuczne i bazofile do wydzielania histaminy i in-
nych mediatorów lokalnej odpowiedzi zapalnej. Ich ilość rośnie w odpowiedzi na alergen, a także
w zakażeniach pasożytniczych.
Immunoglobuliny IgD – ich funkcja jest mało poznana, wchodzą w skład przeciwciał obec-
nych na limfocytach B.
10.3.5. Markery nowotworowe
Są białkami specyficznymi, swoistymi syntetyzowanymi i uwalnianymi przez komórki nowo-
tworowe lub produkowane przez komórki gospodarza w odpowiedzi na obecność komórek nowotwo-
rowych. Ich stężenie podwyższa się w miarę wzrostu nowotworów. Dzielimy je na komórkowe mar-
kery nowotworowe (antygeny błon komórkowych, receptory dla hormonów i czynników wzrostu,
onkogeny, geny supresorowe), wykazywane w badaniach histopatologicznych, oraz krążące markery
nowotworowe (antygeny o różnym pochodzeniu) oznaczane w surowicy krwi.
Tabela V. Wybrane markery nowotworowe w diagnostyce
i monitorowaniu chorób nowotworowych
Nowotwór
Podstawowy marker
Rak jelita grubego
CEA
Rak żołądka
CA 72–4
Rak wątroby
AFP
Rak piersi
CA 15–3
Rak jajnika
CA 125
Rak gruczołu krokowego
PSA
Rak tarczycy
tyreoglobulina, kalcytonina

10. Krew
83
10.3.6. Metody rozdziału białek osocza krwi
Białka osocza krwi można rozdzielić na frakcje. Najczęściej wykorzystuje się proces elektrofo-
rezy oraz chromatografię.
10.3.6.1. Elektroforeza białek surowicy (proteinogram)
Elektroforeza polega na wędrówce białek surowicy krwi w polu elektrycznym. Do rozdziału
białek wykorzystujemy różnego rodzaju podłoża (agarowa, octan celulozy) i bufory o pH zasadowym.
Białka, będące w większości anionami, poruszają się z różną prędkością w kierunku anody i rozdziela-
ją się na kilka frakcji. Szybkość wędrówki poszczególnych białek zależy od wielkości ładunku ujem-
nego i jego stosunku do masy cząsteczkowej białka.
Białka rozdzielają się na pięć głównych frakcji:
− albuminy
59–72%
− α
1
-globuliny 1–4%
− α
2
-globuliny 3–14%
− β-globuliny 8–17%
− γ-globuliny 9–22%
W rozdziale elektroforetycznym osocza pomiędzy frakcjami β i γ obecna jest frakcja zawierają-
ca fibrynogen. Po wybarwieniu uzyskany rozdział elektroforetyczny jest porównywany z rozdziałem
normalnym. Wyliczenie procentowej zawartości poszczególnych frakcji umożliwia pomiar densyto-
metryczny.
10.3.6.2. Chromatografia
Jest to metoda analityczna polegająca na rozdzieleniu substancji między fazy stacjonarną i ru-
chomą. Ze względu na rodzaj fazy ruchomej wyróżniamy chromatografię cieczową i gazową. Jeżeli
faza stała wypełnia rurkę, mówimy o chromatografii kolumnowej, a jeżeli pokrywa powierzchnię,
mówimy o chromatografii cienkowarstwowej. Rozdziału mieszaniny składników dokonuje się na za-
sadzie elucji (wymywania).
Do rozdziału białek używamy najczęściej:
− chromatografii powinowactwa – polegającej na wybiórczym wiązaniu się niektórych białek z in-
nymi substancjami, np. z enzymem mającym powinowactwo do koenzymu obecnego w fazie sta-
cjonarnej, pozostałe białka przepłyną swobodnie przez kolumnę,
− chromatografii żelowej – polegającej na rozdzielaniu mieszaniny białek ze względu na wielkość
cząsteczki; fazą stacjonarną jest porowaty żel, a ruchomą roztwór buforowy; cząsteczki o większej
masie cząsteczkowej są wymywane szybciej, a pozostałe – o mniejszej masie cząsteczkowej – wol-
niej, gdyż silniej penetrują pory żelu,
− chromatografii jonowymiennej – fazę stacjonarną stanowią żywice jonowymienne; wprowadzana
na kolumnę mieszanina białek jest rozdzielana – białka o przeciwnym ładunku są wiązane, a o ła-
dunku zgodnym z wypełnieniem kolumny przepływają swobodnie i są wymywane w pierwszej ko-
lejności,
− wysokosprawnej chromatografii cieczowej (HPLC) – polegającej na przepływie fazy ruchomej
przez kolumnę z wypełnieniem pod wysokim ciśnieniem.
Elektroforezę i chromatografię wykorzystuje się również do rozdzielania innych (poza oso-
czem) mieszaniny białek.
10.4. Hemostaza
Podstawową rolą krwi w organizmie jest utrzymanie stałego środowiska wewnętrznego. Mate-
riałem najczęściej używanym do badań biochemicznych jest surowica, powstająca w wyniku krzep-
nięcia krwi. Od osocza różni się brakiem fibrynogenu i niektórych czynników krzepnięcia. Osocze
powstaje w wyniku oddzielenia elementów morfotycznych krwi od frakcji płynnej.
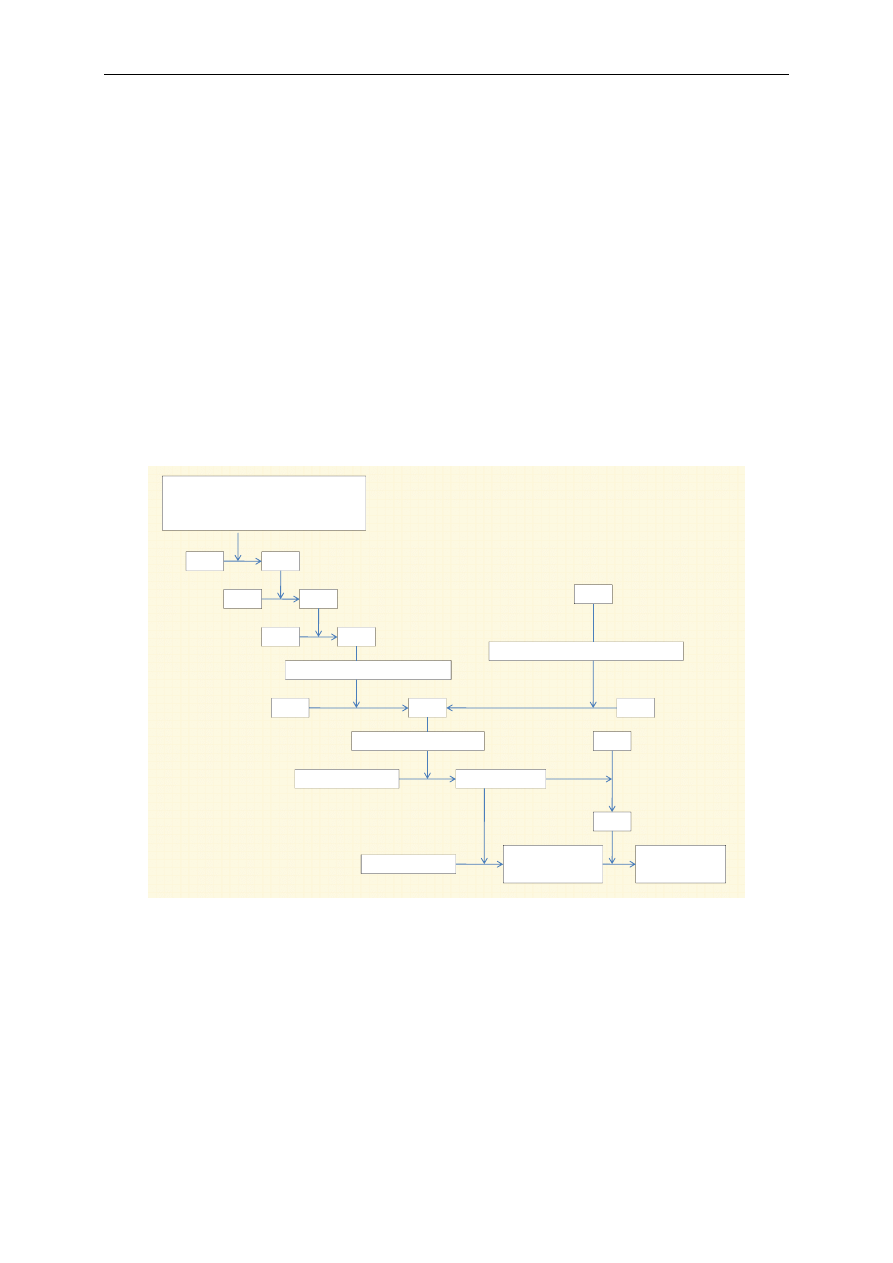
Część III. Płyny biologiczne i gospodarka wodno-elektrolitowa ...
84
Hemostaza jest zespołem mechanizmów umożliwiających zachowanie płynności krwi oraz za-
trzymanie krwawienia wywołanego naruszeniem ciągłości naczyń. Podstawowymi elementami hemo-
stazy są:
− ściany naczyń krwionośnych, a zwłaszcza śródbłonek,
− płytki krwi i inne elementy morfotyczne krwi (erytrocyty, monocyty, granulocyty),
− układ krzepnięcia i fibrynolizy.
10.5. Krzepnięcie krwi
Prawie wszystkie czynniki krzepnięcia (z wyjątkiem jonów wapnia) są białkami i można je po-
dzielić na trzy grupy:
− czynniki aktywowane przez kontakt z powierzchnią (XI, XII), czynnikiem aktywującym mogą być
odsłonięte z powodu urazu włókna kolagenu,
− czynniki zespołu protrombiny (II, VII, IX, X), syntetyzowane w wątrobie przy udziale witaminy K,
− czynniki z grupy fibrynogenu (I, V, VIII, XIII), wykazują dużą wrażliwość na działanie trombiny
i plazminy.
Proces krzepnięcia dzieli się na trzy okresy (ryc. 22): aktywacja czynnika X, przemiana pro-
trombiny w trombinę oraz przekształcenie fibrynogenu w fibrynę.
XII
XIIa
XIa
XI
kontakt z powierzchnią,
wielkocząsteczkowy kininogen,
kalikreinogen
IXa – Ca
2+
– VIII – Fl
IXa
IX
X
Xa
Xa – Ca
2+
– V – Fl
X
protrombina (II)
trombina (IIa)
fibryna
niestabilizowana
XIII
XIIIa
fibrynogen (I)
fibryna
stabilizowana
VIIa – czynnik tkankowy – Ca
2+
VII
uk
ład zewn
ątrzpoch
odn
y
uk
ład we
wn
ątrzpoc
hodny
Ryc. 22. Schemat krzepnięcia krwi. Fl – fosfolipidy, in vivo głównie fosfolipidy płytek krwi
Aktywny czynnik X jest niezbędny do przekształcenia protrombiny w trombinę. Jego uczynnie-
nie zachodzi dwoma torami przemian biochemicznych poprzez układ wewnątrzpochodny lub układ
zewnątrzpochodny.
Wszystkie składniki układu wewnątrzpochodnego znajdują się w świetle naczyń. Kaskadę za-
początkowuje zetknięcie czynników kontaktu, a zwłaszcza czynnika XII, z odsłoniętym kolagenem
w uszkodzonym naczyniu. Uczynnienie XII przyspiesza obecność wielkocząsteczkowego kininogenu
oraz kalikreinogenu. Ten ostatni – jako enzym uczynniony – kalikreina, przyspiesza proteolizę czyn-
nika XII na kilka fragmentów. Jeden z nich – XIIa działa aktywująco na czynnik XI. Powstały XIa
powoduje w obecności jonów wapnia przekształcenie czynnika IX w IXa. Kaskadowa proteolityczna
aktywacja kolejnych czynników prowadzi do powstania kompleksu IXa–VIII–fosfolipidy płytkowe–
–jony wapniowe–X. Ten złożony kompleks, w którym jony wapniowe umożliwiają wiązanie pozosta-

10. Krew
85
łych czynników na powierzchni fosfolipidów, ułatwia proteolizę czynnika X przez czynnik IXa. W ten
sposób powstaje Xa, nazywany protrombinazą.
Kontakt czynnika VII z czynnikiem tkankowym, czyli tromboplastyną tkankową, przy udziale
Ca
2+
powoduje powstanie VIIa. Tromboplastyna tkankowa prawidłowo nie występuje w świetle na-
czyń, stąd nazwa „układ zewnątrzpochodny”. Powstaje kompleks VIIa–czynnik tkankowy–Ca
2+
uczynniający czynnik X.
Dalsze przemiany procesu krzepnięcia to przekształcenie protrombiny (II) w trombinę (IIa) pod
wpływem Xa. Trombina jest enzymem uczestniczącym w przemianie rozpuszczalnego fibrynogenu (I)
w nierozpuszczalną fibrynę. Stabilizację fibryny katalizuje czynnik XIIIa, uprzednio uczynniony przez
trombinę.
10.6. Fibrynoliza
Istotą fibrynolizy jest rozpuszczanie wewnątrznaczyniowego skrzepu płytkowo-fibrynowego,
a tym samym zapewnienie drożności naczyń krwionośnych. Układ fibrynolityczny składa się z: pla-
zminogenu, aktywatorów procesu przekształcenia plazminogenu w plazminę oraz inhibitorów działa-
jących na różnych etapach fibrynolizy.
Proces fibrynolizy rozpoczyna powstanie plazminy z plazminogenu w obecności aktywatorów
.
W wyniku działania plazminy powstają peptydowe produkty rozpadu fibrynogenu lub fibryny. Do
produktów degradacji fibrynogenu (FDP) należą wielkocząsteczkowe FDP o właściwościach anty-
koagulacyjnych oraz drobnocząsteczkowe FDP, zwiększające przepuszczalność naczyń włosowatych
i działające chemotaktycznie dla leukocytów.
10.7. Inhibitory krzepnięcia i fibrynolizy
Naturalne inhibitory enzymów proteolitycznych stanowią barierę dla działania proteaz krzep-
nięcia i fibrynolizy. Do inhibitorów tych należą m.in.:
− antytrombina III,
− alfa
1
-antytrypsyna,
− alfa
2
-antyplazmina,
− alfa
2
-makroglobulina,
− C
1
inhibitor.
P i ś m i e n n i c t w o
1. Bańkowski E. Biochemia. Podręcznik dla studentów studiów licencjackich i magisterskich. Med-
Pharm Polska, Wrocław 2006, s. 3–35.
2. Biochemia Harpera ilustrowana. Red. R.K. Murray, D.K. Granner, V.W. Rodwell. Wydawnictwo
Lekarskie PZWL, Warszawa 2008, s. 706–727.
3. Biochemia kliniczna. Red. S. Angielski, J. Rogulski. PZWL, Warszawa 1991, s. 748–796.
4. Bomski H. Podstawowe laboratoryjne badania hematologiczne. PZWL, Warszawa 1995, s. 226–
–437.
5. Choroby wewnętrzne. Red. F. Kokot. PZWL, Warszawa 1991, s. 361–437.
6. Dembińska-Kieć A., Naskalski J. Diagnostyka laboratoryjna z elementami biochemii klinicznej.
Elsevier Urban & Partner, Wrocław 2010, s. 195–221.
7. Hames B.D., Hooper N.M., Houghton J.D. Biochemia. Krótkie wykłady. Wydawnictwo Naukowe
PWN, Warszawa 2000, s. 91–106.
8. Hematologia kliniczna. Red. K. Janicki. PZWL, Warszawa 1991, T. 1, s. 103–127.
9. Stępień E. Fibrynoliza. Problemy kliniczne i diagnostyka. Badanie i diagnoza 2009; 15: s. 73–77.
10. Stryer L., Berg J.M., Tymoczko J.T. Biochemia. Wydawnictwo Naukowe PWN, Warszawa 2005,
s. 153–470.

11. MOCZ
Alina Ostałowska
11.1. Powstawanie moczu
Podstawową funkcją nerek jest zapewnienie homeostazy poprzez regulację objętości i składu
płynu pozakomórkowego i utrzymanie równowagi kwasowo-zasadowej oraz czynność wewnątrzwy-
dzielnicza (synteza erytropoetyny i reniny) i aktywacja witaminy D
3
.
Powstawanie moczu jest efektem filtracji krwi w kłębuszkach nerkowych, selektywnej resorpcji
zwrotnej i wydzielania substancji do kanalików nerkowych. Przesączanie osocza prowadzi do powsta-
nia moczu pierwotnego, którego skład zbliżony jest do składu osocza pozbawionego białek i elemen-
tów morfotycznych. W czasie przepływu moczu pierwotnego przez kanaliki nerkowe następuje jego
zagęszczenie na skutek zwrotnego wchłaniania wody, składników mineralnych, glukozy i aminokwa-
sów. Procesy zagęszczania moczu regulują:
− hormon antydiuretyczny,
− przedsionkowy czynnik natriuretyczny,
− układ renina–angiotensyna–aldosteron.
U zdrowego dorosłego człowieka powstaje od 1500 ml do 2500 ml moczu ostatecznego,
w skład którego wchodzą: woda, jony sodu i potasu, jony wodorowe, mocznik, kwas moczowy, bili-
rubina, zbędne produkty przemiany materii, toksyny, metabolity leków oraz substancje obecne we
krwi w stężeniu przewyższającym ich próg nerkowy. Mocz zdrowego człowieka może zawierać śla-
dowe ilości białek i elementów morfotycznych krwi.
Skąpomocz (łac. oliguria) oznacza wydalanie < 500 ml moczu na dobę. Przyczyną może być
ostra niewydolność nerek lub przewlekłe choroby miąższu nerkowego w fazie schyłkowej.
Bezmocz (łac. anuria) oznacza wydalanie < 100 ml moczu na dobę.
Wielomocz (łac. poliuria) oznacza wydalanie moczu w ilości sięgającej nawet do kilkunastu li-
trów na dobę. Może być objawem fazy wielomoczu w ostrej lub przewlekłej niewydolności nerek,
moczówki prostej pochodzenia podwzgórzowo-przysadkowego (niedobór wazopresyny) lub nerkowe-
go (niewrażliwość cewek nerkowych na wazopresynę), cukrzycy, hiperkalcemii i polidypsji psycho-
gennej.
11.2. Badanie ogólne moczu
Badanie ogólne moczu należy do podstawowych badań laboratoryjnych w diagnostyce chorób
nerek i dróg moczowych oraz w wykrywaniu chorób ogólnoustrojowych powodujących zmiany
w jego składzie. Badanie to obejmuje ocenę cech fizycznych, biochemicznych i morfologicznych
(osadu moczu po odwirowaniu). Zwykle jest wykonywane w próbce pierwszej lub drugiej porannej
porcji moczu. Powinno być wykonane nie później niż 2 godziny po pobraniu próbki. W moczu ozna-
cza się także różne substancje, takie jak hormony i leki.

11. Mocz
87
11.2.1. Własności fizyczne moczu
11.2.1.1. Barwa
Fizjologicznym barwnikiem moczu jest urochrom, dający żółte zabarwienie o różnych odcie-
niach, w zależności od stopnia zagęszczenia moczu.
W hematurii makroskopowej mocz przyjmuje barwę czerwonobrunatną lub kawową. Stwier-
dza się w nim obecność białka, a także dodatnią reakcję z odczynnikiem benzydynowym lub toluidy-
nowym (wymienione substancje ulegają utlenieniu w obecności krwinek czerwonych, hemoglobiny
i mioglobiny wykazujących właściwości peroksydazowe). W badaniu mikroskopowym obserwuje się
liczne erytrocyty. Po odwirowaniu mocz ma prawidłową barwę. Zabarwienie surowicy krwi jest nie-
zmienione.
W hemoglobinurii zabarwienie moczu może być takie jak w hematurii, ale nie zmienia się po
odwirowaniu. Ponadto stwierdza się białkomocz oraz dodatnią reakcję z odczynnikiem benzydyno-
wym lub toluidynowym. Natomiast w osadzie moczu zwykle nie występują erytrocyty, a surowica jest
różowa (cechy hemolizy).
W mioglobinurii zabarwienie moczu może być takie jak w hemoglobinurii i hematurii. Stwier-
dza się w nim obecność białka, dodatnią reakcję z odczynnikiem benzydynowym lub toluidynowym
oraz brak lub niewielką liczbę krwinek czerwonych w osadzie. Po odwirowaniu barwa moczu nie
zmienia się, a zabarwienie surowicy krwi jest prawidłowe. W przypadku obecności porfiryn mocz
przyjmuje barwę czerwoną, nasilającą się w świetle ultrafioletowym i nieulegającą zmianie po odwi-
rowaniu.
Czerwona barwa moczu uwarunkowana lekami (salicylany, metronidazol, ryfampicyna, fenyto-
ina, azatiopryna) oraz barwnikami egzogennymi (barwnik czerwonych buraków, papryki, czarnych
jagód) może ulec zmianie przy zmianie pH, natomiast pozostaje taka sama po jego odwirowaniu.
W moczu nie stwierdza się wtedy obecności białka ani krwinek czerwonych, a surowica krwi ma pra-
widłowe zabarwienie. Ponadto mocz daje ujemną reakcję z odczynnikiem benzydynowym.
11.2.1.2. Przejrzystość
Świeżo oddany mocz zdrowego człowieka jest przejrzysty. Dłużej przechowywany mętnieje, ze
względu na rozkład i precypitację zawartych w nim substancji, a także z powodu namnażania się bak-
terii. Zmętnienie moczu może być również spowodowane wytrącającymi się najczęściej kryształami
fosforanowymi lub moczanowymi, a w rzadszych przypadkach – wydzieliną gruczołu krokowego lub
ropomoczem.
11.2.1.3. Zapach
Mocz prawidłowy ma charakterystyczny zapach amoniaku, który pochodzi głównie z rozkładu
mocznika przez drobnoustroje ureazododatnie. Przyczyną odmiennego zapachu mogą być spożyte
pokarmy (np. szparagi), zaburzenia przemiany aminokwasowej (np. zapach mysiego moczu u chorych
na fenyloketonurię) i węglowodanowej (np. zapach acetonu świadczący o ketonurii), rozpadający się
nowotwór układu moczowego oraz obecność ropy w moczu.
11.2.1.4. Gęstość właściwa moczu (ciężar właściwy)
Gęstość właściwa prawidłowego moczu waha się w granicach 1,016–1,025 g/ml i zależy od stę-
żenia oraz masy składników w nim rozpuszczonych, a także od zdolności nerek do zagęszczania i roz-
cieńczania moczu. W warunkach fizjologicznych gęstość właściwa zależy głównie od zawartości
chlorku sodu i mocznika, a w znacznie mniejszym stopniu od zawartości innych elektrolitów, kreaty-
niny lub kwasu moczowego. Badania gęstości właściwej moczu dokonuje się za pomocą urometru lub
testów paskowych. W razie obecności białka lub glukozy gęstość właściwą moczu trzeba skorygować
o wartość wynikającą ze stężenia tych składników: każdy 1 mg/dl glukozy zwiększa ciężar właściwy
moczu o 0,004 g/ml, a każdy 1 mg/dl białka o 0,003 g/ml.
Upośledzone zagęszczanie moczu może być spowodowane upośledzeniem czynności miąższu
nerkowego, zaburzeniami elektrolitowymi (hiperkalcemia i hipokaliemia), niedoborem wazopresyny

Część III. Płyny biologiczne i gospodarka wodno-elektrolitowa ...
88
lub defektem receptora dla tego hormonu, niedoczynnością lub nadczynnością tarczycy oraz nadczyn-
nością kory nadnerczy. O upośledzeniu zagęszczania moczu świadczy izostenuria, czyli utrzymywanie
gęstości względnej około 1,010 g/ml. Gęstość właściwa moczu > 1,035 g/ml zawsze sugeruje obec-
ność w moczu niefizjologicznego składnika (glukozy, mannitolu, cieniującego środka radiologiczne-
go, etanolu).
11.2.1.5. Osmolalność
Parametr ten dokładnie ocenia stopień zagęszczenia moczu. Zależy od stopnia nawodnienia
organizmu. Może wahać się w szerokich granicach od 50 do 1200 mOsm/kg H
2
O. Wynik osmolalno-
ści nie zależy od obecności białka i innych substancji wielkocząsteczkowych.
11.2.1.6. Odczyn
Mocz prawidłowy jest lekko kwaśny, pH zwykle wynosi 5,0–6,0. Dieta bogatobiałkowa po-
woduje jego zakwaszenie, natomiast jarska alkalizację. W kwasicy, odwodnieniu organizmu, stanach
gorączkowych oraz po spożyciu niektórych leków pH moczu zmniejsza się. Alkaliczne pH częściej
występuje u dzieci. Może także świadczyć o zasadowicy, przewlekłej niewydolności nerek, kwasicy
kanalikowej (nerka wydziela wodorowęglany), stanach zapalnych miedniczek nerkowych lub pęche-
rza moczowego.
11.2.2. Własności chemiczne moczu
11.2.2.1. Mocznik
Jest to główny końcowy produkt przemiany azotu białkowego, powstający w wątrobie w proce-
sie urogenezy z amoniaku i ditlenku węgla. Jest całkowicie przesączany do moczu pierwotnego, z cze-
go około 40% ulega resorpcji zwrotnej. Wydalanie mocznika jest proporcjonalne do zawartości białka
w diecie oraz prędkości degradacji białek endogennych. Zwiększa się na skutek odwodnienia, obniże-
nia perfuzji nerkowej, w stanach wzmożonego katabolizmu białkowego (dieta wysokobiałkowa, utrata
masy mięśniowej, reabsorpcja białek po krwawieniu z przewodu pokarmowego, stany pooperacyjne,
gorączka, glukokortykoidoterapia, nadczynność tarczycy i przedawkowanie hormonów tarczycy).
Zmniejszenie wydalania mocznika z moczem świadczy o zaburzeniach funkcji nerek lub chorobach
wątroby.
11.2.2.2. Kreatynina
Związek ten powstaje w mięśniach szkieletowych na skutek nieodwracalnej dehydratacji kre-
atyny lub defosforylacji fosfokreatyny. Nie ulega resorpcji zwrotnej ani znaczącemu wydalaniu do
kanalików. Stężenie kreatyniny w moczu zależy przede wszystkim od masy mięśniowej, wieku oraz
płci chorego i jest nieco mniejsze u kobiet. Zmniejszenie ilości wydalanej kreatyniny z moczem naj-
częściej stanowi wynik ostrej lub przewlekłej niewydolności nerek. Dochodzi wtedy do wzrostu stę-
żenia kreatyniny w osoczu krwi.
11.2.2.3. Kwas moczowy
Jest końcowym produktem przemiany zasad purynowych. W 75% jest wydalany z moczem
w postaci wolnej lub soli sodowej. Trudno rozpuszczalny w wodzie, w pH kwaśnym może odkładać
się w stawach i nerkach, tworząc kamienie moczanowe. W pH zasadowym tworzy łatwo rozpuszczal-
ne moczany. Ilość wydalanego z moczem kwasu moczowego zależy głównie od endogennej biosynte-
zy i katabolizmu zasad purynowych, a w mniejszym stopniu od zawartości tych związków w pokar-
mach. Zmniejszenie wydalania kwasu moczowego może wynikać ze zmniejszonej podaży zasad pury-
nowych w pokarmach lub mniejszej purynogenezy (podawanie inhibitorów oksydazy ksantynowej),
natomiast wydalanie zwiększone może być spowodowane wzrostem podaży zasad purynowych
w pokarmach, wzmożoną endogenną biosyntezą (cukrzyca), zwiększonym katabolizmem zasad pury-
nowych (intensywna chemioterapia chorób nowotworowych), glukokortykoidoterapią, upośledzoną
resorpcją zwrotną kwasu moczowego w cewkach nerkowych (zespół Fanconiego, ciąża).

11. Mocz
89
11.2.2.4. Amoniak
Amoniak powstaje w organizmie z deaminacji aminokwasów, zasad purynowych i pirymidy-
nowych, a także podczas hydrolizy amidów. Innym jego źródłem są obecne w jelitach bakterie. Więk-
szość organizmów lądowych, w tym również człowiek, należą do organizmów ureotelicznych i prze-
kształcają amoniak w rozpuszczalny w wodzie mocznik. Wydalanie amoniaku z moczem rośnie w me-
tabolicznej kwasicy, a maleje w metabolicznej alkalozie.
11.2.2.5. Barwniki moczu
Barwnikami moczu są urochromy, urobilinogen i urobilina. Bilirubina nie występuje w moczu
w warunkach prawidłowych, jej obecność sugeruje uszkodzenie wątroby lub zablokowanie odpływu
żółci z przewodu żółciowego. Urobilinogen powstaje w czasie przemian bilirubiny w przewodzie po-
karmowym przy udziale enzymów bakteryjnych i jest wydalany z kałem. W moczu prawidłowym
znajduje się tylko niewielka ilość urobilinogenu. Jego obecność może świadczyć o chorobie wątroby
(marskość, zapalenie) lub utrudnionym odpływie żółci z wątroby i pęcherzyka żółciowego.
Inne składniki moczu to fenole, hormony steroidowe i niektóre leki oraz kwas szczawiowy.
11.3. Składniki patologiczne moczu
11.3.1. Białka
Dobowe wydalanie białka z moczem przez zdrowe nerki nie przekracza 250 mg. Jedynie u ko-
biet w okresie ciąży wartość ta może wzrastać do 300 mg/dobę. Białko w moczu to głównie albumina
i niskocząsteczkowe peptydy filtrowane w kłębuszkach nerkowych. Zwiększone wydalanie białek
z moczem (białkomocz) może być fizjologicznym zjawiskiem przejściowym, np. białkomocz ortosta-
tyczny (po przebywaniu przez dłuższy czas w pozycji pionowej), białkomocz związany z wysiłkiem
fizycznym, kąpielą w zimnej wodzie, gorączką lub stresem.
Przyczyny białkomoczu mogą być:
− przednerkowe – mioglobina, hemoglobina, łańcuchy lekkie lub ciężkie immunoglobulin,
− nerkowe – uszkodzenie strukturalne lub czynnościowe kłębuszków lub cewek nerkowych,
− zanerkowe – stany zapalne dróg moczowych, wydzielanie białka Tamma i Horsfalla przez cewki
dystalne.
Dobowy białkomocz może być:
− znikomy – wydalanie < 0,5 g,
− mierny – wydalanie < 3,5 g,
− znaczny – wydalanie > 3,5 g.
Mikroalbuminuria, czyli wydalanie z moczem małych ilości albumin (30–300 mg/dobę), jest
wczesnym i czułym markerem uszkodzenia nerek oraz przyspiesza progresję niewydolności nerek,
zwłaszcza u chorych z cukrzycą i nadciśnieniem tętniczym.
11.3.2. Cukry redukujące
Prawidłowy mocz zawiera tylko śladowe ilości glukozy niewykrywalne rutynowymi metodami
paskowymi. Po osiągnięciu tzw. progowego stężenia we krwi, tj. 160–180 mg/dl (9–10 mmol/l), glu-
koza pojawia się w moczu (glukozuria).
Glukozuria może być pochodzenia cewkowego (glikemia jest prawidłowa) lub cukrzycowego
(glukozuria współwystępuje z hiperglikemią).
W moczu mogą pojawić się również inne cukry redukujące, np. fruktoza (po spożyciu dużych
ilości owoców i miodu), galaktoza (w przypadkach zaburzeń przewodu pokarmowego i uszkodzenia
wątroby), laktoza (u kobiet karmiących).
11.3.3. Ciała ketonowe
Do ciał ketonowych należą aceton, kwas acetooctowy i kwas β-hydroksymasłowy. Ich obecność
w moczu (ketonuria) najczęściej towarzyszy zaburzeniom gospodarki węglowodanowej i lipidowej,

Część III. Płyny biologiczne i gospodarka wodno-elektrolitowa ...
90
np. w przebiegu niewyrównanej cukrzycy, podczas głodówki, w następstwie długotrwałych wymiotów
i biegunek, u osób niedożywionych lub stosujących dietę ubogowęglowodanową i bogatotłuszczową.
11.3.4. Bilirubina
W moczu fizjologicznym nie stwierdza się obecności bilirubiny. We krwi występuje ona głów-
nie w połączeniu z albuminą i w tej postaci nie przesącza się przez kłębki nerkowe. W wątrobie ulega
sprzęganiu z kwasem glukuronowym i jako glukuronian jest wydalana poprzez drogi żółciowe do
przewodu pokarmowego. We krwi stężenie bilirubiny sprzężonej jest niewielkie i znacznie zwiększa
się w wyniku niedrożności dróg żółciowych (żółtaczka zastoinowa) i w uszkodzeniu wątroby (np. wi-
rusowe zapalenie wątroby, marskość wątroby, przerzuty nowotworowe do wątroby). Sprzężona biliru-
bina ulega przesączaniu w kłębkach nerkowych i wydaleniu z moczem.
11.3.5. Urobilinogen
Związek ten powstaje z bilirubiny w przewodzie pokarmowym pod wpływem flory bakteryjnej
i jest składnikiem moczu (do 4 mg/dobę). Zwiększone wydalanie urobilinogenu z moczem towarzyszy
niedokrwistości hemolitycznej, miąższowym chorobom wątroby bez cholestazy, nadprodukcji urobili-
nogenu (zaparcia, niedrożność lub zapalenie jelit). Zmniejszone wydalanie świadczy o cholestazie
i/lub utrudnionym odpływie żółci do dwunastnicy, natomiast brak wydalania oznacza całkowity brak
flory bakteryjnej jelit, np. u noworodków i po intensywnej antybiotykoterapii.
11.3.6. Hemoglobina
Hemoglobina może występować w moczu razem z erytrocytami (jest z nich uwalniana), wtedy
w osadzie stwierdza się cienie krwinek czerwonych, tzw. erytrocyty wyługowane. Najczęściej jednak
wolną hemoglobinę (hemoglobinuria) obserwuje się w moczu na skutek zachodzącej w naczyniach
krwionośnych hemolizy krwinek czerwonych. Dzieje się tak po znacznym wysiłku fizycznym, wy-
chłodzeniu organizmu, przetoczeniu niezgodnej grupowo krwi, w rozległych oparzeniach i zatruciach
środkami uszkadzającymi erytrocyty (sulfonamidy, fenylohydrazyna), a także po rozległych zawałach
mięśnia sercowego. Wolna hemoglobina pojawia się w moczu po przekroczeniu stężenia w osoczu
80 mg/dl. Mocz zawierający wolną hemoglobinę ma barwę czerwoną i w osadzie nie stwierdza się
krwinek czerwonych (patrz pkt 11.2.1.1. Barwa).
11.3.7. Lipidy
Lipidy są obecne w moczu, jeżeli lipoproteiny osocza przedostaną się przez uszkodzoną błonę
filtracyjną. Lipiduria jest częstym zjawiskiem w przypadku nasilonego białkomoczu, np. w zespole
nerczycowym. Są wykrywane jako krople tłuszczu, wałeczki tłuszczowe lub kryształy cholesterolu.
11.4. Osad moczu
11.4.1. Krwinkomocz i krwiomocz
Prawidłowe dobowe wydalanie erytrocytów z moczem nie przekracza 3 mln (odpowiada to 3–
–4 erytrocytom w polu widzenia przy oglądaniu osadu moczu pod mikroskopem w powiększeniu
400 x). Pojawienie się większej ilości erytrocytów nazywamy krwinkomoczem, w przypadku bardzo
dużej ich ilości mówimy o krwiomoczu. Ich przyczynami są stany zapalne układu moczowego, w tym
gruźlica i kłębuszkowe zapalenie nerek, kamica moczowa, nowotwory nerek, pęcherza i gruczołu kro-
kowego oraz urazy tych narządów.
11.4.2. Leukocyturia
Prawidłowe dobowe wydalanie leukocytów z moczem nie przekracza 3 mln. Wynik testów pa-
skowych jest dodatni przy obecności 4–5 leukocytów w polu widzenia w badaniu mikroskopowym.
Leukocyturia najczęściej świadczy o zapaleniu dróg moczowych wywołanych przez bakterie, wirusy,
grzyby lub pasożyty. Obecność eozynofilów bywa objawem alergicznego śródmiąższowego zapalenia
nerek. Zwiększona liczba leukocytów może być także następstwem m.in. dużego wysiłku fizycznego,
gorączki oraz niewydolności krążenia.

11. Mocz
91
11.4.3. Wałeczkomocz
Wałeczki są białkowymi odlewami kanalików nerkowych lub cewek zbiorczych. Powstają
w wyniku żelowania białka Tamma-Horsfalla w świetle cewek dystalnych. W białkowym żelu uwię-
zione zostają elementy morfotyczne znajdujące się w tym czasie w świetle cewek nerkowych, m.in.
erytrocyty, leukocyty, komórki nabłonkowe i kryształy.
Typy wałeczków:
− szkliste – nie mają znaczenia diagnostycznego,
− ziarniste – zawierają drobno- i gruboziarniste elementy komórkowe, ich obecność wskazuje na
uszkodzenie miąższu nerkowego,
− leukocytowe – w swoim składzie mają leukocyty, występują często u chorych z odmiedniczkowym
zapaleniem nerek,
− erytrocytowe – posiadają niezmienione erytrocyty lub ich fragmenty, wałeczki takie mogą wskazy-
wać na zapalenie kłębuszków nerkowych,
− nabłonkowe – zawierają w macierzy wałeczkowej komórki cewek nerkowych, co może wskazywać
na ich uszkodzenie.
P i ś m i e n n i c t w o
1. Choroby wewnętrzne. Red. A. Szczeklik, t. 1, Medycyna Praktyczna, Kraków 2005.
2. Ćwiczenia praktyczne z biochemii. Skrypt dla studentów II roku Wydziału Lekarskiego z Oddziałem
Lekarsko-Dentystycznym. Red. E. Birkner. Wydawnictwo SUM, Katowice 2008, s. 78–82.
3. Diagnostyka laboratoryjna z elementami biochemii klinicznej. Red. Dembińska-Kieć A., Naskalski
J. Elsevier Urban & Partner, Wrocław 2010.
4. Kokot F, Kokot S. Badanie laboratoryjne – zakres norm i interpretacja, wyd. III uaktualnione, Wy-
dawnictwo Lekarskie PZWL, Warszawa 1998.
5. Kokot S. Interpretacja ważniejszych wyników badań biochemicznych surowicy krwi i moczu. [w:]
Diagnostyka różnicowa objawów chorobowych, wyd. II, Wydawnictwo Lekarskie PZWL, Warsza-
wa 1998.

12. GOSPODARKA WODNO-ELEKTROLITOWA
Urszula Błaszczyk, Jolanta Zalejska-Fiolka
12.1. Gospodarka wodna organizmu
Woda jest najlepszym rozpuszczalnikiem dla związków nieorganicznych i organicznych typu
hydrofilowego. Umożliwia ona w organizmie transport substancji odżywczych, biokatalizatorów
i produktów przemiany materii oraz przenoszenie energii cieplnej i regulację temperatury ciała. Woda
jest również niezbędna do działania enzymów; przy odwodnieniu ich właściwości katalityczne ulegają
zahamowaniu. Zarówno ciśnienie osmotyczne, jak i onkotyczne jest zależne od obecności wody. Ciś-
nienie onkotyczne (rodzaj ciśnienia osmotycznego powodowanego przez białka obecne w osoczu
krwi) równoważy ciśnienie krwi w naczyniach krwionośnych, dzięki czemu nie dochodzi do utraty
wody z naczyń. W stanach chorobowych, w których następuje obniżenie stężenia białek w osoczu (np.
przy białkomoczu lub niedożywieniu), zmniejszone ciśnienie onkotyczne prowadzić może do powsta-
nia obrzęku.
Zawartość wody w organizmie jest zależna od stężenia elektrolitów, wodochłonności koloidów
oraz obecności adenozynotrifosforanu (ATP). Mitochondria np. cechuje stała zawartość wody (około
20%), a przy braku ATP pęcznieją i zwiększają ilość wody o 15%. Ważny jest również wpływ pH,
gdyż przy zakwaszeniu zwiększa się wodochłonność tkanek.
Wpływ na gospodarkę wodną wywierają również układy nerwowy i wydzielania wewnętrzne-
go. Podrażnienie nerwów współczulnych zmniejsza wydalanie wody, drażnienie nerwów przywspół-
czulnych zwiększa jej wydalanie. Tarczyca natomiast poprzez działanie tyroksyny zwiększa wymianę
wodną. Hormon przytarczycy sprzyja odwodnieniu. Adrenalina, hormon wydzielany przez część
rdzenną nadnerczy, początkowo zmniejsza, a następnie zwiększa wydalanie wody. Niedoczynność
kory nadnerczy powoduje nadmierne jej wydalanie. Ilość wody przyjmowanej przez organizm jest
mniejsza od ilości wydalanej, co wiąże się z powstawaniem jej cząsteczek podczas utleniania komór-
kowego. Największa ilość wody wydalana jest przez nerki (32–52%), następnie przez skórę (około
26%) i płuca (około 20%), a najmniejsza przez przewód pokarmowy (4–20%).
Im szybsza przemiana materii i energii, tym większe zapotrzebowanie organizmu na wodę.
Ilość wody u noworodków dochodzi do 80%, u dorosłych wynosi 60–70% masy ciała. W pierwszych
dniach życia oraz w okresie młodocianym organizm wykazuje zwiększone zapotrzebowanie na wodę.
Osesek potrzebuje około 140 g wody/kg masy ciała na dobę, podczas gdy człowiek dorosły – zaledwie
35 g/kg. Ujemny bilans wodny występuje w stanach patologicznych, np. przy uporczywych wymio-
tach, biegunkach i w moczówce. Odwodnienie organizmu powyżej 20% powoduje śmierć.
12.2. Gospodarka elektrolitowa
Płyny biologiczne (płyn wewnątrzkomórkowy, międzykomórkowy i płyny zewnątrzkomórko-
we, jak np. osocze, chłonka, płyn mózgowo-rdzeniowy) zawierają oprócz związków organicznych
również nieorganiczne aniony i kationy. W zależności od ich stężenia dzielimy je na właściwe skład-
niki mineralne i pierwiastki śladowe – mikroelementy. Do pierwszej grupy zaliczamy kationy: sodowy
(Na
+
), potasowy (K
+
), wapniowy (Ca
2+
), magnezowy (Mg
2+
) i wodorowy (H
+
) oraz aniony: chlorkowy
(Cl
–
), wodorowęglanowy (HCO
3
–
) i fosforanowy (PO
4
3–
). Pierwiastki śladowe to: jod, mangan, kobalt,
cynk, molibden, selen, chrom, a także żelazo i miedź.

12. Gospodarka wodno-elektrolitowa
93
12.2.1. Sód i potas
Jon sodowy jest kationem pozakomórkowym, a jon potasowy kationem wewnątrzkomórkowym.
Różne rozmieszczenie tych elektrolitów dokonuje się dzięki ATP-azie sodowo-potasowej z błon ko-
mórkowych, zwanej pompą sodowo-potasową. Jon sodowy jest głównym kationem odpowiedzialnym
za ciśnienie osmotyczne w płynach ustrojowych. Hormony kory nadnercza wzmagają resorpcję
zwrotną jonów sodowych w kanalikach nerkowych i ułatwiają wydalanie jonów potasowych. Ich nie-
dobór prowadzi do ucieczki jonów sodowych z organizmu i zatrzymania jonów potasowych.
Hiponatriemia, czyli zmniejszenie stężenia Na
+
w surowicy, może występować przy prawi-
dłowej zawartości jonów sodowych, ale po zbyt obfitym nawodnieniu, a także w hiperlipemii, hiper-
proteinemii i hiperglikemii.
Hipernatriemię (zwiększenie stężenia Na
+
w surowicy) stwierdza się w stanach przebiegają-
cych z hipertonicznym zagęszczeniem krwi spowodowanym niedostatecznym dowozem wody lub jej
utratą przez skórę (poty), płuca, nerki (moczówka prosta, złe zagęszczanie moczu, zapalenie miedni-
czek nerkowych) oraz jelita (biegunki).
Potas ustrojowy w 98% występuje wewnątrzkomórkowo. Najwięcej stwierdza się go w komór-
kach wykazujących aktywną przemianę cukrów.
Hiperkaliemia (zwiększenie stężenia K
+
we krwi) występuje w niewydolności nadnerczy, nie-
wydolności nerek połączonej z bezmoczem, a zwłaszcza w przypadkach zmiażdżenia mięśni, po opa-
rzeniach, gdy dochodzi do uwolnienia jonów potasowych z dużej masy tkanek i komórek. Hiperka-
liemię obserwuje się w stanach hemolitycznych, w śpiączce cukrzycowej i wątrobowej (przemiesz-
czanie jonów potasowych z komórek do płynów ustrojowych), po wlewach soli potasu, przy nadmier-
nym rozpadzie białek i glikogenu. Hiperkaliemia połączona jest zwykle z kwasicą metaboliczną. To-
warzyszą jej zaburzenia rytmu serca, a w końcu blok serca.
Hipokaliemię (zmniejszenie stężenia K
+
we krwi) stwierdza się w okresie wzrostu i regeneracji,
po podaniu insuliny i testosteronu, po dłuższym stosowaniu leków moczopędnych, w chronicznym
zapaleniu miedniczek i kłębków nerkowych, w wyniku upośledzonego wchłaniania z przewodu po-
karmowego (po środkach przeczyszczających, w zwężeniu odźwiernika), na skutek zwiększonej utraty
płynów (biegunki, w guzach trzustki lub okrężnicy). Hipokaliemia połączona jest z adynamią mię-
śniową, osłabieniem, zaparciami, a nawet atonią jelit. Towarzyszą jej metaboliczna zasadowica, poli-
uria oraz zaburzenia rytmu serca.
12.2.2. Wapń
Wapń w postaci fosforanu jest głównym składnikiem budulcowym kości i zębów. Jon wapnio-
wy odpowiada za prawidłową pobudliwość nerwową, jest niezbędny w procesie skurczu mięśniowe-
go, uszczelnia naczynia i błony komórkowe, bierze udział w procesie krzepnięcia krwi. Wapń osocza
składa się z 3 frakcji: wapnia związanego z białkami, wapnia związanego z cytrynianem, fosforanem
i siarczanem oraz wapnia zjonizowanego. Dwie ostatnie frakcje odpowiadają wapniowi dializującemu,
co stanowi około 52%. Wapń związany z białkami to wapń niedializujący. Między kośćmi, krwią
i płynem śródkomórkowym zachodzi wymiana wapnia, lecz tylko wapń zjonizowany reguluje sekrecję
hormonów z przytarczyc i komórek C gruczołu tarczowego. Wchłanianie jonów wapniowych z prze-
wodu pokarmowego zależy od witaminy D.
Hiperkalcemia (zwiększenie stężenia Ca
2+
we krwi) występuje w nadczynności przytarczyc
i po przedawkowaniu witaminy D oraz wskutek wzrostu stężenia cAMP. Stężenie jonów wapniowych
we krwi wzrasta w nowotworach kości, sarkoidozie oraz hipofosfatazji.
Hipokalcemia (zmniejszenie stężenia Ca
2+
we krwi) występuje w niedoczynności przytarczyc,
przy upośledzonym wchłanianiu z przewodu pokarmowego, w chorobach trzustki, żółtaczce zastoino-
wej, głodzie i hemodializie. Zmniejszenie stężenia jonów wapniowych stwierdza się po lekach moczo-
pędnych, po inhibitorach cyklazy adenylowej, przy obniżeniu stężenia cAMP. Zmniejszenie stężenia
wapnia dotyczy wyłącznie wapnia zjonizowanego. Przy obniżeniu jego stężenia do około 6 mg/dl
pojawia się tężyczka. Leki hamujące uwalnianie jonów wapniowych do cytoplazmy działają rozluź-
niająco i przeciwskurczowo.
Część III. Płyny biologiczne i gospodarka wodno-elektrolitowa ...
94
12.2.3. Magnez
Magnez jest aktywatorem wielu enzymów komórkowych (fosfataz, ATP-az, enzymów glikoli-
zy, enzymów biorących udział w przemianach nukleotydów i kwasów nukleinowych). Pierwiastek ten
wykazuje antagonistyczne działanie w stosunku do wapnia. Stężenie jonów Mg
2+
w płynie pozako-
mórkowym wpływa na pobudliwość i reakcję nerwowo-mięśniową. Obniżeniu stężenia jonów magne-
zu w surowicy towarzyszy tężyczka, ogólne osłabienie, zaburzenia orientacji i senność.
12.3. Równowaga kwasowo-zasadowa krwi
Gospodarka kwasowo-zasadowa zależy w dużej mierze od ciśnienia cząsteczkowego ditlenku
węgla CO
2
oraz od stężenia jonów wodorowych pochodzących z nielotnych zasad. Wydalanie CO
2
dokonuje się poprzez płuca; jony wodorowe są wydalane przez nerki. Oba te metabolity, powstające
w wyniku procesów przemiany materii, powiązane są ze sobą przez wspólny układ buforowy. Stęże-
nie jonów wodorowych we krwi tętniczej, w temp. 37ºC, waha się w granicach wartości pH 7,35–7,45,
natomiast we krwi żylnej jest nieco mniejsze (o około 0,05). Organizm ma znaczne możliwości kom-
pensacji zaburzeń równowagi kwasowo-zasadowej, stąd nawet w stanach niewyrównanych, zmiany
pH krwi na ogół nie są znaczne. Jest to istotne ze względu na fakt, że przesunięcia pH poniżej 7,0
i powyżej 7,7 mogą stanowić bezpośrednie zagrożenie życia. Pomiaru pH dokonuje się potencjome-
trycznie, z użyciem mikroelektrody szklanej wbudowanej w układ pomiarowy analizatorów równo-
wagi kwasowo-zasadowej. Wykonując równocześnie pomiar prężności CO
2
, można wyliczyć pozosta-
łe parametry do oceny równowagi kwasowo-zasadowej: stężenie wodorowęglanów (HCO
3
–
), prężność
tlenu (pO
2
) oraz NZ – nadmiar lub niedobór zasad).
Tabela VI. Prawidłowe wartości gospodarki kwasowo-zasadowej krwi
pCO
2
HCO
3
–
NZ
pO
2
pH
kPa
mmHg
mmol/l
mmol/l
kPa
mmHg
7,35–7,45
4,8–6,0
36–45
21–26
± 2,5
8,7–2,7
65–95
12.4. Zaburzenia gospodarki kwasowo-zasadowej
12.4.1. Kwasice metaboliczne
Zaburzeniem pierwotnym jest zwiększenie ilości nielotnych kwasów w organizmie. Prowadzi to
do spadku wartości wodorowęglanów oraz niedoboru albo utraty zasad. Następstwem jest spadek war-
tości pH. Kompensacyjna hiperwentylacja, prowadząc do zwiększonego wydychania CO
2
, może spo-
wodować spadek pCO
2
. Całkowita kompensacja zachodzi wówczas, gdy pH osiąga wartości prawi-
dłowe. Zależnie od przyczyn kwasice dzielą się na:
− kwasice z nadmiernej podaży/wytwarzania: kwasica ketonowa (cukrzyca, głód); kwasica mle-
czanowa (uogólnione lub miejscowe niedotlenienie, wstrząs kardiogenny lub krwotoczny, zatrucie
tlenkiem węgla lub cyjankami, oparzenie, ciężki wysiłek fizyczny, toksyny bakteryjne – posoczni-
ca); inne kwasice z nadmiernego wytwarzania (zatrucia metanolem lub glikolem etylenowym),
− kwasice z utraty: jelitowa utrata HCO
3
–
(biegunka, przetoka trzustkowa, przetoka żółciowa),
− kwasice dystrybucyjne: hiperkaliemia, nadmiar podanego chlorku potasu,
− kwasice z zatrzymania: przewlekłe odmiedniczkowe zapalenie nerek, przewlekłe kłębuszkowe za-
palenie nerek, ostra niewydolność nerek, szpiczak mnogi.
kPa)
w
(
pCO
•
225
,
0
]
[HCO
2
3
pH = 6,11+ log

12. Gospodarka wodno-elektrolitowa
95
12.4.2. Zasadowice metaboliczne
Zaburzeniem pierwotnym jest nadmiar HCO
3
–
, co powoduje wzrost wartości pH. W wyniku
działania kompensacyjnego i hiperwentylacji może dojść do wzrostu pCO
2
. Ze względu na przyczyny
zasadowice dzielą się na:
− zasadowice z nadmiernej podaży/nadmiernego wytwarzania: nadmiar podanego NaHCO
3
, leki
zobojętniające, cytrynian, mleczan,
− zasadowice z utraty: alkaloza z utraty soku żołądkowego (wymioty, drenaż), leki moczopędne
(tiazydy, furosemid), działanie mineralokortykosteroidów (pierwotny i wtórny hiperaldosteronizm,
zespół Cushinga, leczenie kortykosteroidami),
− zasadowice dystrybucyjne: hipokaliemia.
12.4.3. Kwasice oddechowe
Zaburzeniem pierwotnym jest wzrost pCO
2
(hiperkapnia), przez co dochodzi do zmniejszenia
wartości pH. Kompensacyjnie nerki mogą zmniejszyć wydalanie wodorowęglanów. Przyczyny kwasi-
cy oddechowej:
− ośrodkowy układ nerwowy: guzy mózgu, zapalenie mózgu, narkotyki, uraz czaszkowo-mózgowy,
− nerwy obwodowe: porażenie nerwu przeponowego,
− mięśnie: miastenia, środki zwiotczające mięśnie, uraz operacyjny,
− klatka piersiowa: deformacje klatki piersiowej, złamanie wielu żeber,
− choroby oskrzeli i płuc: aspiracja ciała obcego, astma oskrzelowa, przewlekła obturacyjna choroba
płuc, rozległe zapalenie płuc, obrzęk płuc.
12.4.4. Zasadowice oddechowe
Zaburzeniem pierwotnym jest zmniejszenie pCO
2
, co prowadzi do zwiększenia wartości pH.
Kompensacja tego zaburzenia zachodzi poprzez wzrost wydalania HCO
3
–
przez nerki. Czynnikami,
które mogą wywoływać zasadowice oddechowe, są:
− hiperwentylacja psychogenna (często),
− podrażnienie ośrodka oddechowego: zapalenie mózgu, zapalenie opon mózgowo-rdzeniowych,
uraz czaszkowo-mózgowy, leki (salicylany, teofilina), przyczyny hormonalne (progesteron, ciąża),
marskość wątroby, wstrząs septyczny,
− odruchowe podrażnienie ośrodka oddechowego przy hipoksemii: zwłóknienie płuc, zastój płuc-
ny przy niewydolności lewokomorowej, zator płucny, przebywanie na wysokościach, działanie
zimna,
− czynniki jatrogenne: oddech mechaniczny.
12.4.5. Wodorowęglany
Stężenie HCO
3
–
we krwi tętniczej wzrasta w zasadowicach metabolicznych (wzrost pH krwi
wskutek wymiotów lub niedoboru jonów K
+
) i kwasicach oddechowych (uwarunkowanych wzrostem
pCO
2
krwi spowodowanym rozedmą płuc, uszkodzeniem warstwy surfaktantu pęcherzyków płucnych,
niewydolnością krążenia przebiegającą z zastojem w płucach). Stężenie HCO
3
–
wyraźnie zmniejsza
się (nawet poniżej 10 mmol/l) w kwasicach metabolicznych.
12.4.6. Chlorki
Jon chlorkowy jest głównym nieorganicznym anionem płynu pozakomórkowego, bierze udział
w utrzymaniu prawidłowego ciśnienia osmotycznego oraz w gospodarce wodno-elektrolitowej. W ko-
mórkach okładzinowych żołądka wykorzystywany jest do wytwarzania HCl. W krwinkach czerwo-
nych wymienia się z jonem HCO
3
–
.
12.4.7. Fosforany
Fosfor odgrywa ważną rolę w procesach metabolicznych. W wiązaniu fosforanowym ATP
i ADP magazynuje się energia. Wiele substancji ulega aktywacji poprzez połączenie z resztą kwasu
fosforowego. Fosfor zawarty jest w niektórych lipidach, kwasach nukleinowych, a także w niektórych

Część III. Płyny biologiczne i gospodarka wodno-elektrolitowa ...
96
białkach i enzymach. Nerka wykorzystuje jon fosforanowy do utrzymania równowagi kwasowo-za-
sadowej. Fosforany I- i II-rzędowe wchodzą w skład układu buforowego krwi i moczu, natomiast III-
-rzędowe stanowią składnik budulcowy kości i zębów. Na stężenie fosforu nieorganicznego w surowi-
cy krwi mają wpływ: parathormon (PTH), witamina D, wchłanianie fosforanów w jelitach, czynność
wydalnicza nerek, przemiana kostna i żywienie.
12.5. Pierwiastki występujące we krwi w ilościach mikrogramowych
12.5.1. Żelazo
Oprócz żelaza hemoglobiny (około 60%) i enzymów hemoproteinowych (około 16%) część że-
laza jest magazynowana w ferrytynie (około 15%) i mioglobinie (około 8%). W osoczu występuje
białko transportujące żelazo – transferyna (około 0,1%), należące do frakcji beta-globulin. Wolne jony
żelazowe praktycznie nie występują. Transferyna doprowadza żelazo wchłonięte z przewodu pokar-
mowego oraz uwolnione podczas rozpadu hemoglobiny do miejsc, w których zachodzi biosynteza
hemu lub w których żelazo jest magazynowane w cząsteczkach ferrytyny. Ferrytyna składa się z 24
podjednostek białkowych, z których każda ma po jednym jonie żelazowym.
12.5.2. Miedź
Dzienne zapotrzebowanie wynosi 2 mg Cu/24 h. Miedź jest składnikiem wielu enzymów (tyro-
zynaza, dehydrataza kwasu deltaaminolewulinowego, monoaminooksydaza). W surowicy krwi miedź
związana jest z białkiem – ceruloplazminą, należącą do frakcji alfa2-globulin. Mało wiadomo na temat
regulacji wchłaniania miedzi. Wydalanie odbywa się przez wątrobę z żółcią. Niedobory miedzi
stwierdza się rzadko, dotyczą one głównie chorych żywionych przewlekle drogą pozajelitową. Wro-
dzony niedobór błonowego przenośnika miedzi zależnego od ATP (zwany zespołem Menkesa) cechu-
je się spowolnieniem wzrostu, niedorozwojem umysłowym, demineralizacją kości i łamliwością wło-
sów. Innym, niezwykle rzadko występującym wrodzonym defektem przenośnika miedzi, jest choroba
Wilsona (zwyrodnienie wątrobowo-soczewkowe). Dochodzi wówczas do akumulacji Cu w wątrobie
i w mózgu, co daje objawy dysfunkcji wątroby i objawy neurologiczne.
12.6. Pierwiastki śladowe
Zalicza się do nich:
− Jod – wykorzystywany jest przez gruczoł tarczycowy do tworzenia tyroksyny.
− Mangan – aktywator arginazy, karboksylazy pirogronianowej i dysmutazy ponadtlenkowej. Jest
niezbędny do prawidłowej funkcji ośrodkowego układu nerwowego i formowania właściwej struk-
tury kości. W większości przypadków funkcje manganu może przejąć magnez. Nadmiar tego pier-
wiastka jest neurotoksyczny i wywołuje objawy choroby Parkinsona.
− Kobalt – jest składnikiem witaminy B
12
– koenzymu mutazy metylomalonylo–CoA, metylotransfe-
razy THFA i reduktazy rybonukleotydów. Niedobór tej witaminy staje się przyczyną niedokrwisto-
ści złośliwej.
− Cynk – wchodzi w skład wielu enzymów, m.in. anhydrazy węglanowej, fosfatazy zasadowej,
dysmutazy ponadtlenkowej, dehydrogenazy alkoholowej, reduktazy retinenu. Insulina jest magazy-
nowana w trzustce w formie kompleksów z cynkiem. Niedobór Zn upośledza proces gojenia się ran,
powoduje zmiany skórne oraz objawy neuropsychiatryczne, m.in. zaburzenia poczucia smaku. Nie-
dobór u dzieci objawia się spowolnieniem wzrostu, zanikiem jąder i opóźnionym rozwojem płcio-
wym.
− Molibden – wiąże się z niektórymi flawoproteinami (oksydaza ksantynowa).
− Selen – w postaci selenocysteiny wchodzi w skład peroksydazy glutationowej, uczestniczy w synte-
zie ATP w mitochondriach. Niedobór Se jest przyczyną uszkodzenia mięśnia sercowego (kardiopa-
tii endemicznej).
− Chrom – uczestniczy w metabolizmie glukozy poprzez ułatwianie oddziaływania insuliny na ko-
mórkę docelową.

12. Gospodarka wodno-elektrolitowa
97
P i ś m i e n n i c t w o
1. Biochemia kliniczna. Red. S. Angielski, J. Rogulski. PZWL, Warszawa 1991, s. 467–638.
2. Diagnostyka laboratoryjna. B. Neumeister, I. Besenthal, H. Liebich. Wydawnictwo Medyczne
Urban & Partner, Wrocław, 2001, s. 160–214.
3. Diagnostyka laboratoryjna z elementami biochemii klinicznej. Red. A. Dembińska-Kieć, J. Naskal-
ski. Wydawnictwo Medyczne Urban & Partner, Wrocław 2002, s. 221–238.

13. ENZYMY
Jolanta Zalejska-Fiolka, Urszula Błaszczyk
13.1. Budowa i rola enzymów
Enzymy są białkami zaliczanymi do grupy katalizatorów biologicznych. Biorąc udział w danej
reakcji biologicznej przyspieszają jej bieg nie zużywając się przy tym. Istotą przyspieszania przez
enzymy szybkości przebiegu katalizowanej reakcji jest ich zdolność do obniżania energii aktywacji.
Warunkiem zajścia reakcji katalizy jest powstanie kompleksu enzym–substrat. Substrat przyłącza się
do enzymu w tzw. miejscu/centrum aktywnym. Jest ono układem przestrzennym i zajmuje niewielką
część całej cząsteczki enzymu. Zagłębienia lub szczeliny są zazwyczaj niedostępne dla cząsteczek
wody (jeśli nie bierze ona udziału w reakcji), a w tworzeniu kompleksu enzym–substrat uczestniczą
głównie słabe wiązania niekowalencyjne o niskiej energii 12–50 kJ/mol. Centrum aktywne zbudowane
jest z trzech rodzajów aminokwasów. Najważniejsze to tzw. aminokwasy kontaktowe, które w tzw.
centrum aktywnym bezpośrednio łączą się z substratem. Są to najczęściej aminokwasy z polarnymi
grupami bocznymi, np. cysteina z grupą –SH, seryna z grupą –OH, kwas glutaminowy z grupą
–COOH, lizyna z grupą –NH
2
czy histydyna z pierścieniem imidazolowym. Wymienione grupy mają
za zadanie wiązanie grup funkcyjnych substratu podlegającego przemianie, a także przetrzymanie go
w momencie reakcji w ściśle określonym położeniu przestrzennym.
Kolejną grupą aminokwasów występujących w centrum aktywnym są aminokwasy pomocni-
cze, utrzymujące substrat w centrum aktywnym poprzez tworzenie wiązań jonowych, oraz amino-
kwasy współdziałające nadające centrum aktywnemu odpowiednią konformację.
Enzymy są wysoko swoiste, co oznacza, że każdy katalizuje najczęściej tylko jedną reakcję,
czyli jest swoisty dla jednego substratu lub grupy substratów podobnych chemicznie.
Na szybkość reakcji enzymatycznej wpływa wiele czynników. Zalicza się do nich: temperaturę,
pH, siłę jonową, stężenie substratu, stężenie produktu, aktywatory i inhibitory.
Wpływ temperatury – szybkość reakcji enzymatycznych (w pewnym przedziale temperatur)
wzrasta wprost proporcjonalnie do wzrostu temperatury. Dla człowieka za graniczną przyjmuje się
temperaturę 42ºC. Po jej przekroczeniu szybkość reakcji gwałtownie maleje z uwagi na denaturację
enzymu. Na ogół wzrost temperatury o 10ºC podwaja szybkość reakcji.
Wpływ pH – każdy enzym ma optymalne do działania pH, w zakresie którego szybkość reakcji
enzymatycznej jest największa. Przykładem może być pepsyna (1–2), amylaza ślinowa (6–7) lub
trypsyna, chymotrypsyna (8–9).
Siła jonowa – wpływa przede wszystkim na stan rozpuszczania się białek. Większość enzymów
to globuliny wymagające do rozpuszczania obecności soli w stężeniu 0,05–0,2 mol/dm
3
. Zbyt duże
stężenie soli prowadzi do wysolenia białka, czyli jego wytrącenia.
Stężenie substratu – wpływa na szybkość reakcji wprost proporcjonalnie do stężeń cząstek rea-
gujących. Reakcja enzymu (E) z substratem (S) przebiega poprzez kompleks enzym–substrat (ES).
W 1913 roku Michaelis i Menten sformułowali równanie:

13. Enzymy
99
V –
szybkość reakcji,
V
max
– szybkość maksymalna reakcji,
[s] –
stężenie substratu,
K
m
– stała Michaelisa
Stała Michaelisa ma bardzo duże znaczenie i stanowi cechę charakterystyczną danego enzymu.
Wyraża się ją w mol/l. Jest to takie stężenie substratu, przy którym szybkość reakcji jest równa poło-
wie prędkości maksymalnej. Wynosi ono od 10
-2
do 10
-7
mol/l. Im wartość ta jest mniejsza, tym więk-
sze jest powinowactwo danego enzymu do substratu.
Wpływ stężenia enzymu – w warunkach, gdy substrat jest w nadmiarze (w początkowym sta-
dium reakcji), szybkość reakcji katalizowanej przez enzym jest wprost proporcjonalna do stężenia
enzymu. Przy nadmiarze substratu, kiedy wszystkie cząsteczki enzymu są w kompleksie ES, szybkość
reakcji jest wprost proporcjonalna do ilości enzymu.
Wpływ aktywatorów – aktywatory są to różnego rodzaju substancje niebiorące udziału w re-
akcji katalitycznej, lecz uczynniające enzymy lub zwiększające ich aktywność. Zalicza się do nich:
kationy niektórych metali, aniony reszt kwasowych, białka działające przez usunięcie inhibitora ma-
skującego grupy czynnej enzymu czy też czynniki regulujące potencjał oksydoredukcyjny.
Wpływ inhibitorów – katalityczna szybkość enzymu może być zmniejszona przez cząsteczki
inhibitora. Istnieje wiele inhibitorów, w tym metabolitów obecnych w warunkach fizjologicznych
w organizmie oraz leków i substancji obcych dla organizmu. Rozróżniamy dwa typy hamowania: nie-
odwracalne oraz odwracalne, które dzieli się na kompetycyjne i niekompetycyjne.
− Hamowanie nieodwracalne zachodzi przez inhibitory, które wiążą się z enzymem nieodwracalnie,
często tworzą kowalencyjne wiązania z resztami aminokwasów znajdującymi się w miejscu aktyw-
nym lub jego pobliżu i inaktywują enzym trwale. Przykładem może być: diizopropylofluorofosfo-
ran, składnik gazów bojowych działających na układ nerwowy, reagujący z resztą seryny w miejscu
aktywnym esterazy acetylocholinowej, nieodwracalnie hamując enzym i uniemożliwiając przeka-
zywanie impulsów nerwowych. Penicylina nieodwracalnie hamuje transpeptydazę peptydoglikanu
tworzącą poprzeczne wiązania w ścianie komórek bakteryjnych.
− Inhibitory kompetycyjne, inaczej współzawodniczące. Inhibitor jest analogiem strukturalnym
substratu i współzawodniczy z nim o jego centrum aktywne enzymu. Na zasadzie inhibitorów kom-
petycyjnych działa wiele leków, np. allopurinol (stosowany w leczeniu dny moczanowej), prostyg-
mina (pobudza kurczliwość jelit), teofilina (rozszerza oskrzela) czy kwas acetylosalicylowy (działa
przeciwzapalnie i przeciwzakrzepowo).
− Hamowanie niekompetycyjne – inhibitor nie jest analogiem strukturalnym substratu, natomiast
modyfikuje centrum aktywne enzymu lub inne miejsce w enzymie, np. przez fosforylację grup –OH
seryny, przez modyfikację grup tiolowych –SH, przez działanie metali ciężkich (np. arsen, rtęć, sre-
bro, ołów) w stężeniach wyższych niż 10
-3
mol/l, przez hamowanie enzymów zawierających jony
metali w centrum aktywnym. Inhibitory te nie są stosowane jako leki.
Oznaczanie aktywności enzymów pozwala na dokładną diagnostykę chorób. Aktywność enzy-
matyczną wykorzystuje się najczęściej w diagnostyce chorób serca i wątroby. Płynami fizjologiczny-
mi używanymi do badań są przeważnie osocze i surowica.
Powszechnie stosowaną jednostką aktywności enzymatycznej jest jednostka międzynarodowa
(IU), czyli ilość enzymu katalizująca przemianę 1 μmola substratu w czasie 1 minuty w optymalnych
warunkach reakcji enzymatycznej; zwykle przyjmuje się określone warunki: temperaturę 30°C, dane
pH i maksymalne wysycenie enzymu substratem. Do innych jednostek zalicza się katal, aktywność
właściwą, aktywność molową i liczbę obrotów.
13.2. Podział enzymów
W 1961 roku Komisja Enzymowa Międzynarodowej Unii Biochemicznej zaproponowała po-
dział enzymów, którego podstawą jest rodzaj katalizowanej reakcji. Wyróżnia się 6 klas głównych,
[s]
+
K
[s]
•
V
=
V
m
max

Część III. Płyny biologiczne i gospodarka wodno-elektrolitowa ...
100
dzielących się na kilka lub kilkanaście podklas. Każdemu enzymowi przyporządkowano systematycz-
ny numer kodu (EC) rozpoczynający się numerem klasy, podklasy, grupy i numeru kolejnego danego
enzymu w grupie. Klasy enzymów: oksydoreduktazy (katalizują reakcje oksydoredukcyjne), transfera-
zy (katalizują przenoszenie określonych grup z donora na akceptor), hydrolazy (katalizują hydrolizę
wiązań, czyli rozkład z udziałem cząsteczki wody), liazy (katalizują odłączanie grup od substratu bez
udziału wody), izomerazy (katalizują reakcje wewnątrzcząsteczkowego przegrupowania) i ligazy (ka-
talizują wytwarzanie wiązań).
W diagnostyce najczęściej używa się podziału enzymów według Richtericha i Hessa na enzymy
wskaźnikowe (komórkowe), sekrecyjne (pozakomórkowe) i ekskrecyjne. Enzymy wskaźnikowe są to
enzymy wewnątrzkomórkowe uwalniane w wyniku rozpadu komórki lub uszkodzenia błony komór-
kowej. Prawidłowo, w warunkach fizjologicznych nie występują w osoczu w ogóle lub tylko w ilo-
ściach śladowych. Ich obecność wskazuje na proces niszczenia tkanki. Najszybciej pojawiać się będą
enzymy cytoplazmatyczne, później mitochondrialne, jąder i lizosomów. Enzymy sekrecyjne są synte-
tyzowane przez komórki różnych narządów (głównie wątroby), a następnie wydzielane do krwi, gdzie
pełnią różnorodne funkcje. Obniżenie ich aktywności świadczy o niewydolności narządu syntetyzują-
cego i wydzielającego te enzymy. Natomiast enzymy ekskrecyjne są syntetyzowane przez gruczoły
i wydalane do płynów fizjologicznych. Ich pojawienie się w osoczu świadczy o zaburzeniu funkcji
gruczołu. W warunkach fizjologicznych są nieobecne w osoczu lub występują w ilościach śladowych.
13.3. Wybrane zagadnienia z diagnostyki enzymatycznej
W diagnostyce laboratoryjnej szczególne znaczenie odgrywają izoenzymy, które katalizują tę
samą reakcję, a różnią się budową, właściwościami fizykochemicznymi i immunologicznymi. Cechuje
je większa swoistość tkankowa w porównaniu z całą aktywnością enzymatyczną. Enzymy allosterycz-
ne zbudowane są z więcej niż jednego łańcucha polipeptydowego. Zależnie od liczby podjednostek
możliwa jest różna liczba kombinacji izoenzymów. W diagnostyce najczęściej oznaczane są izoenzy-
my kinazy kreatynowej, dehydrogenazy mleczanowej, fosfatazy zasadowej i kwaśnej oraz amylazy.
Do najważniejszych enzymów oznaczanych w diagnostyce laboratoryjnej zalicza się: dehydro-
genazę mleczanową (LDH), aminotransferazę asparaginianową (AST) i alaninową (ALT), kinazę kre-
atynową (CK), γ-glutamylotransferazę (γ-GT), amylazę, fosfatazę kwaśną i zasadową (ALP). Obecnie,
w przypadku chorób mięśnia sercowego oznacza się aktywność CK i białek: sercowej troponiny T i I
oraz mioglobiny. W przypadku schorzeń wątroby oznacza się aktyw-ność AST i ALT, γ-GT, ALP,
dehydrogenazy glutaminianowej (GLDH) i cholinoesterazy (ChE).
13.3.1. Kinaza kreatynowa
Kinaza kreatynowa (EC 2.7.3.2) jest zbudowana z podjednostek M – mięśniowej i B – mózgo-
wej. Istnieją trzy izoenzymy kinazy kreatynowej będące dimerami: CK-MB (sercowy), CK-MM (mięś-
niowy) i CK-BB (mózgowy), w związku z czym najwyższa jej aktywność występuje w mięśniach
szkieletowych, sercu i mózgu. Stwierdza się ją także w macicy, układzie moczowo-płciowym, płucach
i przewodzie pokarmowym. Występuje zarówno w cytoplazmie, jak i mitochondrium. Prawidłowy
zakres normy dla tego enzymu w surowicy krwi wynosi 40–285 IU/l dla mężczyzn i 55–370 IU/l dla
kobiet. W przebiegu zawału serca, zapalenia mięśnia sercowego, wsierdzia i osierdzia oraz dusznicy
bolesnej wzrasta aktywność całkowitej kinazy kreatynowej (CK), czemu towarzyszy wzrost aktywno-
ści izoenzymu sercowego (MB). W przypadku zawału mięśnia sercowego aktywność CK zwiększa się
już po 4 godzinach od wystąpienia zawału, a wzrost maksymalny przypada na około 20 godzinę. Za
kryterium rozpoznania zawału przyjmuje się wzrost aktywności całkowitej CK z udziałem frakcji
CK-MB ponad 6% aktywności całkowitej. Aktywność CK wzrasta także w przebiegu chorób mięśni
szkieletowych, do których zalicza się m.in. dystrofię mięśniową, zapalenie mięśni i urazy. Za kryte-
rium rozpoznania chorób mięśni szkieletowych przyjmuje się wzrost aktywności całkowitej CK
z udziałem frakcji CK-MB nieprzekraczający 6% aktywności całkowitej.
Podczas diagnostyki chorób serca należy przeprowadzać badania uzupełniające obejmujące
oznaczanie stężenia sercowej troponiny T, I, mioglobiny, aktywności dehydrogenazy mleczanowej –
izoenzymu sercowego (LDH
1
) i aminotransferazy asparaginowej (AST). Natomiast w przypadku cho-

13. Enzymy
101
rób mięśni szkieletowych badania należy uzupełnić o stężenie mioglobiny oraz aktywność dehydroge-
nazy mleczanowej (LHD
5
).
13.3.2. Dehydrogenaza mleczanowa
Dehydrogenaza mleczanowa (EC 1.1.1.27) zbudowana jest z określonych genetycznie podjed-
nostek H (sercowych) i M (mięśniowych). Wyróżniamy pięć izoenzymów LDH
1
(H4), LDH
2
(H3M),
LDH
3
(H2M2), LDH
4
(HM3) i LDH
5
(M4). Najwyższą aktywność stwierdza się w mięśniach szkiele-
towych, sercu, nerkach, mózgu i wątrobie. W mniejszym stopniu obserwuje się ją także w śledzionie,
płucach, nadnerczach, trombocytach, leukocytach i erytrocytach. Jest enzymem cytoplazmatycznym.
Prawidłowa aktywność w surowicy krwi wynosi 120–230 IU/l.
Z uwagi na wszechobecność w organizmie dehydrogenaza mleczanowa nie należy do istotnych
parametrów diagnostycznych. Jej aktywność wzrasta w chorobach serca, mięśni szkieletowych, wą-
troby i dróg żółciowych oraz w przebiegu chorób hematologicznych. Wyższą aktywność stwierdza się
także w przebiegu choroby nowotworowej i zatorze płucnym.
13.3.3. Aminotransferaza asparaginowa
Aminotransferaza asparaginowa (EC 2.6.1.1) ma najwyższą aktywność w wątrobie, sercu
i mięśniach szkieletowych. Występuje w mitochondrium i cytoplazmie hepatocytów oraz w komór-
kach mięśniowych, kanalikach nerkowych i erytrocytach. Prawidłowa aktywność w surowicy krwi
wynosi 5–40 IU/l. Największy wzrost aktywności obserwuje się w schorzeniach wątroby, obejmują-
cych m.in. ostre zapalenie wątroby, marskość i cholestazę, a także w zawale mięśnia sercowego.
Aktywność wzrasta także po zatruciu związkami chemicznymi i grzybami.
13.3.4. Aminotransferaza alaninowa
Aminotransferaza alaninowa (EC 2.6.1.2) szczególnie obficie występuje w cytoplazmie komó-
rek wątrobowych, a także w sercu i mięśniach. Wyróżnia się również izoenzym mitochondrialny.
Prawidłowy zakres aktywności w surowicy krwi wynosi 5–40 IU/l. Największy wzrost aktywności
obserwuje się w przebiegu chorób wątroby, m.in. ostrego zapalenia, toksycznego uszkodzenia hepato-
cytów, cholestazie, marskości, nowotworach i stłuszczeniu wątroby.
Dla oceny stopnia uszkodzenia wątroby wyznacza się stosunek aktywności AST/ALT – wskaź-
nik de Ritisa. W przebiegu ostrego wirusowego zapalenia jest on niższy od 0,7, zaś w przypadku mar-
twicy komórek wątrobowych – wyższy od 0,7. W alkoholowym zapaleniu wątroby wynosi około 2,
natomiast w zawale mięśnia sercowego – powyżej 1. W ciężkim uszkodzeniu wątroby obserwuje się
ponad 100-krotny wzrost aktywności AST i ALT, natomiast 3–4-krotny w chorobach przewlekłych
wątroby.
13.3.5. γ-Glutamylotransferaza
γ-Glutamylotransferaza (EC 2.3.2.2) jest enzymem związanym z błoną komórkową. Najwyższą
aktywność stwierdza się w wątrobie oraz w nerkach, trzustce, jelicie cienkim, płucach i śledzionie.
Prawidłowa aktywność w surowicy krwi wynosi 18–100 IU/l dla mężczyzn i 10–66 IU/l dla kobiet.
Zmiany aktywności tego enzymu są ściśle skorelowane ze zmianami aktywności fosfatazy zasadowej.
Największy wzrost aktywności towarzyszy ostrym i przewlekłym chorobom wątroby i występuje
w przebiegu chorób dróg żółciowych i trzustki, szczególnie związanych z zastojem w drogach odpro-
wadzających.
13.3.6. Fosfataza zasadowa
Fosfataza zasadowa (EC 3.1.3.1) składa się z trzech genetycznie określonych izoenzymów. Wy-
różnia się postać wątrobowo-kostną, nerkową, jelitową i łożyskową. Występują także postacie nieuwa-
runkowane genetycznie – wywodzące się z dróg żółciowych i guzów. Prawidłowa aktywność w suro-
wicy wynosi 20–150 IU/l dla dzieci i 20–70 IU/l dla dorosłych.
Fizjologiczny wzrost aktywności występuje u kobiet w ciąży. Pojawiający się wówczas izoen-
zym łożyskowy zanika po porodzie. U dzieci przeważa postać kostna, a u osób starszych – wątrobowa.

Część III. Płyny biologiczne i gospodarka wodno-elektrolitowa ...
102
Największy wzrost aktywności obserwuje się w przebiegu chorób wątroby i dróg żółciowych (ALP
wątrobowa) oraz chorób kości (ALP kostna).
13.3.7. Dehydrogenaza glutaminianowa
Dehydrogenaza glutaminianowa (EC 1.4.1.3) występuje przede wszystkim w wątrobie. Znajdu-
je się wyłącznie wewnątrz mitochondriów. Jej aktywność wzrasta w żółtaczce mechanicznej oraz cho-
robach wątroby, takich jak nowotwór oraz jego przerzuty do wątroby, stłuszczenie i marskość wątro-
by, zastój żółci. Aktywność GLDH wzrasta także przy ostrym zatruciu grzybami, tetrachlorkiem
węgla, związkami arsenu i halotanem (środek usypiający).
13.3.8. Cholinoesteraza
Cholinoesteraza (ChE, EC 3.1.1.7) i pseudocholinoesteraza (EC 3.1.1.8) występują w powiąza-
niu z receptorami acetylocholiny w ośrodkowym i obwodowym układzie nerwowym oraz w płytkach
motorycznych mięśni i erytrocytach. Aktywność ChE wzrasta w przebiegu chorób związanych z utratą
białek, tj. w zespole nerczycowym oraz w przebiegu cukrzycy, hipertriacyloglicerydemii i stłuszczeniu
wątroby, natomiast obniża się w przebiegu marskości i zapaleniu wątroby, czemu towarzyszy obniżo-
na zdolność wytwórcza wątroby. Spadek aktywności występuje także po zatruciu fosforanami orga-
nicznymi i pod wpływem leków – inhibitorów ChE (np. fizostygminy, cyklofosfamidu).
13.3.9. Fosfataza kwaśna
Fosfataza kwaśna (EC 3.1.3.2) w osoczu występuje w postaci 5 izoenzymów. Największe zna-
czenie mają izoenzymy kostny i pochodzący z gruczołu krokowego, pozostałe pochodzą z wątroby
i nerek. Prawidłowa całkowita aktywność fosfatazy kwaśnej w surowicy krwi wynosi 2–10 IU/l. Pod-
wyższenie tej wartości towarzyszy chorobie Pageta, akromegalii, szpiczakowi, występuje także u cho-
rych z osteolizą spowodowaną nowotworami kości. Znaczenie diagnostyczne posiada również izoen-
zym z gruczołu krokowego. U zdrowych mężczyzn stanowi on około 30% całkowitej aktywności fos-
fatazy kwaśnej w osoczu. Oznaczanie aktywności tego izoenzymu zaleca się w monitorowaniu lecze-
nia chorych z rakiem gruczołu krokowego naciekającym tkanki około gruczołowe.
13.3.10. Amylaza
Amylaza (EC 3.2.1.1) należy do enzymów ekskrecyjnych, wydzielanych do światła przewodu
pokarmowego, tylko niewielka ilość dostaje się do krążenia. α-amylaza występuje w trzustce, ślinian-
kach, wątrobie, mięśniach i neutrofilach. Aktywność izoenzymu trzustkowego α-amylazy wzrasta
w ostrym zapaleniu trzustki i guzach trzustki. W zapaleniu ślinianek lub zamknięciu przewodu wy-
prowadzającego we krwi wzrasta aktywność izoenzymu ślinowego α-amylazy. Wzrost aktywności
α-amylazy we krwi powoduje jej wydalanie z moczem przez nieuszkodzone kłębuszki nerkowe, co
może być przyczyną białkomoczu przednerkowego. Aktywność tego enzymu w moczu jest więc do-
brym odzwierciedleniem poziomu we krwi i przy nieupośledzonej funkcji nerek jest wykorzystywana
w monitorowaniu ostrego zapalenia trzustki z uwagi na łatwą dostępność materiału badanego, jakim
jest mocz. Prawidłowe wartości w surowicy krwi mieszczą się w zakresie 25–125 IU/l, a w moczu
poniżej 650 IU/l.
P i ś m i e n n i c t w o
1. Bańkowski E. Biochemia. Podręcznik dla studentów uczelni medycznych. Wydawnictwo Medyczne
Urban & Partner, Wrocław 2004, s. 48–89.
2. Diagnostyka laboratoryjna. Red. B. Neumeister, I. Besenthal, H. Liebich. Wydawnictwo Medyczne
Urban & Partner, Wrocław 2001, s. 52–70.
3. Diagnostyka laboratoryjna z elementami biochemii klinicznej. Red. A. Dębińska-Kieć, J. Naskalski
Urban & Partner, Wrocław 2002, s. 173–193.
14. WYBRANE BADANIA LABORATORYJNE
Aleksandra Kasperczyk, Sławomir Kasperczyk
Badania laboratoryjne mają ogromne znaczenie w rozpoznawaniu chorób, monitorowaniu ich
przebiegu oraz określaniu skuteczności leczenia. Mogą dotyczyć pojedynczej analizy, profilu badań
kontrolnych (np. morfologia krwi) oraz profili narządowych. Do najczęściej oznaczanych należy profil
wątrobowy, na który składa się najczęściej oznaczanie aktywności aminotransferaz (AST, ALT),
γ-GT, ALP, stężenia bilirubiny i albuminy. Znajomość podstawowych zagadnień związanych z analizą
laboratoryjną, w tym znajomość wartości referencyjnych daje możliwość łatwiejszej interpretacji uzy-
skanych wyników.
Wartości referencyjne są pojęciem statystycznym i obejmują 95% badanej populacji ludzi
zdrowych. Ich znajomość pozwala na kliniczną ocenę pojedynczych wyników badań laboratoryjnych
oraz na wskazanie prawdopodobieństwa czy wynik jest prawidłowy, czy patologiczny. Zakresy więk-
szości wartości referencyjnych zależą od: płci i wieku, pory dnia lub stanów fizjologicznych, metody-
ki oraz błędu precyzji metody (tab. VII).
Tabela VII. Wartości referencyjne stężeń wybranych składników osocza i surowicy krwi
Składnik
Zakres normy
Zakres normy
Sód
135–145 mmol/l
–
Potas
3,5–5,0 mmol/l
–
Wapń
2,1–2,6 mmol/l
8,5–10,5 mg/dl
Żelazo
12,5–26,9 µmol /l
70–150 µg/dl
Glukoza
3,4–5,6 mmol/l
60–100 mg/dl (mg%)
Hemoglobina
7,5–9,9 mmol/l
12–16 g/dl (g%)
Bilirubina
3,4–17,0 µmol/l
0,2–1,0 mg/dl
Białko
60–80 g/l
6–8 g/dl
Albuminy
35–50 g/l
3,5–5 g/dl
Mocznik
2,5–6,5 mmol/l
15–40 mg/dl
Kreatynina
60–130 µmol/l
0,7–1,5 mg/dl
Kwas moczowy
180–360 µmol/l
3–6 mg/dl
Cholesterol
< 5,0 mmol/l
< 190 mg/dl
Cholesterol HDL ♂
Cholesterol HDL ♀
> 1,0 mmol/l
> 1,2 mmol/l
> 40 mg/dl
> 45 mg/dl
Cholesterol LDL
< 3,0 mmol/l
< 115 mg/dl
Triacyloglicerole
0,46–1,71 mmol/l
40–150 mg/dl

Część III. Płyny biologiczne i gospodarka wodno-elektrolitowa ...
104
14.1. Płyn biologiczny jako materiał badawczy
Najczęściej badania laboratoryjne wykonywane są w podstawowych płynach biologicznych –
krwi i moczu. Krew jako materiał badawczy może być wykorzystana do badań jako pełna krew oraz
po rozdzieleniu za pomocą wirowania, w zależności od warunków, na:
− surowicę – krew pobiera się do suchej szklanej lub plastikowej probówki, zawierającej czynniki
aktywujące proces wykrzepiania; po wyrzepieniu krew należy odwirować, uzyskany płyn nad
skrzepem to surowica;
− osocze – do jego pozyskania niezbędne jest dodanie do probówki czynnika przeciwkrzepliwego,
czyli tzw. antykoagulantu (może nim być wersenian potasowy, czyli EDTA, heparyna, cytrynian);
po odwirowaniu krwi pełnej i oddzieleniu elementów komórkowych otrzymujemy osocze.
Surowica różni się od osocza brakiem fibrynogenu.
Podstawowe przeliczniki biochemiczne:
1 g = 1000 mg; 1 mg = 1000
μg
miligramprocent (mg%) to liczba miligramów substancji w 100 ml roztworu (mg/dl)
mikrogramprocent (
μg%) to liczba mikrogramów substancji w 100 ml roztworu (μg/dl)
14.2. Zasady zachowania się w pracowni biochemicznej
Pracę w laboratorium należy wykonywać w fartuchu ochronnym. Z uwagi na kontakt z ma-
teriałem biologicznym powinno używać się jednorazowych rękawiczek gumowych. Przed przystąpie-
niem do wykonywania oznaczenia należy zaznajomić się z zasadą metody oraz przeanalizować kolej-
ne jego etapy. Ostrożnie korzystać z instalacji gazowej. Nie wolno zapalać ognia, jeżeli pracuje się
z substancjami łatwopalnymi (eter, aceton, benzen). Należy wygaszać nieużywane palniki. Podczas
ogrzewania nad płomieniem palnika nieustannie potrząsać probówką uważając, aby jej wylot nie był
skierowany w kierunku wykonującego badanie ani w stronę innych osób. Objętość cieczy nie powinna
przekraczać 1/3 objętości probówki. Ogrzewane naczynia szklane powinno się stawiać na płytce
metalowej. Wszystkie czynności ze stężonymi kwasami należy przeprowadzać pod sprawnie
działającym wyciągiem ze szczególną ostrożnością. Pamiętać, aby nie wlewać wody do kwasów.
Pracując z odczynnikami chemicznymi, potencjalnymi truciznami, myć często ręce w czasie i po
pracy. Po zakończonych ćwiczeniach należy posprzątać stanowisko pracy i umyć szkło laboratoryjne
wodą z detergentem używając szczoteczek, a następnie dokładnie wypłukać i trzykrotnie przemyć
wodą destylowaną.
Oparzenia skóry kwasem lub alkaliami należy przemyć szybko dużą ilością chłodnej wody. Na
oparzoną skórę (płomień, gorące szkło) puścić strumień zimnej wody w celu ochłodzenia termicznego
oparzonego miejsca. Oko zanieczyszczone chemikaliami obficie przepłukać wodą.
14.3. Podstawowe umiejętności praktyczne niezbędne w laboratorium biochemicznym
14.3.1. Pipetowanie
Do odmierzania roztworów możemy używać pipet
szklanych i automatycznych. Do każdego roztworu uży-
wamy oddzielnej pipety, a w przypadku pipet automatycz-
nych zmieniamy końcówki. Do napełniania szklanych pipet
używamy tłoków. Nigdy nie naciągamy cieczy ustami.
Odmierzając roztwór napełniamy szklaną pipetę powyżej
kreski kalibracyjnej i doprowadzamy do niej górny menisk,
potem przenosimy odmierzoną ciecz. Przy użyciu pipet
automatycznych należy nastawić żądaną objętość pokrę-
tłem poniżej przycisku pipetowania. Na przycisku podany
jest zakres objętości dla danej pipety. Aktualnie nastawiona
pojemność pokazywana jest w okienku licznika w mikroli-
Ryc. 23. Pipety automatyczne wraz z jedno-
razowymi końcówkami

14. Wybrane badania laboratoryjne
105
trach (μl). Nie wolno ustawiać pojemności mniejszej ani większej niż podany zakres, ponieważ może
to spowodować uszkodzenie pipety.
14.3.2. Wirowanie
Celem tej czynności jest oddzielenie od rozpuszczalnika sub-
stancji zawartej w roztworze. Wykorzystuje się tutaj zwiększenie
siły przyciągania ziemskiego przez siłę odśrodkową działającą na
wirowaną probówkę. Za jednostkę tej siły przyjmuje się przyspie-
szenie ziemskie i określa się, ile razy siła odśrodkowa (G) jest
większa od przyciągania ziemskiego. Do wirowania wykorzystuje
się wartość G lub w przeliczeniu na liczbę obrotów rotora wirówki
na minutę (np. 3000/min). Do wirowania używać probówek wi-
rowniczych z tworzyw sztucznych (polipropylen), rzadziej szkla-
nych, które należy umieścić bardzo ostrożnie w gilzach. Poziom
cieczy w probówkach powinien być co najmniej 1 cm poniżej ich
brzegu. Przed przystąpieniem do wirowania należy starannie zrów-
noważyć naprzeciwległe probówki z oprawkami i zawartością cie-
czy (poziom cieczy w tarowanych probówkach powinien być
zbliżony).
14.3.3. Kolorymetria
Najczęściej do oznaczania stężenia substancji wykorzystuje się metody kolorymetryczne. Nale-
żą one do szybkich i łatwych technik analitycznych, wykorzystujących liniową zależność pomiędzy
intensywnością zabarwienia roztworu a stężeniem zawartej w nim substancji. Metodami tymi można
oceniać stężenie zarówno substancji barwnych, jak i bezbarwnych. W drugim przypadku substancję
bezbarwną należy przeprowadzić w związek barwny
w określonych reakcjach chemicznych. Absorbancja
(A) (pochłanialność) światła monochromatycznego jest
wprost proporcjonalna do grubości warstwy (l) i stęże-
nia roztworu (c). Umożliwia to obliczenie stężenia
związku w płynie biologicznym za pomocą spektrofo-
tometru. Przy takiej samej grubości warstwy roztwo-
rów o nieznanym (próba badana) i znanym stężeniu
(wzorzec) absorbancje będą proporcjonalne do ilości
substancji zawartych w tych roztworach. Stężenie
w próbie badanej możemy obliczyć z proporcji lub wy-
korzystując krzywą kalibracyjną, która podaje zależ-
ność absorbancji roztworu od ilości zawartej w nim
określonej substancji w formie wykresu.
14.4. Oznaczanie wybranych wskaźników biochemicznych we krwi i moczu
14.4.1. Wykrywanie składników patologicznych moczu za pomocą testów paskowych
O d c z y n n i k i, s p r z ę t i m a t e r i a ł:
1) mocz fizjologiczny
2) mocz patologiczny zawierający białko
3) mocz patologiczny zawierający związki ketonowe
4) mocz patologiczny zawierający glukozę
5) paski testowe
Ryc. 24. Wirówka
Ryc. 25. Spektrofotometry

Część III. Płyny biologiczne i gospodarka wodno-elektrolitowa ...
106
W y k o n a n i e:
Do 4 probówek wlać po około 5 ml wymienionych próbek moczu, zanurzyć pasek na około 10 s. Po-
równać zabarwienia z barwami wzorcowymi umieszczonymi na opakowaniu pasków (ryc. 26).
14.4.2. Wykrywanie składników patologicznych moczu
14.4.2.1. Wykrywanie białka z zastosowaniem kwasu
sulfosalicylowego
O d c z y n n i k i, s p r z ę t i m a t e r i a ł:
1) mocz fizjologiczny
2) mocz patologiczny zawierający białko
3) 20% roztwór kwasu sulfosalicylowego
4)
probówka 10 ml 2 szt.
5) pipeta automatyczna 1–5 ml (lub szklana 1–10 ml)
W y k o n a n i e:
Do probówki wlać 2 ml moczu patologicznego i wprowadzić kilka kropli roztworu kwasu sulfosalicy-
lowego. Pojawi się zmętnienie. Następnie wstrząsnąć probówką i odstawić na kilka minut, aż osad
opadnie na dno. Próba ta jest bardzo czuła, a stopień zmętnienia i ilość osadu są proporcjonalne do
zawartości białka.
Równocześnie przeprowadzić badanie z moczem fizjologicznym.
14.4.2.2. Wykrywanie cukrów z odczynnikiem Nylandera
O d c z y n n i k i, s p r z ę t i m a t e r i a ł:
1) mocz fizjologiczny
2) mocz patologiczny zawierający cukry redukujące (glukozę)
3) odczynnik Nylandera
4) probówka 10 ml 2 szt.
5) pipeta automatyczna 1–5 ml (lub szklana 1–10 ml)
6) pipeta automatyczna 0,1–1 ml (lub szklana 0,1–1 ml)
W y k o n a n i e:
Do probówki wlać 2 ml moczu, wprowadzić 0,4 ml odczynnika Nylandera i ogrzać nad palnikiem do
wrzenia. Podczas podgrzewania roztwór ciemnieje, a następnie wytrąca się czarny osad metalicznego
bizmutu. Ciecz nad osadem może być klarowna i mieć barwę brunatną.
Równocześnie przeprowadzić badanie z moczem fizjologicznym.
14.4.2.3. Wykrywanie ciał ketonowych
O d c z y n n i k i, s p r z ę t i m a t e r i a ł:
1) mocz fizjologiczny
2) mocz patologiczny zawierający ciała ketonowe
3) roztwór 2,4-dinitrofenylohydrazyny
4) probówka 10 ml 2 szt.
5) pipeta automatyczna 1–5 ml (lub szklana 1–10 ml)
Ryc. 26. Testy paskowe do badania moczu

14. Wybrane badania laboratoryjne
107
W y k o n a n i e:
Do probówki wlać 2 ml moczu i wprowadzić 2 ml roztworu 2,4-dinitrofenylohydrazyny. Pojawi
się osad o zabarwieniu żółtym.
Równocześnie przeprowadzić badanie z moczem fizjologicznym.
14.4.3. Rozdział pełnej krwi, przygotowywanie hemolizatu i zawiesiny krwinek
O d c z y n n i k i, s p r z ę t i m a t e r i a ł:
1) pełna krew ludzka lub barania
2) 0,9% NaCl (sól fizjologiczna)
3) woda destylowana
4) probówka 10 ml 7 szt.
5) pipeta automatyczna 1–5 ml
6) pipeta automatyczna 0,1–1 ml
7) wirówka
W y k o n a n i e:
Odmierzyć 2 ml krwi pełnej. Po wyważeniu wirówki probówką z 2 ml wody wirować krew przez
4 minuty (2000 obrotów/min).
Odciągnąć pipetą oddzielone osocze do osobnej probówki, a uzyskane krwinki zalać solą fizjologiczną
do 5 ml i wymieszać.
Następnie ponownie odwirować w wirówce przez 4 minuty (2000 obrotów/min). Supernatant (płyn
znad osadu krwinek) odciągnąć pipetą i wylać.
Pobrać 300
μl (0,3 ml) krwinek i zalać je 5 ml wody destylowanej i silnie wytrząsać przez około
30 sekund uzyskując hemolizat krwinek.
Pozostałe krwinki zalać 5 ml soli fizjologicznej uzyskując zawiesinę krwinek.
Porównać i opisać właściwości krwi pełnej, osocza, zawiesiny i hemolizatu.
14.4.4. Oznaczanie glukozy w pełnej krwi za pomocą glukometru
O d c z y n n i k i, s p r z ę t i m a t e r i a ł:
1) przyrząd do nakłucia opuszki palca,
2) chusteczka papierowa,
3) paski testowe,
4) glukometr (ryc. 27).
W y k o n a n i e:
Umyć ręce wodą i mydłem, dokładnie wytrzeć i osuszyć.
Wyjąć z folii aluminiowej pasek testowy i włożyć koniec
ze stykami kontaktowymi do glukometru dopychając do
oporu.
Glukometr włącza się automatycznie i jest gotowy do
badania.
Nakłuć boczną powierzchnię opuszki palca nożykiem lub igłą. Poczekać aż pojawi się kropla krwi
i złożyć kroplę krwi w strefie aktywnej elektrody. Nie wolno dotykać palcem tej strefy bezpośrednio.
Test rozpoczyna się automatycznie i wynik jest wyświetlany po około 20 sekundach w zależności od
typu glukometru.
Należy zapisać wynik i porównać z wartościami referencyjnymi.
Zakres pomiarów 20–600 mg/dl (1,1–33,3 mmol/l).
Wartości referencyjne: 70–110 mg/dl (3,9–6,1 mmol/l).
Ryc. 27. Glukometry i testy paskowe

Część III. Płyny biologiczne i gospodarka wodno-elektrolitowa ...
108
14.4.5. Oznaczanie stężenia białka w surowicy krwi metodą biuretową
O d c z y n n i k i, s p r z ę t i m a t e r i a ł:
1) odczynnik biuretowy
2) roztwór albuminy 60 g/l
3) surowica
4) probówka 10 ml 2 szt.
5) pipeta automatyczna 1–5 ml (lub szklana 1–10 ml)
6) pipeta automatyczna 0,1–1 ml (lub szklana 0,1–1 ml)
Białka i peptydy zawierające wiązania peptydowe tworzą w środowisku zasadowym z jonami
Cu
2+
barwne kompleksy. Nazwa „reakcja biuretowa” pochodzi od biuretu, czyli dimocznika (produktu
kondensacji dwóch cząsteczek mocznika), który daje reakcję barwną z Cu
2+
w środowisku alkalicz-
nym.
W y k o n a n i e:
Probówki oznaczyć literami: B – próba badana, S – próba standardowa, K – próba kontrolna.
Do probówki B dodać 0,1 ml surowicy i 5 ml odczynnika biuretowego.
Do probówki S dodać 0,1 ml roztworu wzorcowego i 5 ml odczynnika biuretowego.
Do probówki K dodać 0,1 ml wody destylowanej i 5 ml odczynnika biuretowego.
Pozostawić w temperaturze pokojowej przez 15 min. Porównać powstałe zabarwienia.
14.4.6. Wykrywanie katalazy w pełnej krwi
O d c z y n n i k i, s p r z ę t i m a t e r i a ł:
1) pełna krew
2) woda destylowana
3) 3% nadtlenek wodoru (woda utleniona)
4) pipety
5) probówki szklane
6) palnik gazowy
W y k o n a n i e:
Odmierzyć do dwóch probówek po 2 ml wody destylowanej i do każdej dodać kroplę krwi. Za-
wartość jednej z probówek zagotować, ostudzić. Następnie do każdej probówki dodać 1 ml roztworu
wody utlenionej i obserwować zachodzące reakcje.
14.4.7. Oznaczanie stężenia hemoglobiny we krwi
O d c z y n n i k i, s p r z ę t i m a t e r i a ł:
1) pełna krew
2) roztwór standardowy hemoglobiny
3) odczynnik Drabkina
W y k o n a n i e:
Opisać 3 probówki: kontrolna, badana i standardowa.
Odmierzyć po 4 ml odczynnika Drabkina za pomocą pipety do każdej probówki.
Do próbki badanej dodać 0,02 ml krwi (20
μl) mikropipetą (lub pipetą automatyczną).
Do próbki standardowej dodać 0,02 ml standardu (20
μl) mikropipetą (lub pipetą automatyczną).
Wymieszać i odstawić na 10 minut.
Wyzerować spektrofotometr przy długości fali
λ = 540 nm wobec odczynnika Drabkina jako próby
kontrolnej. Dokonać pomiaru absorbancji (A) próby badanej i kontrolnej wobec próby kontrolnej.

14. Wybrane badania laboratoryjne
109
O b l i c z a n i e w y n i k ó w:
stężenie hemoglobiny =
standardu
st
•
ej
standardow
próby
A
badanej
próby
A
ężenie
Wartości referencyjne: 12–16 g/dl
14.4.8. Oznaczanie stężenia cholesterolu w surowicy krwi
O d c z y n n i k i, s p r z ę t i m a t e r i a ł:
1) surowica krwi
2) roztwór standardowy cholesterolu
3) odczynnik roboczy
W y k o n a n i e:
Opisać 3 probówki: kontrolna, badana i standardowa.
Odmierzyć po 2 ml odczynnika roboczego za pomocą pipety do każdej probówki.
Do próbki badanej dodać 0,02 ml (20
μl) surowicy krwi mikropipetą (lub pipetą automatyczną).
Do próbki standardowej dodać 0,02 ml (20
μl) standardu mikropipetą (lub pipetą automatyczną).
Wymieszać i wstawić do łaźni wodnej na 10 minut.
Wyzerować spektrofotometr przy długości fali
λ = 500 nm wobec odczynnika roboczego jako próby
kontrolnej. Dokonać pomiaru absorbancji (A) próby badanej i kontrolnej wobec próby kontrolnej.
O b l i c z a n i e w y n i k ó w:
stężenie cholesterolu =
Wartości referencyjne: 3,6–5,2 mmol/l (140–200 mg%).
Piśmiennictwo
1. Ćwiczenia praktyczne z biochemii. Skrypt dla studentów II roku Wydziału Lekarskiego z Oddziałem
Lekarsko-Dentystycznym. Red. E. Birkner. Wydawnictwo SUM, Katowice 2008, s. 22, 84, 100–
–101, 124–125, 139–143, 173, 176, 188.
2. Jakubowski Z., Kabata J., Kalinowski L., Szczepańska-Konkel M., Angielski S. Badania laborato-
ryjne w codziennej praktyce wartości referencyjne i interpretacje. MAK med, Gdańsk 1993, s. 13–
–23.
3. Tomaszewski J. Diagnostyka laboratoryjna. Wydawnictwo Lekarskie PZWL, Warszawa 2001,
s. 19–26.
standardu
stężenie
•
ej
standardow
próby
A
badanej
próby
A
Wyszukiwarka
Podobne podstrony:
BIOCHEMIA Podstawy Biochemii Dla Ochrony Srodowiska UW
Podstawy biochemii
Nadzór pedagogiczny, PODSTAWY PRAWA DLA PEDAGOGA
Kardiolodzy apelują o standardy dla ratowników medycznych, MEDYCYNA, RATOWNICTWO MEDYCZNE, BLS, RKO
Podstawa programowa dla gimnazjum
Charakterystyka nowej podstawy programowej dla przedszkoli i klas początkowych, Współczesne koncepcj
Podstawowe wyzwania dla spowiedników w Polsce, odnowa-charyzmaty
PODSTAWOWE INFORMACJE DLA PRACOWNIKA W DZIEDZIENIE BHP
Podstawy alergologii, Studia - ratownictwo medyczne, 3 rok, Podstawy alergologii i immunologii
Formularz zgloszenia na Kurs dla ratownikow medycznych
Podstawy biochemii
rozpisany zgodny z podstawa ramowy dla 5, Ramowe rozkłady dnia w przedszkolu
Biochemia i toksykologia, STUDIA, WIŚ PK, Podstawy Biochemi
DROGI I ULICE PODSTAWY mater dla stud X 2011
nowa podstawa programowa dla umierkowanych, nacznych i ze sprzężeniami rozporzadzenie 20081223 zal 7
więcej podobnych podstron